Периодическая система Д.И. Менделеева (Занятие 3) презентация
Содержание
- 2. Периодический закон: свойства элементов, а также свойства образуемых ими соединений находятся
- 3. Периодическая система (таблица) - это графическое выражение Периодического закона.
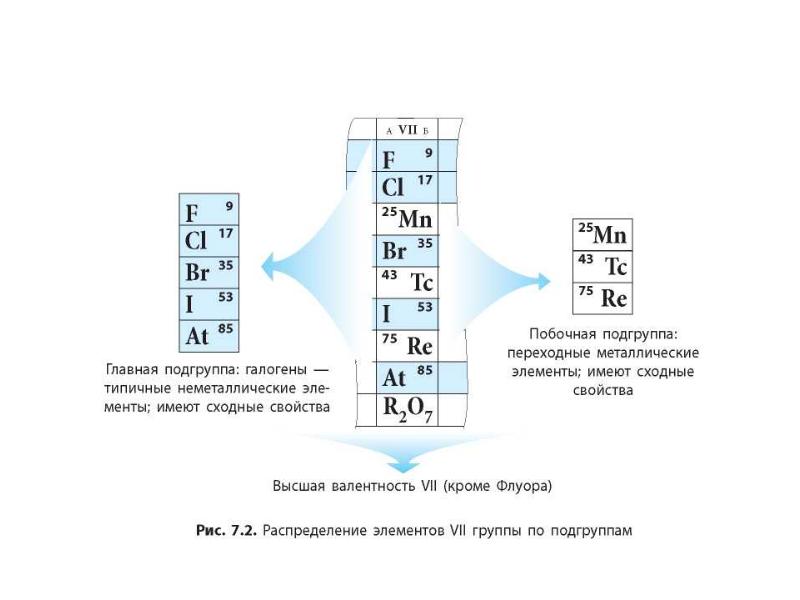
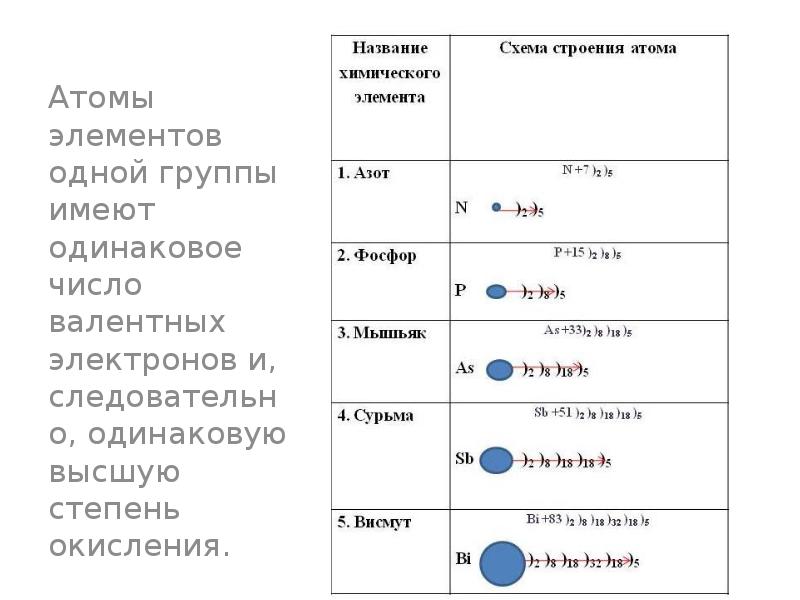
- 7. Группы - вертикальные столбцы. В периодической системе 8 групп. Группы
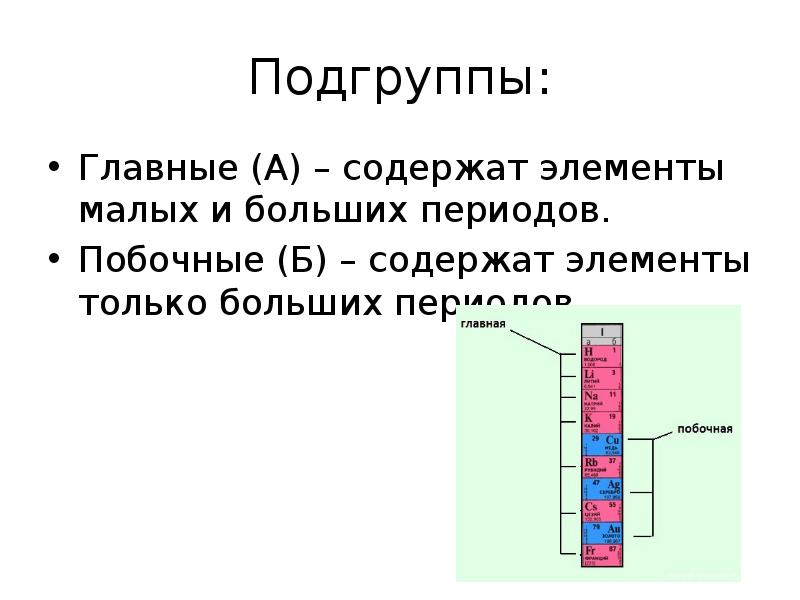
- 8. Подгруппы: Главные (А) – содержат элементы малых и больших периодов. Побочные
- 11. Период - Горизонтальный ряд элементов, расположенных в порядке возрастания зарядов
- 13. Каждый период начинается щелочным металлом и заканчивается инертным газом.
- 14. Номер периода указывает на число энергетических уровней, на которых расположены электроны
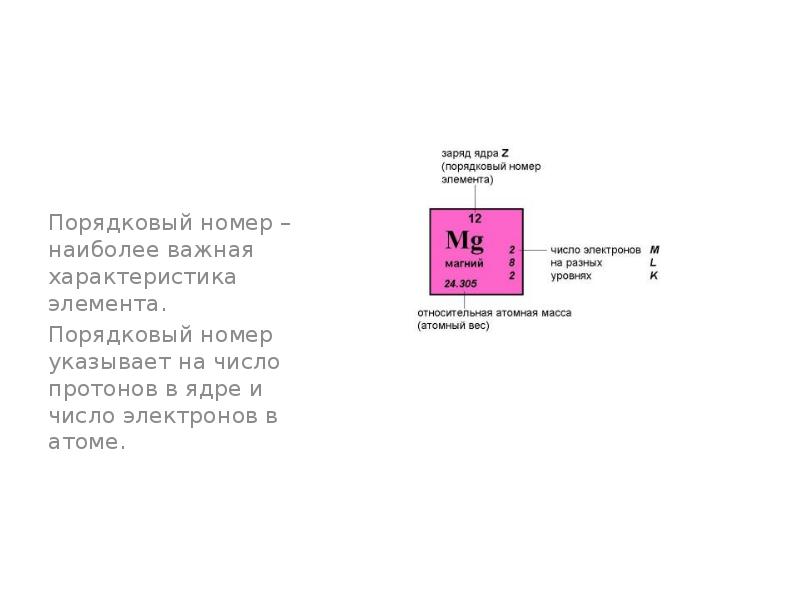
- 16. На что указывает порядковый номер элемента?
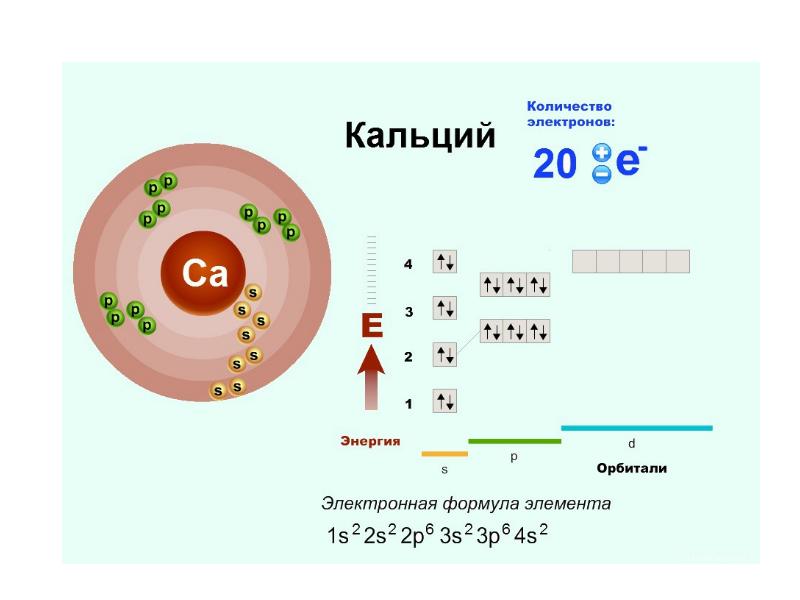
- 17. Порядковый номер элемента указывает на общее число электронов атоме.
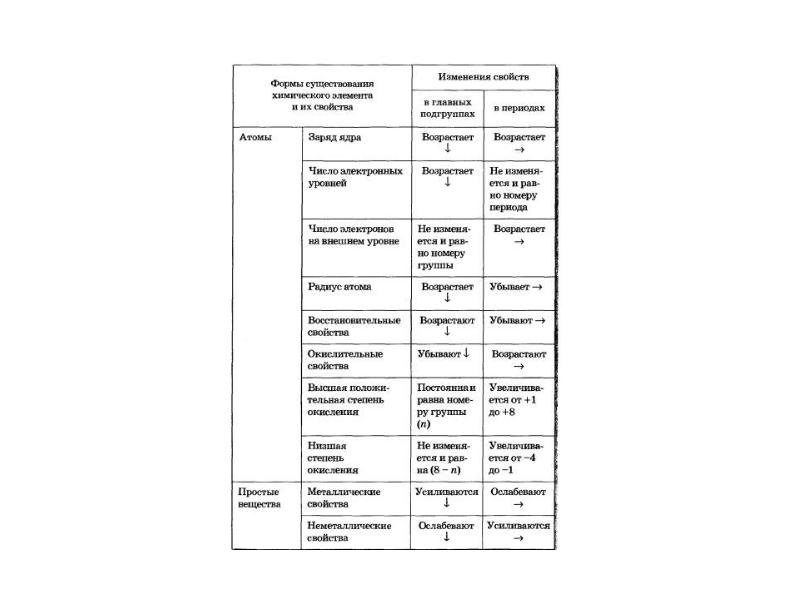
- 18. Изменение свойств элементов в главных подгруппах и периодах
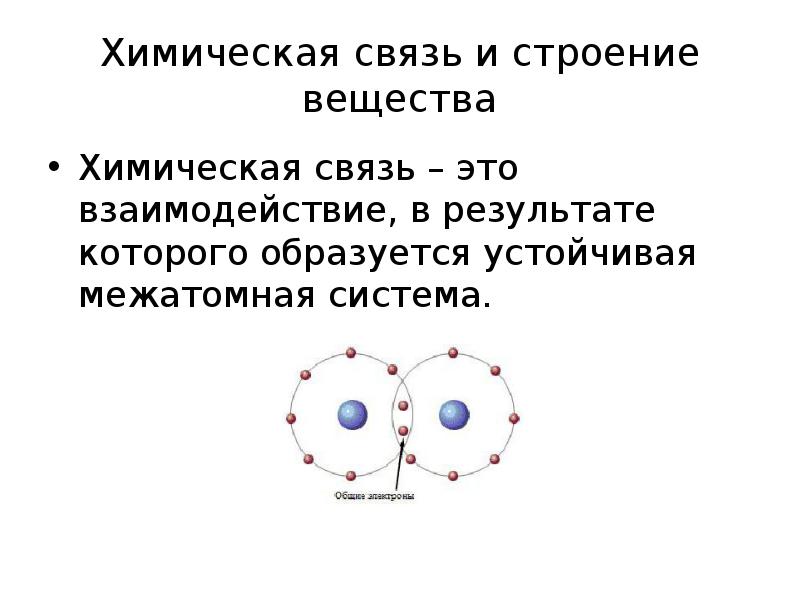
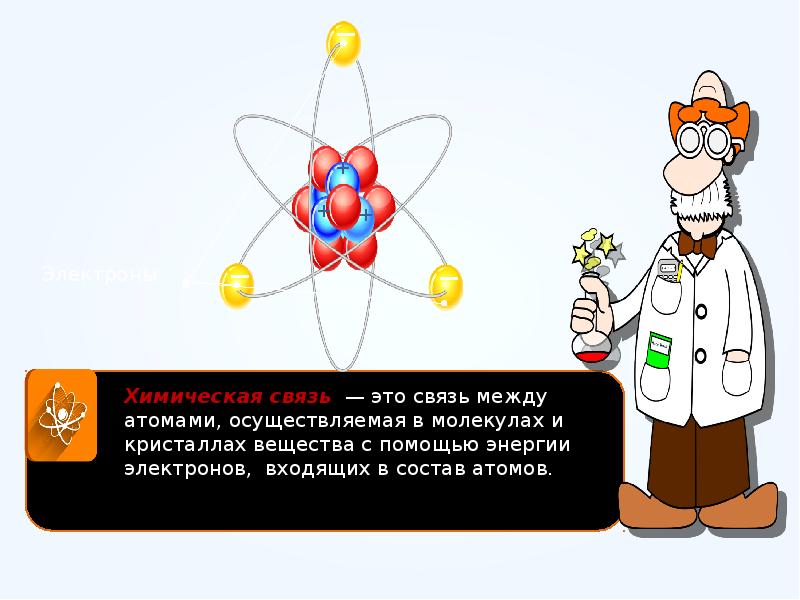
- 19. Химическая связь и строение вещества Химическая связь – это взаимодействие, в
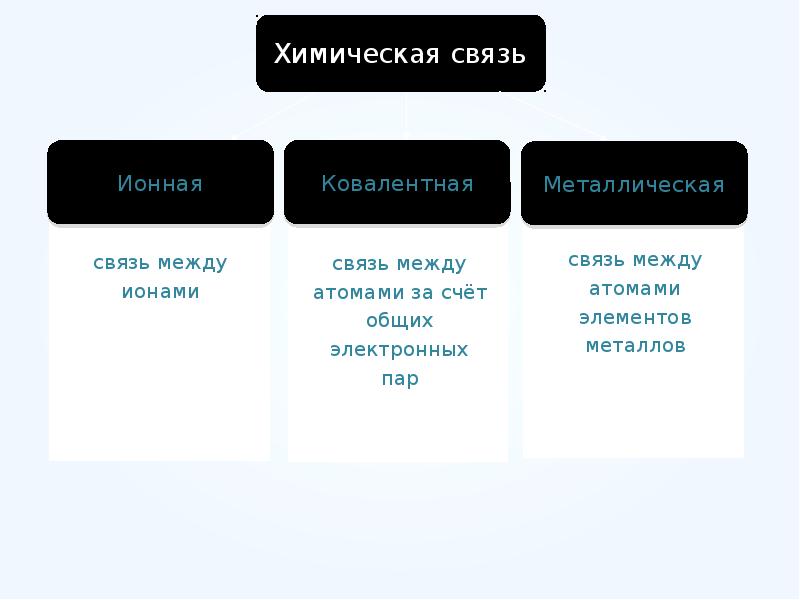
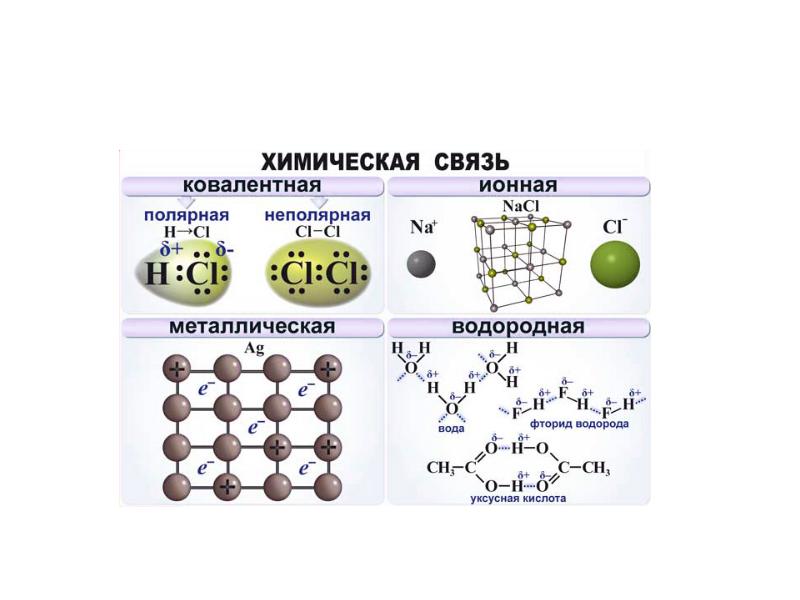
- 20. Типы химических связей Ковалентная. Ионная. Металлическая. Водородная.
- 29. Ковалентная связь Осуществляется за счет образования общих электронных пар. Ковалентная неполярная
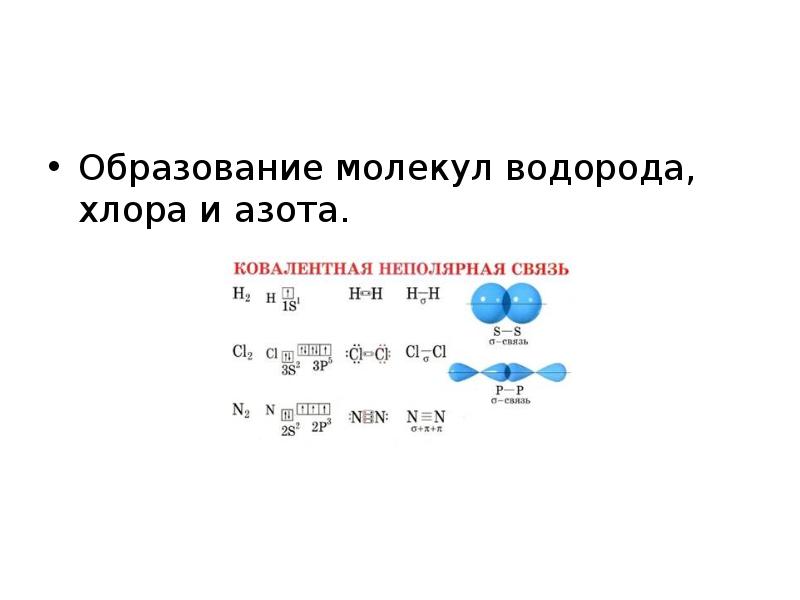
- 30. Ковалентная неполярная связь – образование молекулы водорода.
- 31. Образование молекул водорода, хлора и азота.
- 32. Ковалентная полярная связь образуется между атомами (обычно неметаллов), отличающимися по электроотрицательности.
- 33. Связывающая электронная пара смещена к более электроотрицательному атому хлора.
- 34. Характеристики связи Длина. Энергия.
- 35. Длина связи – расстояние между ядрами взаимодействующих атомов. Энергия связи –
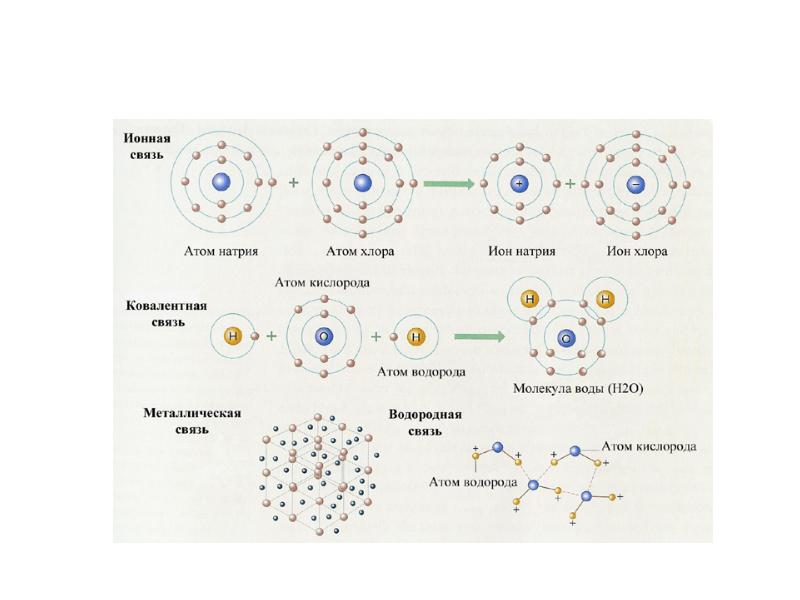
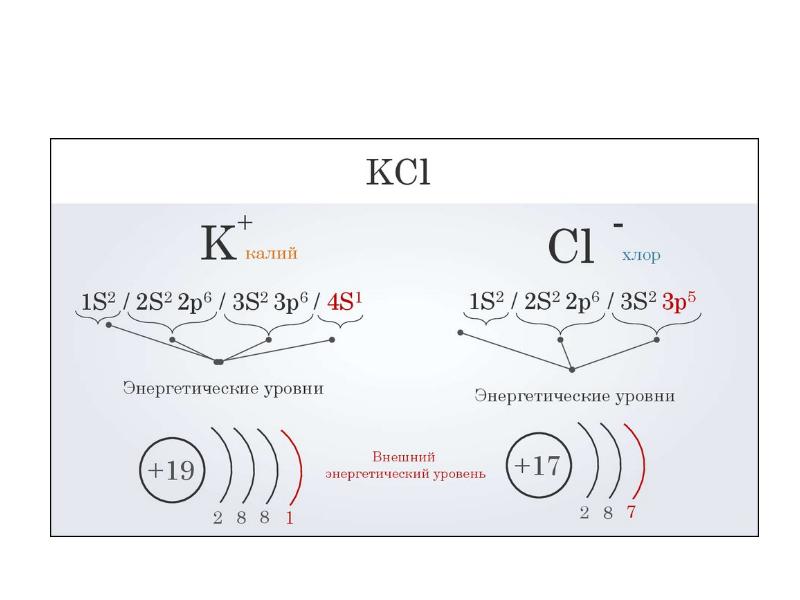
- 36. Ионная связь – осуществляется за счет электростатического взаимодействия ионов с разными
- 37. Взаимодействие атомов натрия и хлора
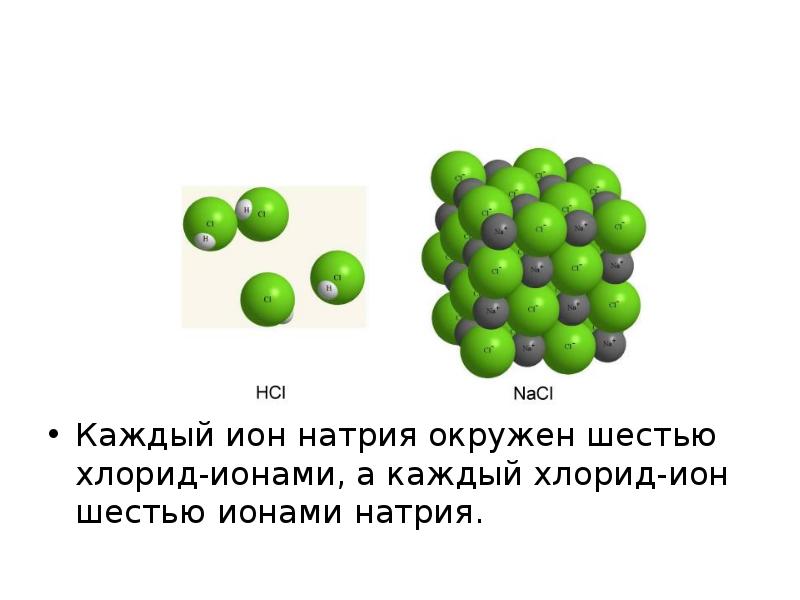
- 39. В твердом (кристаллическом) состоянии каждый положительно заряженный ион взаимодействует не с
- 40. Каждый ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион шестью ионами
- 41. Металлическая связь – осуществляется между атомами с небольшим числом валентных электронов,
- 42. В узлах кристаллической решетки положительные ионы. Подвижные электроны свободно перемещаются по
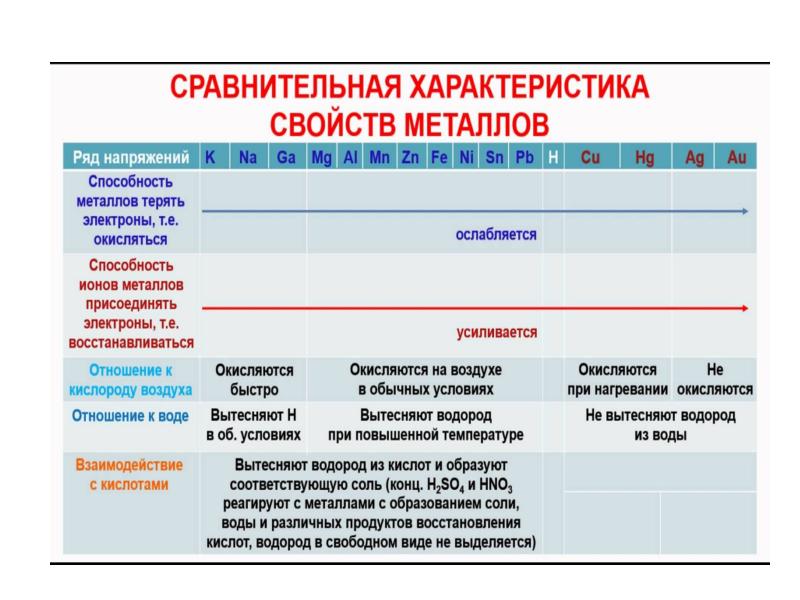
- 43. Свойства металлов: Электропроводность. Теплопроводность. Металлический блеск. Пластичность. Ковкость.
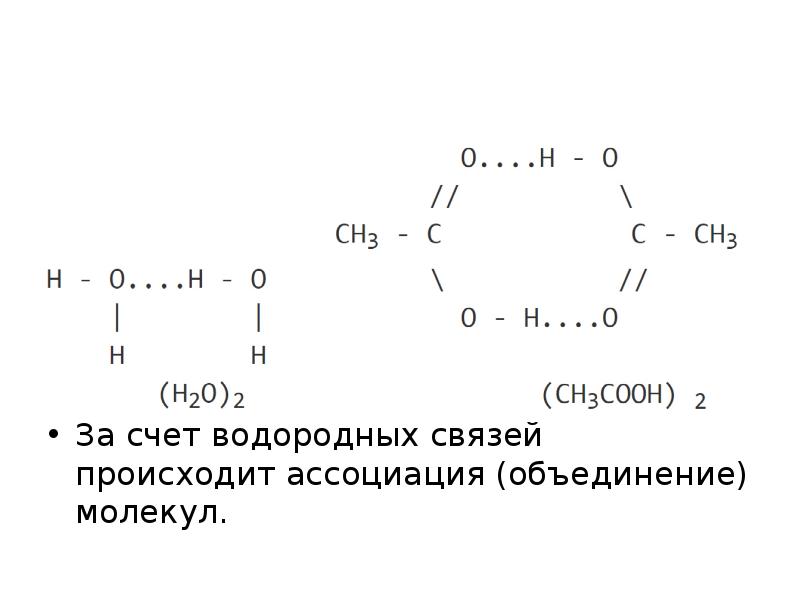
- 45. Водородная связь – возникает между молекулами, в состав которых входят атомы
- 46. За счет водородных связей происходит ассоциация (объединение) молекул.
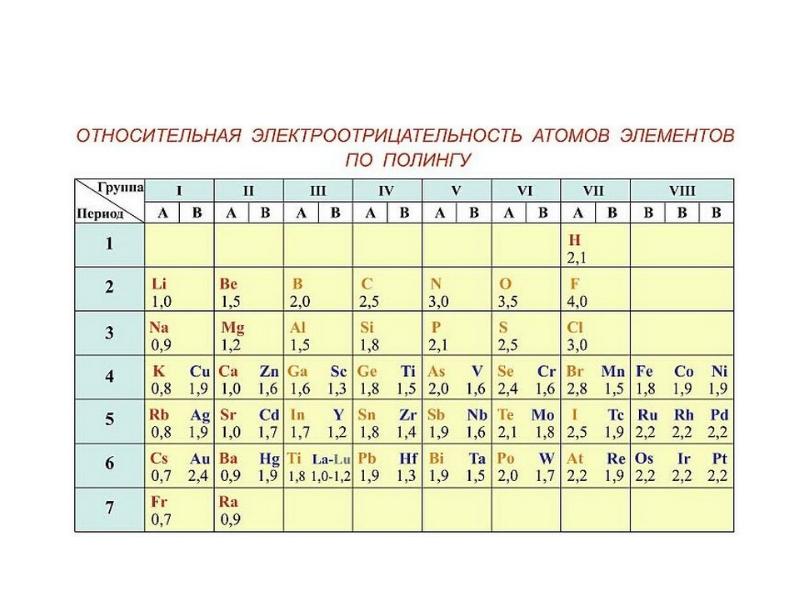
- 47. Электроотрицательность – способность атома в соединении смещать к себе электронную плотность
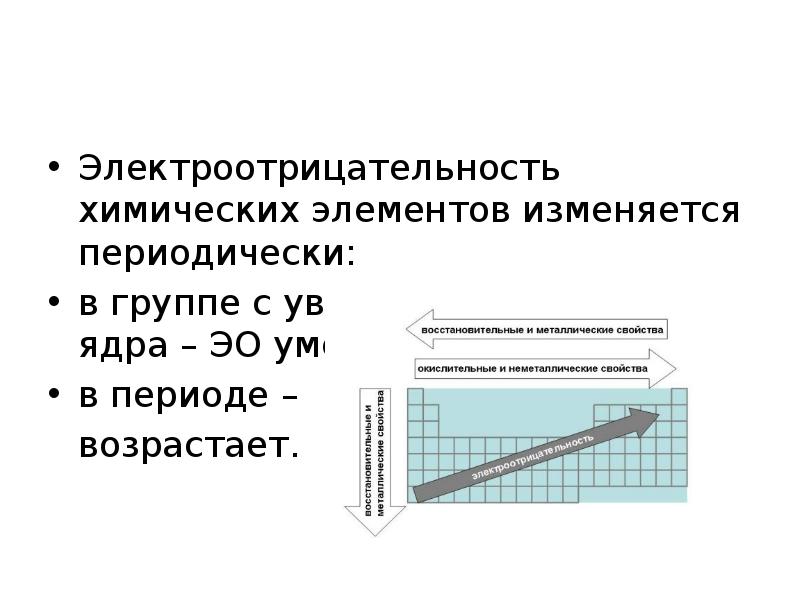
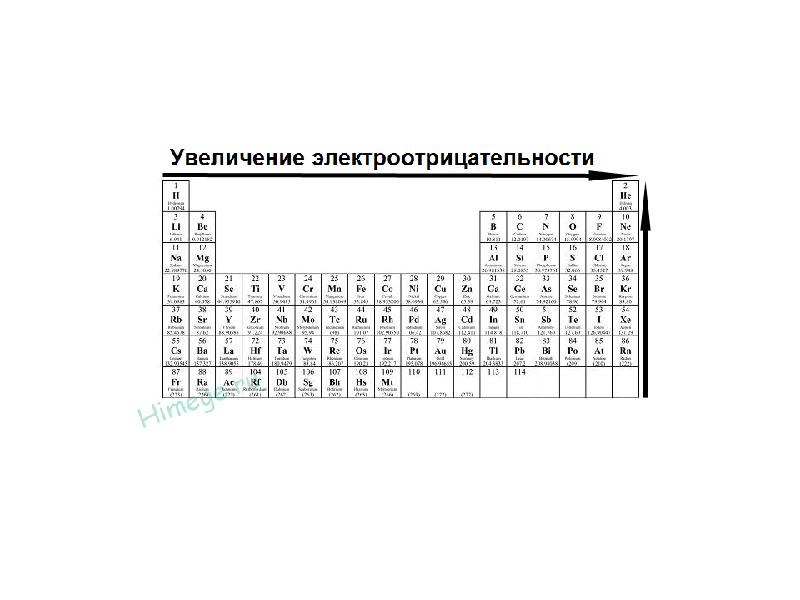
- 49. Электроотрицательность химических элементов изменяется периодически: в группе с увеличением заряда ядра
- 51. Углерод более ЭО, чем водород, но менее отрицателен, чем хлор. В
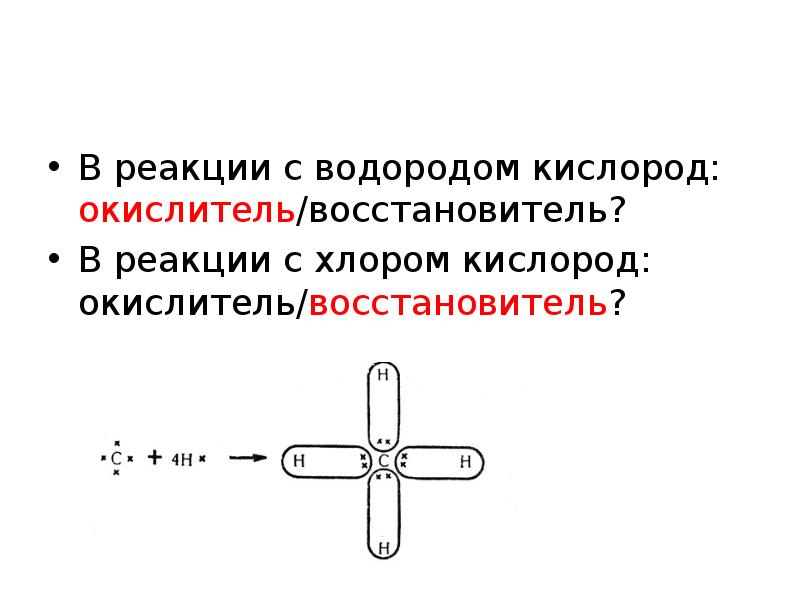
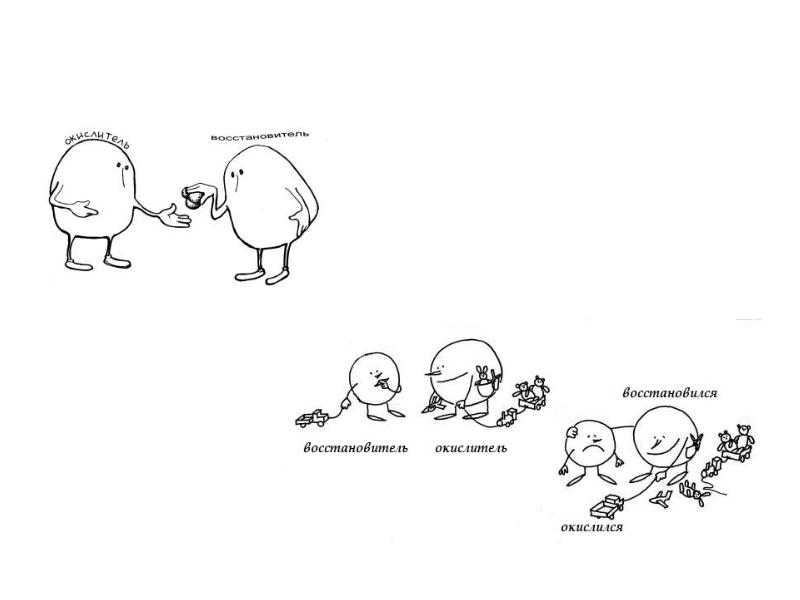
- 52. В реакции с водородом кислород: окислитель/восстановитель? В реакции с хлором кислород:
- 53. Углерод более ЭО, чем водород, но менее ЭО, чем хлор.
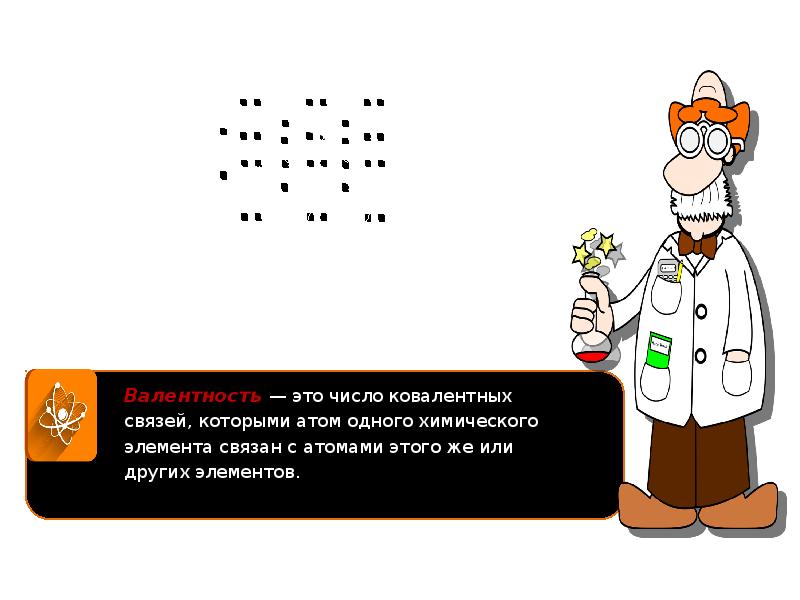
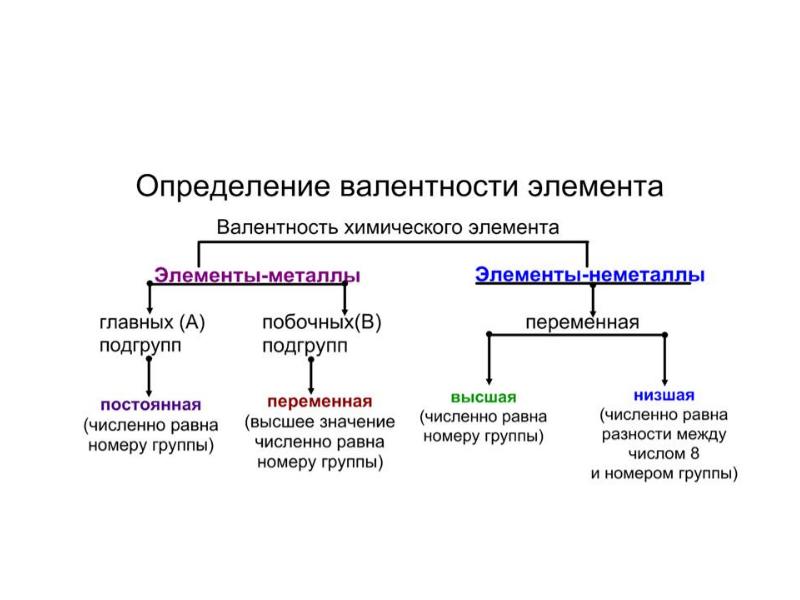
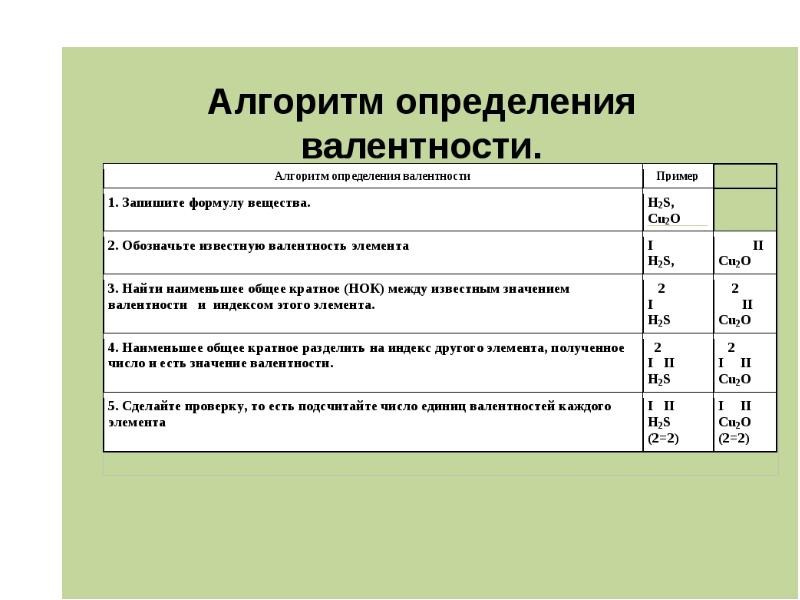
- 54. Валентность – способность атомов химического элемента к образованию химических связей.
- 55. Валентность определяется числом: неспаренных электронов (одноэлектронных орбиталей); неподеленных электронных пар; вакантных
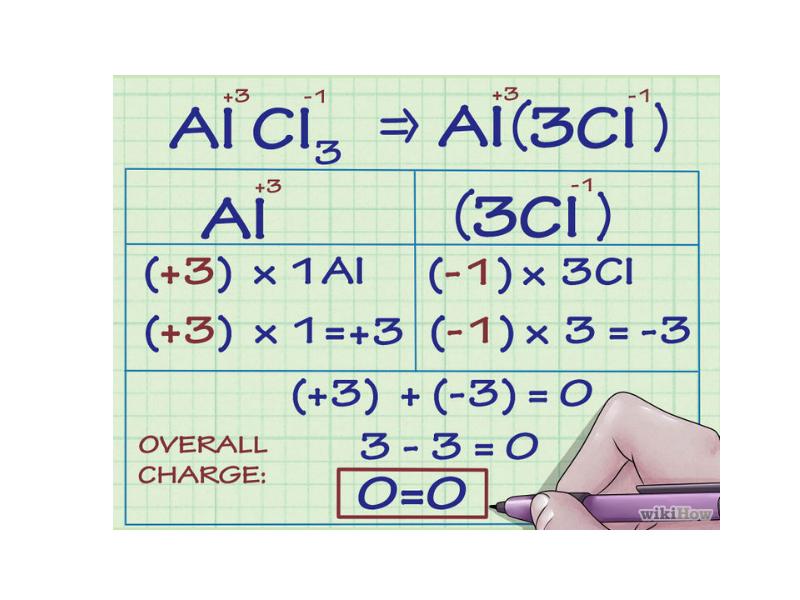
- 59. Степень окисления – условный заряд атома в соединении, вычисленный в предположении,
- 60. Степень окисления может быть отрицательной, нулевой и положительной.
- 67. Скачать презентацию







































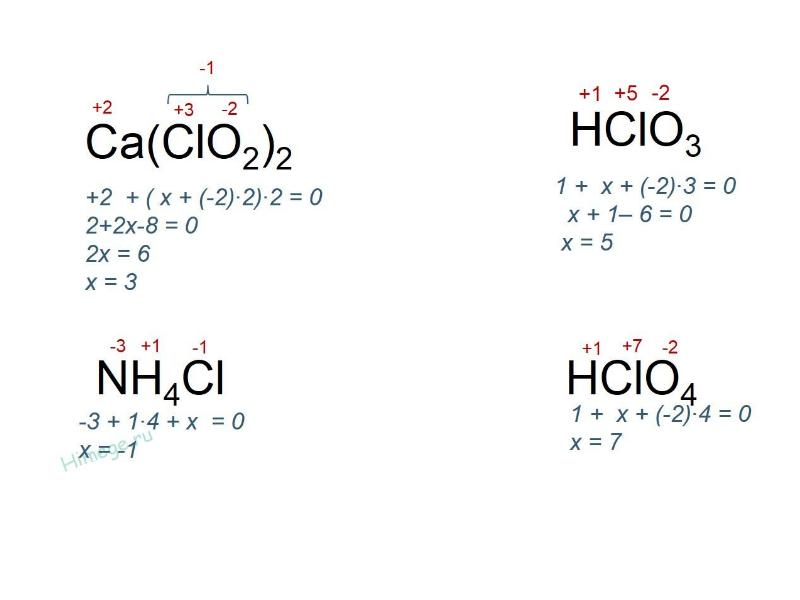

Слайды и текст этой презентации
Скачать презентацию на тему Периодическая система Д.И. Менделеева (Занятие 3) можно ниже:
Похожие презентации





























