Периодический закон Д.И. Менделеева. Химическая связь и ее типы презентация
Содержание
- 2. План лекции 1. Сущность периодического закона. Причина периодической повторяемости химических
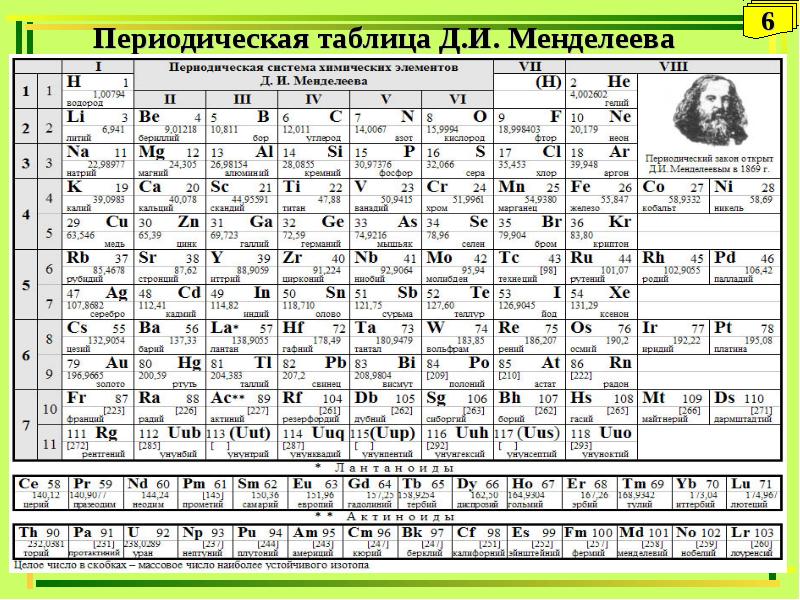
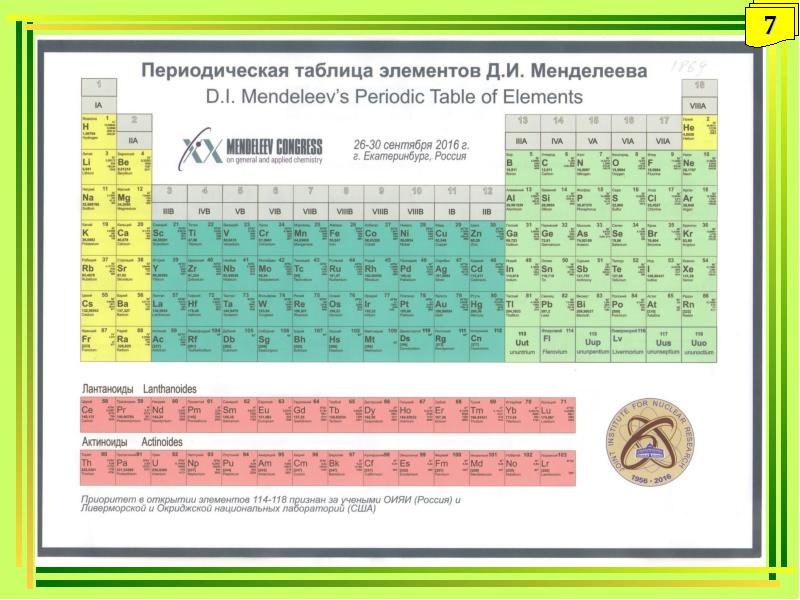
- 6. Периодическая таблица Д.И. Менделеева
- 8. Периодический закон "Свойства простых тел, а также формы и свойства соединений
- 9. Периодический закон сегодня: "Свойства химических элементов, а также образуемых ими простых
- 10. Периодическая система химических элементов Периодическая система химических элементов - естественная классификация
- 11. Периодичность Периодичность – это повторяемость химических и физических свойств элементов и
- 13. Энергия ионизации Энергия (потенциал) ионизации атома Ei - минимальная энергия, необходимая
- 14. Сродство к электрону Сродство атома к электрону Ee – способность атомов
- 15. Электроотрицательность
- 16. Периодическая таблица Д.И. Менделеева
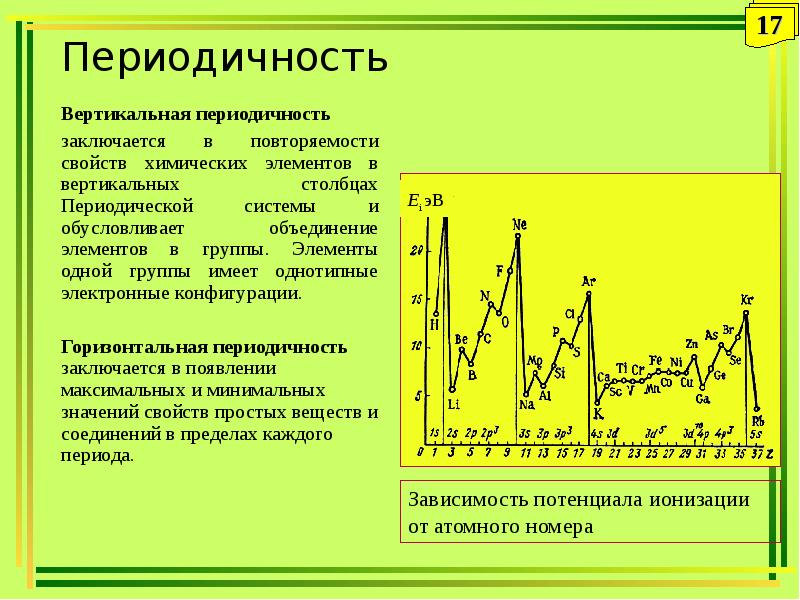
- 17. Периодичность Вертикальная периодичность заключается в повторяемости свойств химических элементов в вертикальных
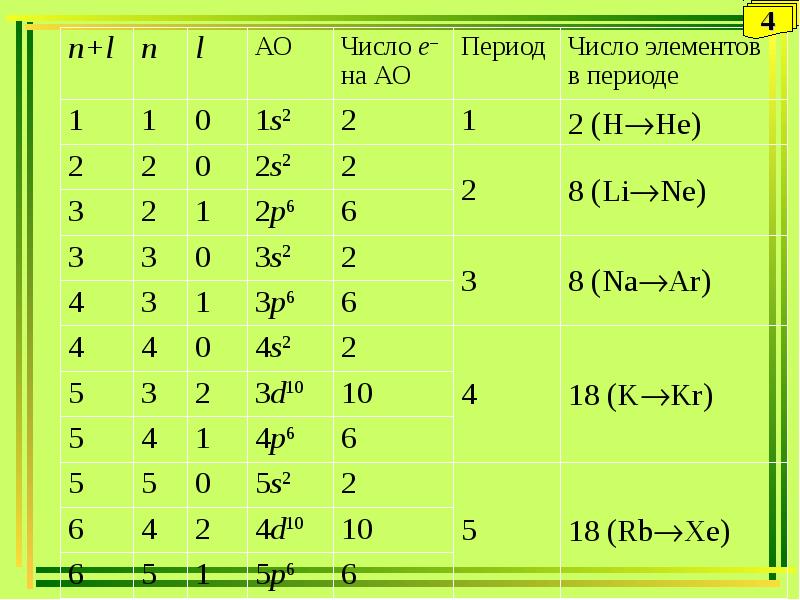
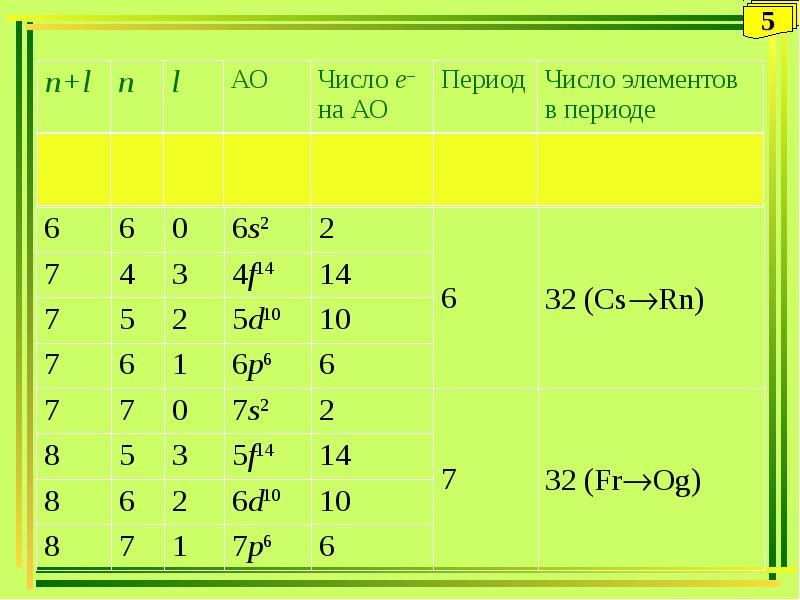
- 18. П.3 Электронные s-,p-,d и f- семейства это связь между положением элемента
- 19. п.3. Основные типы химической связи (ковалентная, ионная, металлическая, водородная), механизм их
- 20. Ковалентная химическая связь это связь, возникающая между атомами за счет образования
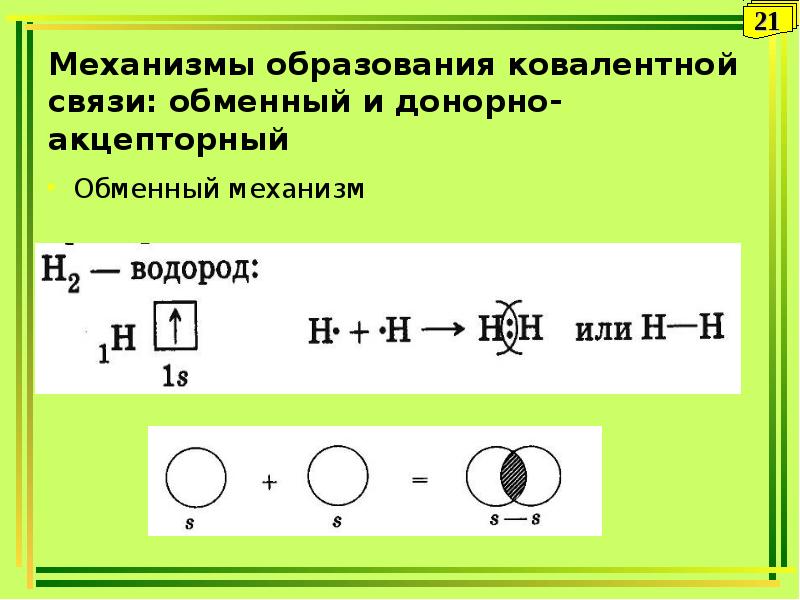
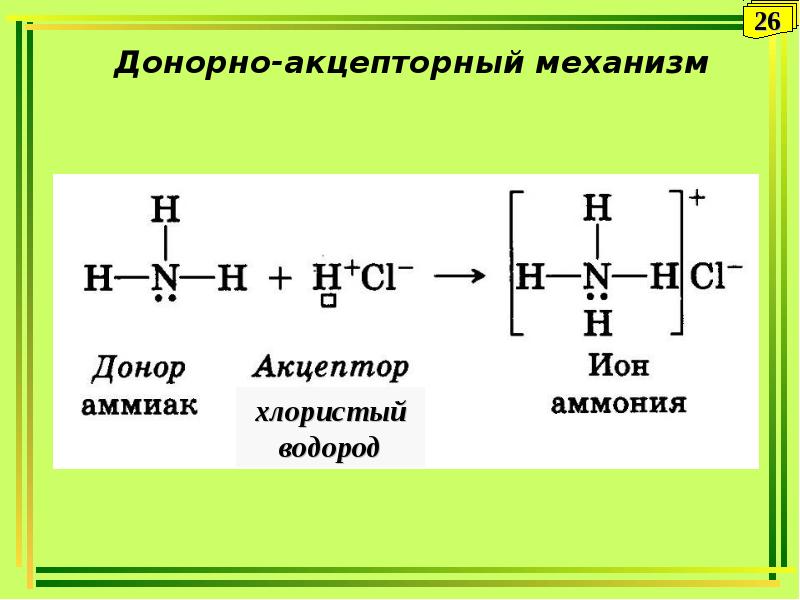
- 21. Механизмы образования ковалентной связи: обменный и донорно-акцепторный Обменный механизм
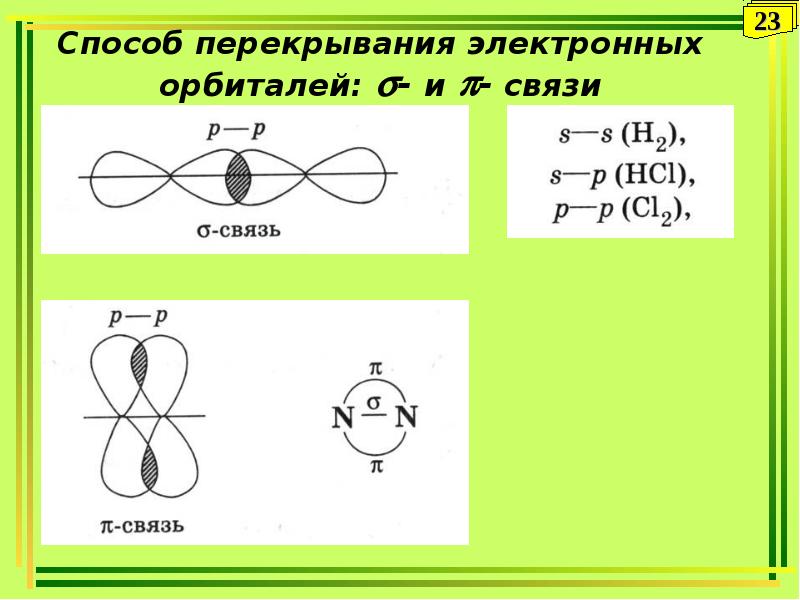
- 23. Способ перекрывания электронных орбиталей: - и - связи
- 24. Полярность ковалентной связи степень смещенности общих электронных пар к одному из
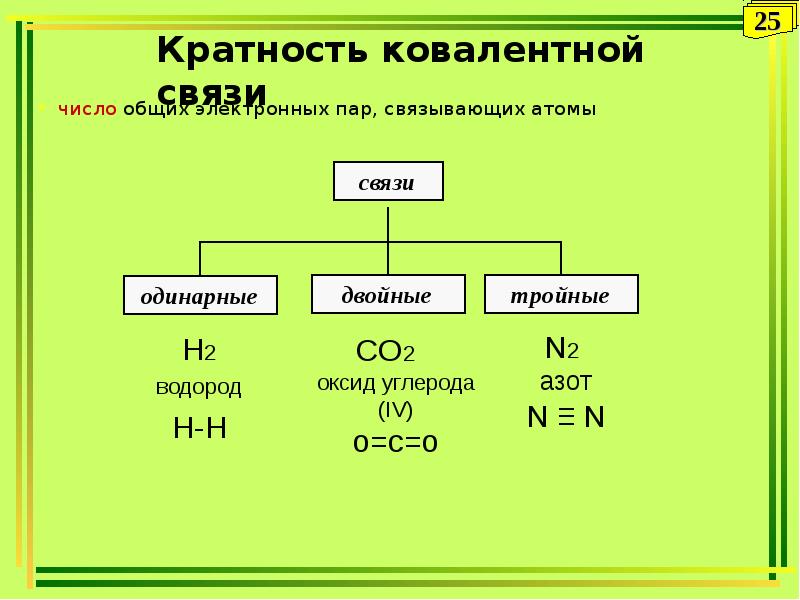
- 25. Кратность ковалентной связи число общих электронных пар, связывающих атомы
- 26. Донорно-акцепторный механизм
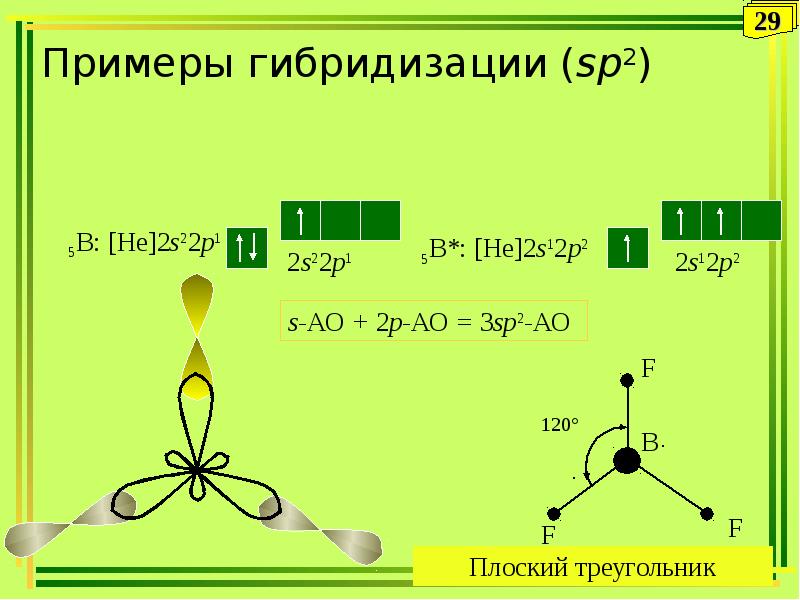
- 27. Гибридизация атомных орбиталей Гибридизация – это выравнивание (усреднение) энергетических и геометрических
- 28. Примеры гибридизации (sp)
- 29. Примеры гибридизации (sp2)
- 30. Примеры гибридизации (sp3)
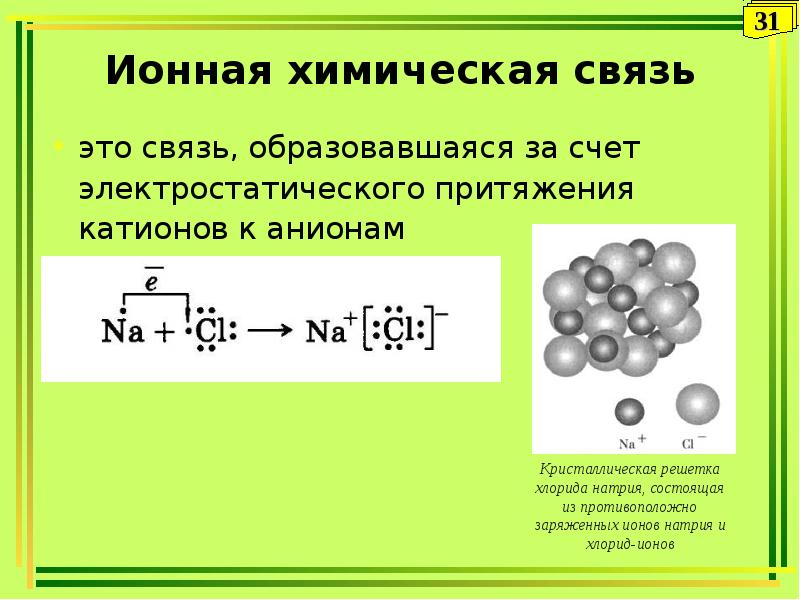
- 31. Ионная химическая связь это связь, образовавшаяся за счет электростатического
- 32. Водородная связь Химическая связь между положительно поляризованными атомами водорода одной молекулы
- 33. Металлическая связь связь в металлах и сплавах, которую выполняют относительно свободные
- 36. Скачать презентацию
























Слайды и текст этой презентации
Скачать презентацию на тему Периодический закон Д.И. Менделеева. Химическая связь и ее типы можно ниже:
Похожие презентации





























