Періодична система хімічних елементів презентация
Содержание
- 2. Сьогодні ми на уроці продовжимо знайомство з ... А ось з
- 3. (Господарство -Періодична система хімічних елементів, брати -періоди, сестри -групи,
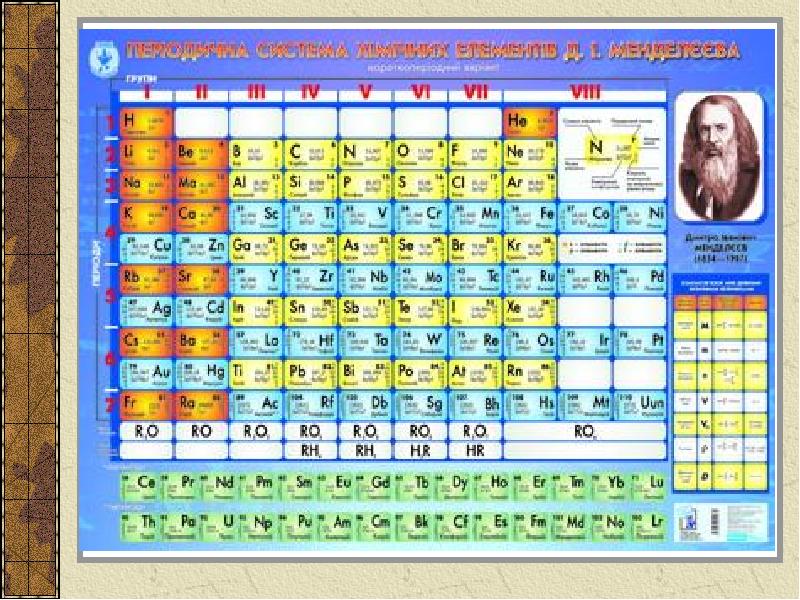
- 5. Періодична система Періодична система-класифікація хімічних елементів, розроблена на основі періодичного закону.
- 6. Період — сукупність елементів, що починається лужним металом та закінчується благородним
- 7. Групи Вертикальні стовпці — групи елементів з подібними хімічними властивостями.
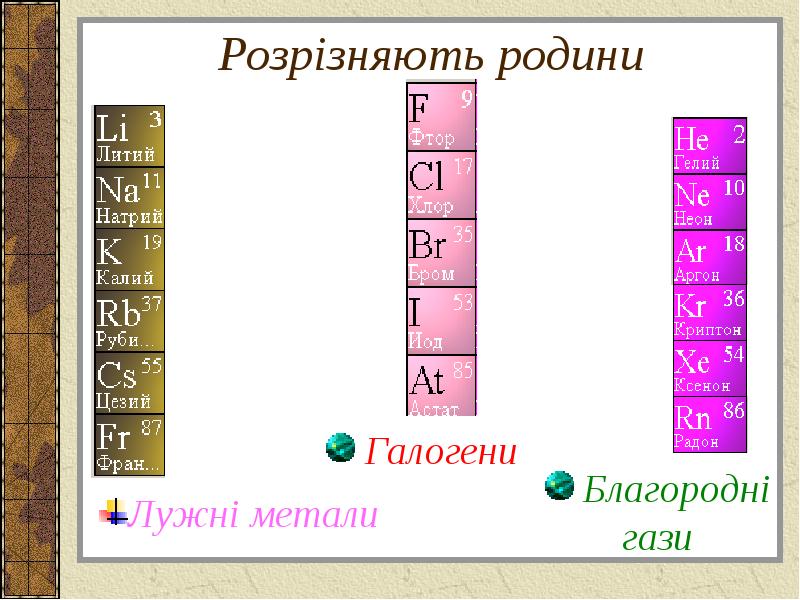
- 8. Розрізняють родини
- 10. Хімічний елемент – це сукупність атомів з однаковим зарядом ядра. Хімічний
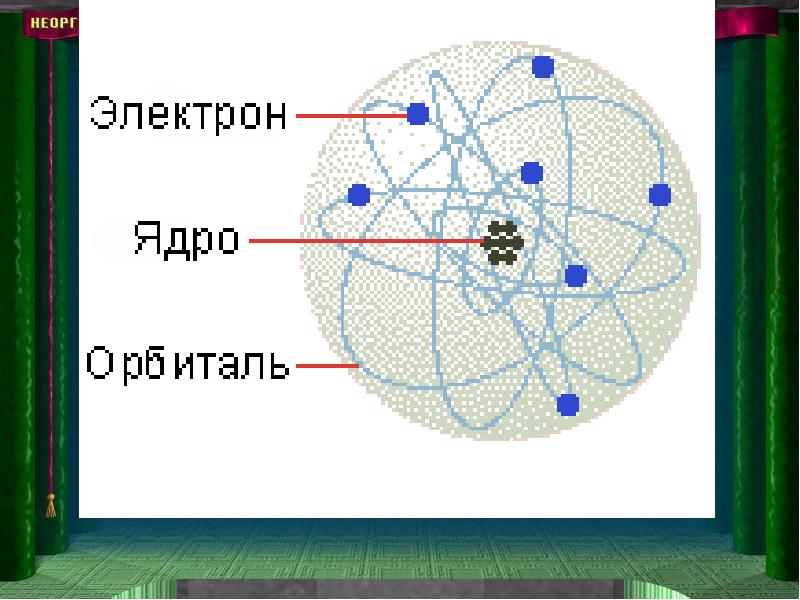
- 12. Першою експериментально обгрунтованої моделлю будови атома була планетарна модель Ернеста Резерфорда,
- 13. Коли на їх шляху поміщали фольгу, то відбувалося в основному їх
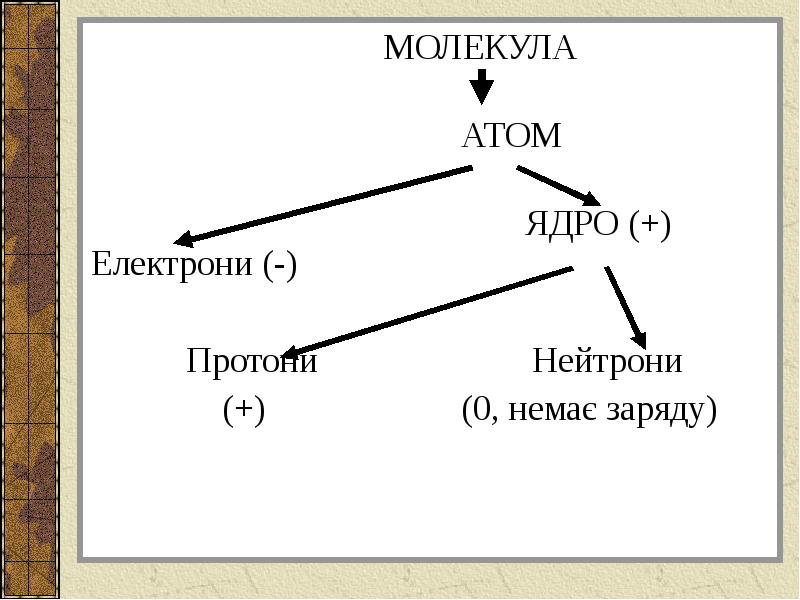
- 15. МОЛЕКУЛА МОЛЕКУЛА
- 16. Склад ядра Ядро : протони, нейтрони.
- 18. Відзначимо собі, що порядковий номер елемента, це не просто номер один
- 19. Ar = m p+ + m n
- 20. Ar –масове число Z –число протонів = порядковому номеру елемента N
- 21. Скачать презентацию
















Слайды и текст этой презентации
Скачать презентацию на тему Періодична система хімічних елементів можно ниже:
Похожие презентации





























