Поверхневі явища. Адсорбція презентация
Содержание
- 3. План Поверхневий натяг. Рівняння Гіббса. Адсорбція газів. Адсорбція з розчинів Адсорбція
- 4. Поверхневі явища Це процеси, які проходять на межі розділення фаз в
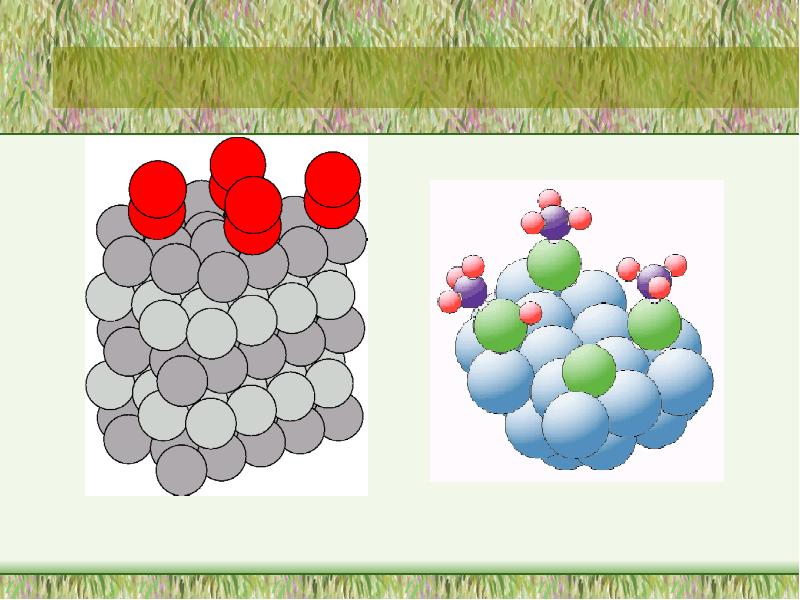
- 5. Властивості молекул в поверхневому шарі і в об*ємі системи істотно відрізняються
- 6. Поверхнева енергія Gs Важливою характеристикою поверхневої фази є поверхнева енергія
- 7. Поверхневий натяг σ Для характеристики поверхні разділу, що відділяє дану
- 8. Методи визначення поверхневого натягу Метод капілярного підняття рівня рідини; Максимального тиску
- 9. Поверхнево-активні речовини (ПАР) ПАР - це сполуки, які адсорбуються на поверхні
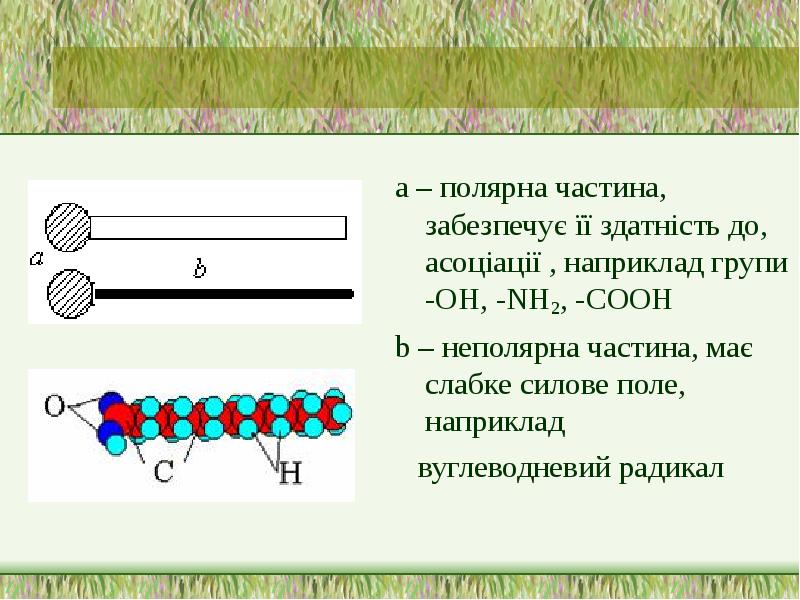
- 10. а – полярна частина, забезпечує її здатність до, асоціації , наприклад
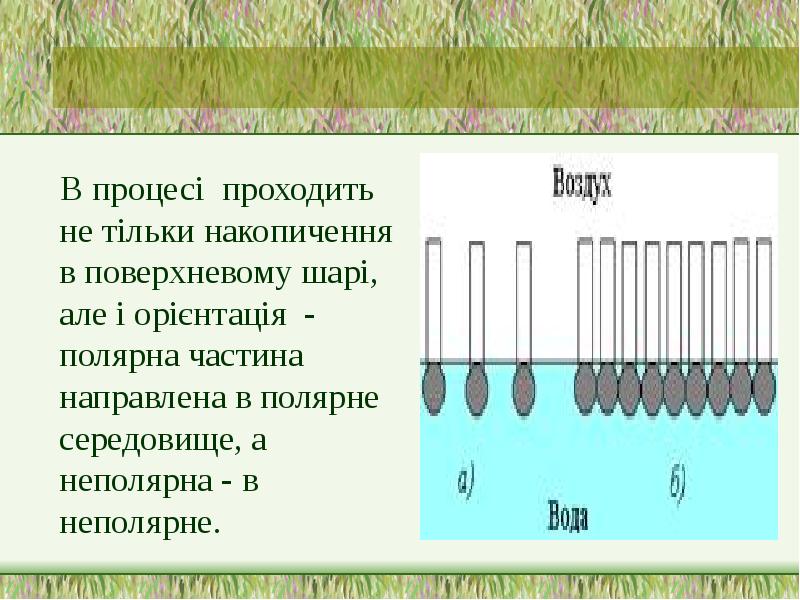
- 11. В процесі проходить не тільки накопичення в поверхневому шарі, але і
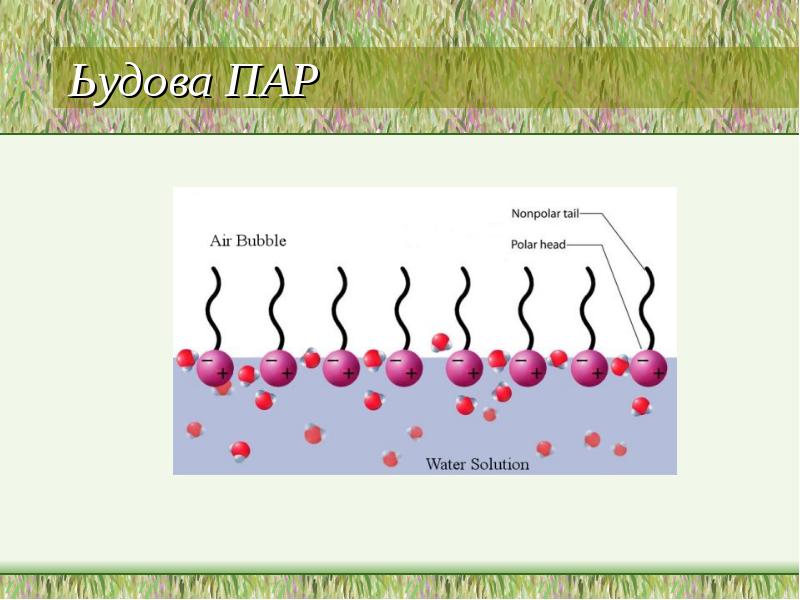
- 12. Ьудова ПАР
- 13. Речовини, додавання яких до розчинника зменшує поверхневий натяг, называються поверхнево-активними (ПАР)
- 14. ПАР До поверхнево-активних належать органічні сполуки: жирні кислоти, солі жирних
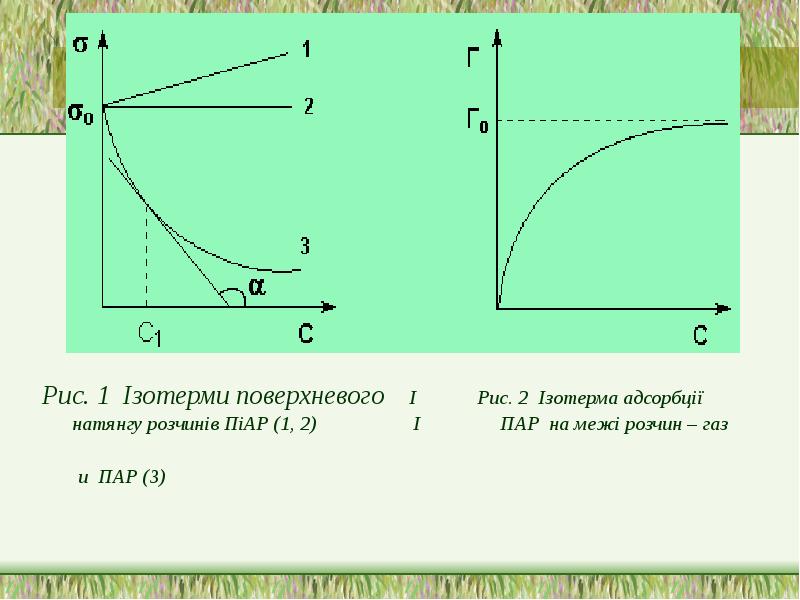
- 15. Правило Дюкло -Траубе В гомологичному ряду при малих концентраціях збільшення вуглецевого
- 16. Рис. 1 Ізотерми поверхневого І Рис. 2 Ізотерма адсорбції натянгу
- 17. Адсорбція -зміна концентрації компонентів в поверхневому шарі порівняно з об*ємом фази.
- 18. Рівняння Гіббса Американський вчений Гіббс вивів рівняння, яке пов'язує величину адсорбції
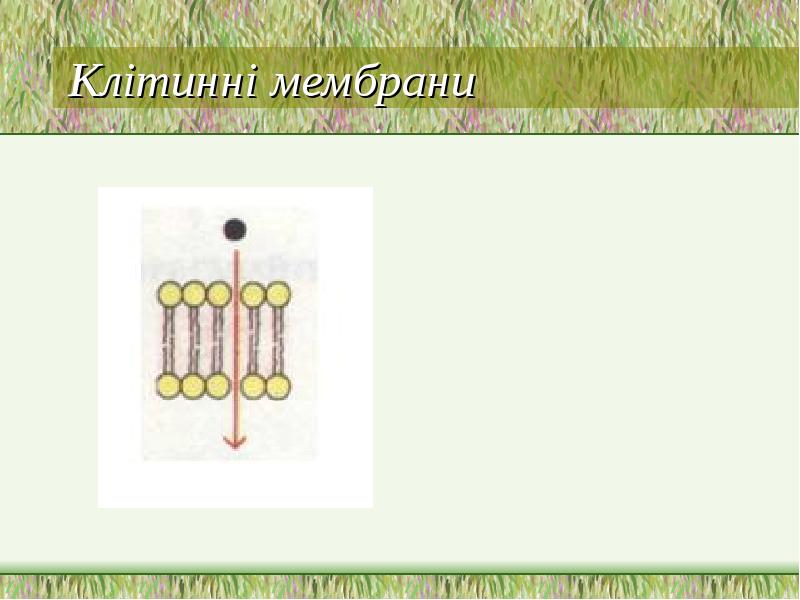
- 19. Клітинні мембрани
- 20. Сорбція Сорбція – поглинання однієї речовини іншою речовиною Сорбент –
- 21. Cорбція Якщо внести у водний розчин оцтової кислоти порошок активованого вугілля,
- 22. Cорбція Інший приклад. Якщо порошок оксиду кальцію привести у контакт із
- 24. Активоване вугілля - цей адсорбуючий засіб, який отримують з копалин або
- 25. Основна властивість активованого вугілля - висока сорбційна здатність, обумовлена великою кількістю
- 27. . Мицеллы: а – сферическая; б – пластинчатая
- 28. Фізична адсорбція проявляється за рахунок Ван-дер-Васльсових взаємодій. Вона характеризується зворотністю і
- 29. Химическая адсорбция (хемосорбция) осуществляется путем химического взаимодействия молекул адсорбента и адсорбата.
- 30. Cорбція Усі подібні процеси називають сорбційними. Отже, сорбцією називають зміну концентрації
- 31. Cорбція Адсорбцією називається процес самочинної зміни концентрації компонента у поверхневому шарі,
- 32. Cорбція Процеси, які завершуються в поверхневому шарі, можна розділити на адсорбцію
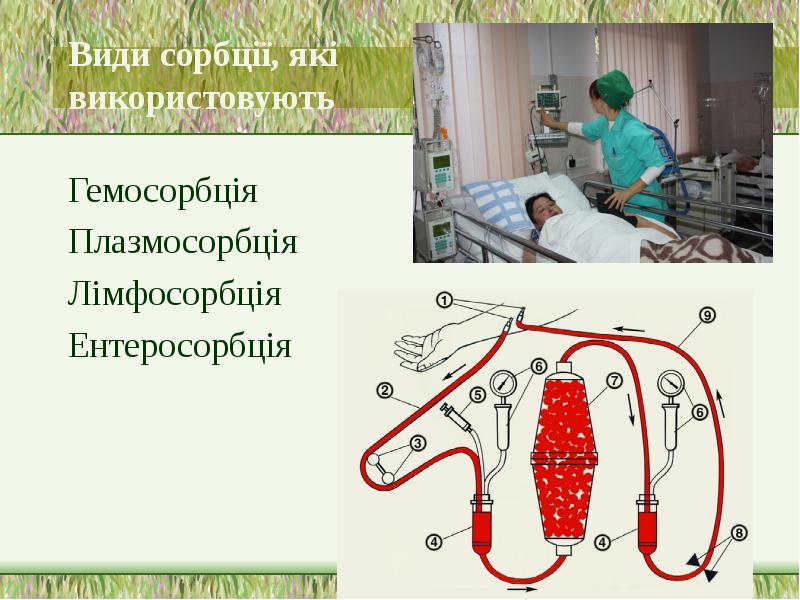
- 34. Види сорбції, які використовують у медицині: Гемосорбція Плазмосорбція Лімфосорбція Ентеросорбція
- 35. Адсорбція з розчинів Молекулярна, адсорбуються електроліти Іонна, адсорбуються сильні електроліти Правило
- 36. Іонна адсорбцІя Це хімічна взаємодія між іонами розчиненої речовини з твердою
- 37. Правило Пескова Фаянса Перше правило. На поверхні кристалічного твердого тіла з
- 38. Правило Пескова Фаянса Друге правило. На твердій поверхні адсорбента адсорбуються
- 39. іонообмінна адсорбція іонообмінна адсорбція - це процес обміну іонів з одинаковим
- 40. Хроматографічний метод Хроматографічний метод є фізико-хімічним методом розділення компонентів складних сумішей
- 41. Хроматографічний метод Окрім свого головного завдання – якісного та кількісного аналізу
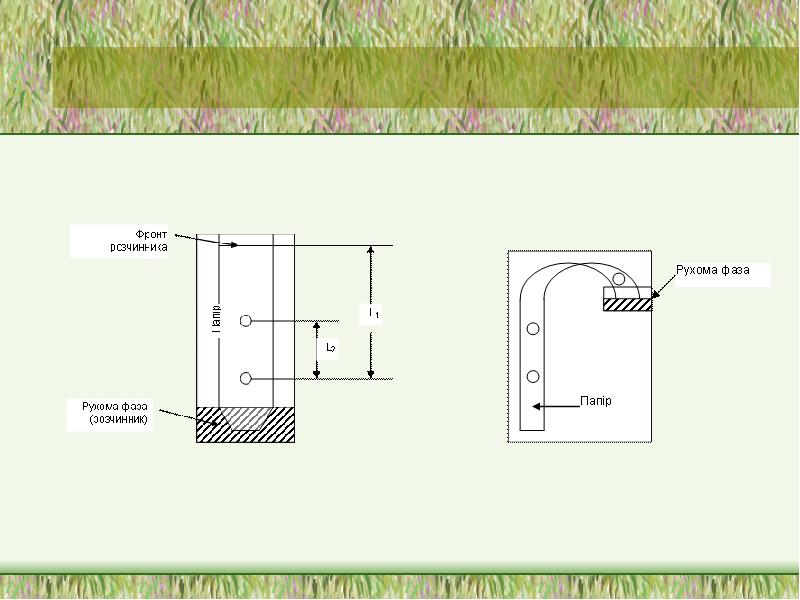
- 42. Cорбція Залежно від агрегатного стану рухомої фази розрізняють рідинну хроматографію і
- 43. хроматографія За механізмом розділення є такі види хроматографії: адсорбційна розподільна йонообмінна
- 44. хроматографія залежно від методу розділення розрізняють: Колонкову Тонкошарову Паперову хроматографії
- 46. Скачать презентацию





































Слайды и текст этой презентации
Похожие презентации





























