Производство водорода презентация
Содержание
- 2. Водород: история и перспективы Генри КАВЕНДИШ (1731 г. –1810) Показал,
- 3. 1950 Акира Митсуи – производство водорода с помощью микроорганизмов 1950 Акира
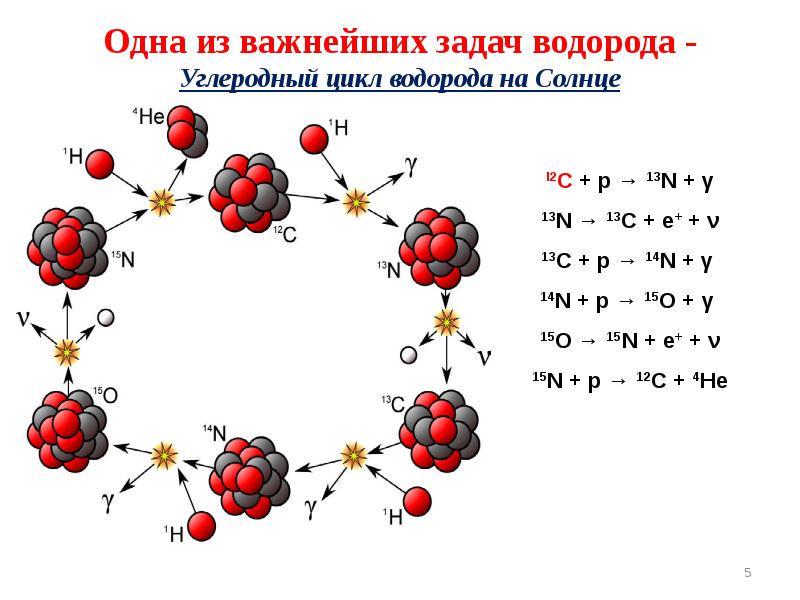
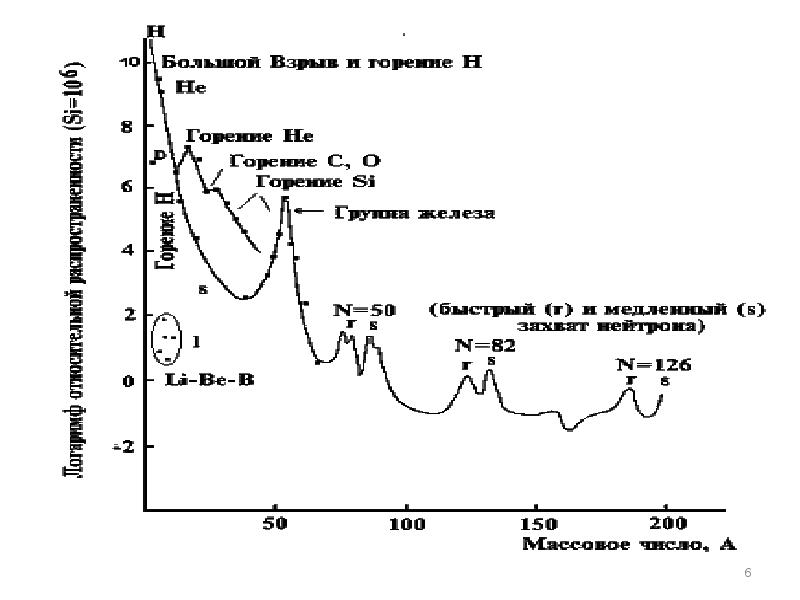
- 5. Одна из важнейших задач водорода - Углеродный цикл водорода на Солнце
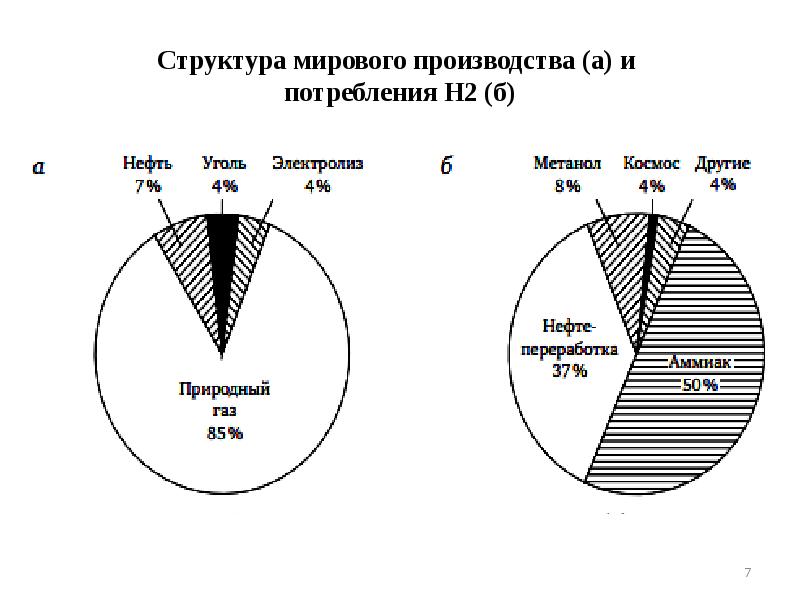
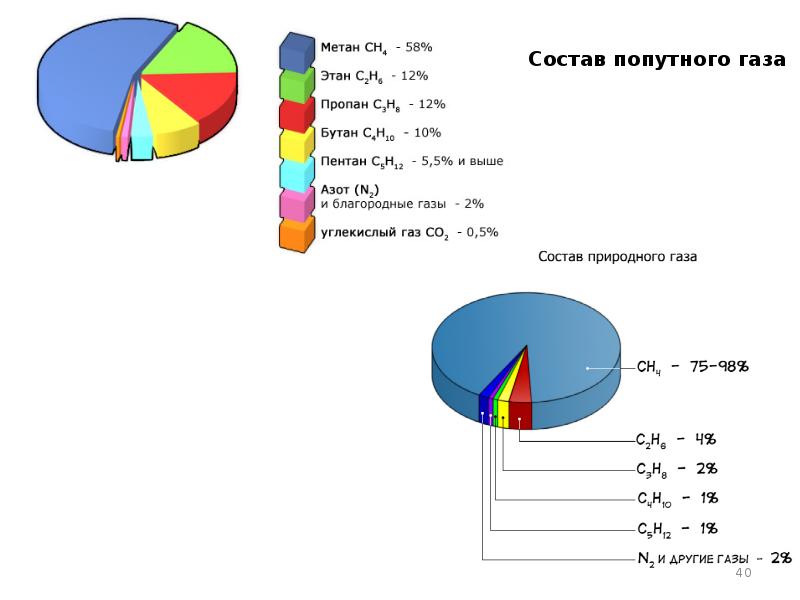
- 7. Структура мирового производства (а) и потребления Н2 (б)
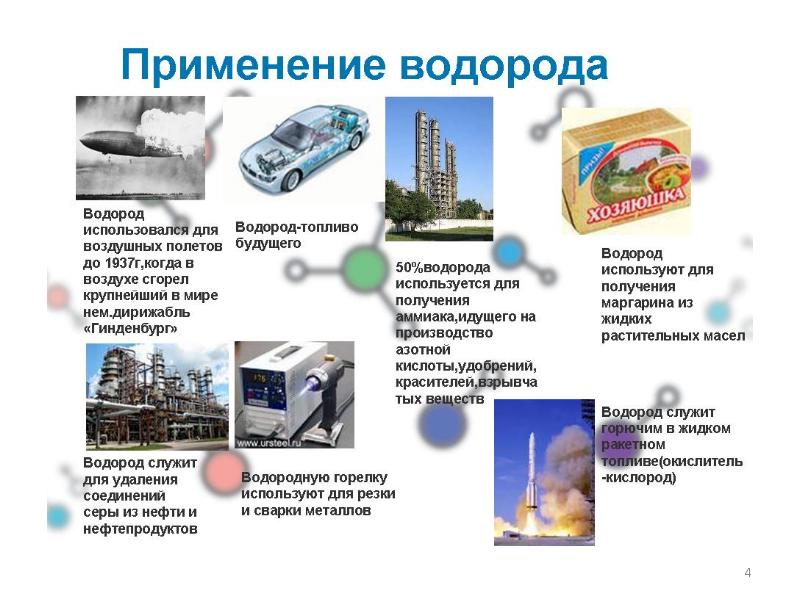
- 8. Применение водорода в химической промышленности
- 10. Возможные способы производства водорода Водород из природных ископаемых и УВ
- 11. 1.1 Производство Н2 газификацией угля
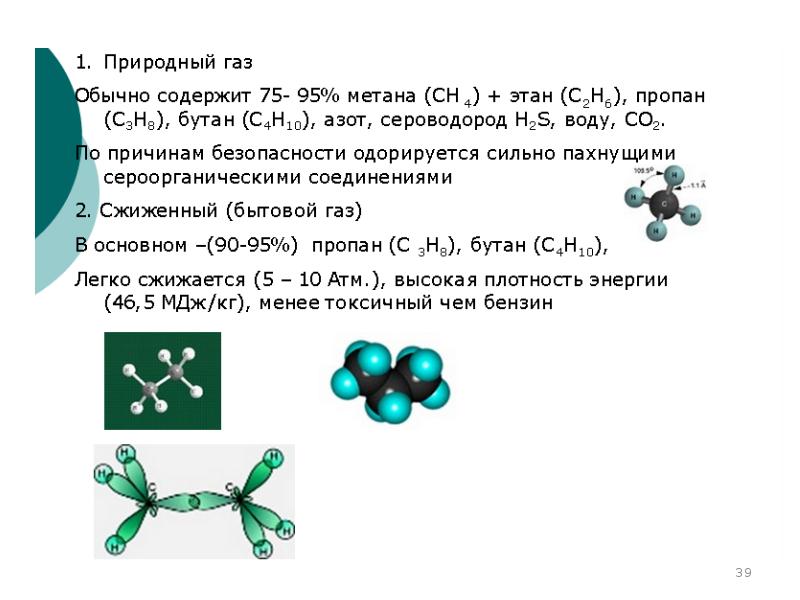
- 12. Основные виды природного и искусственного топлива:
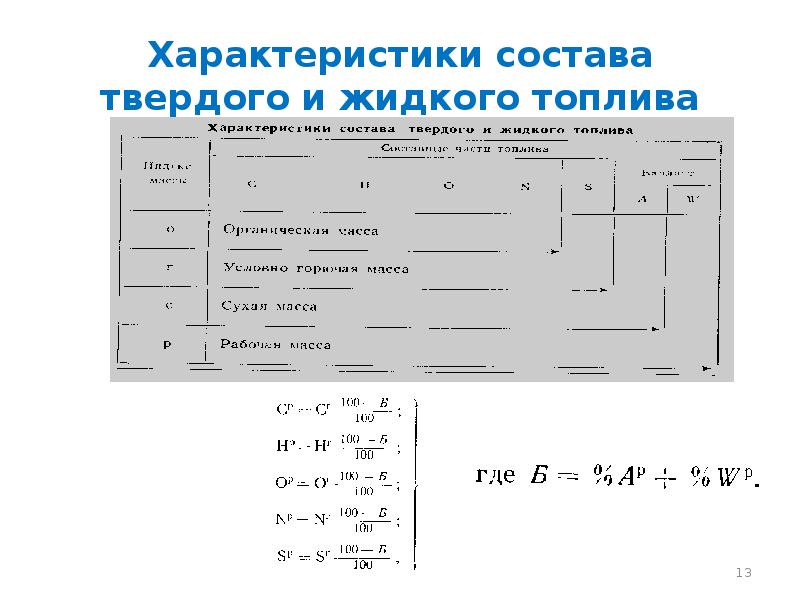
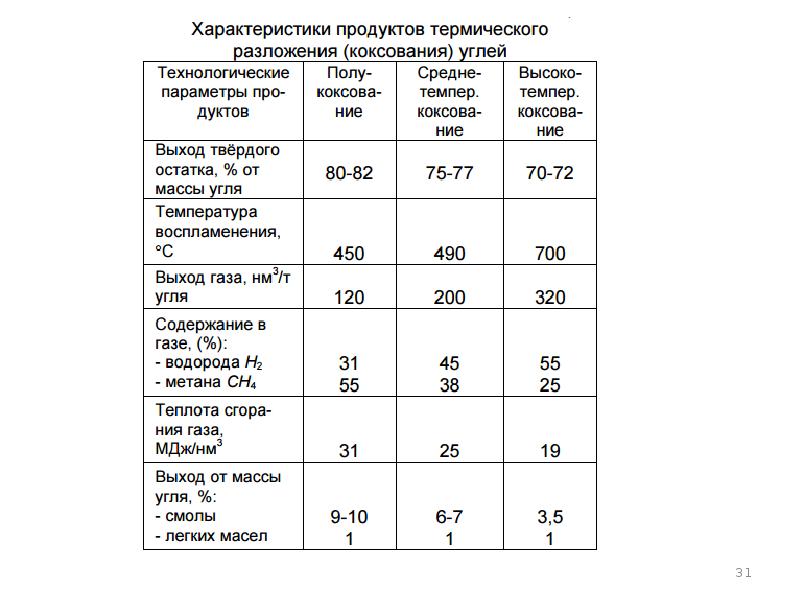
- 13. Характеристики состава твердого и жидкого топлива
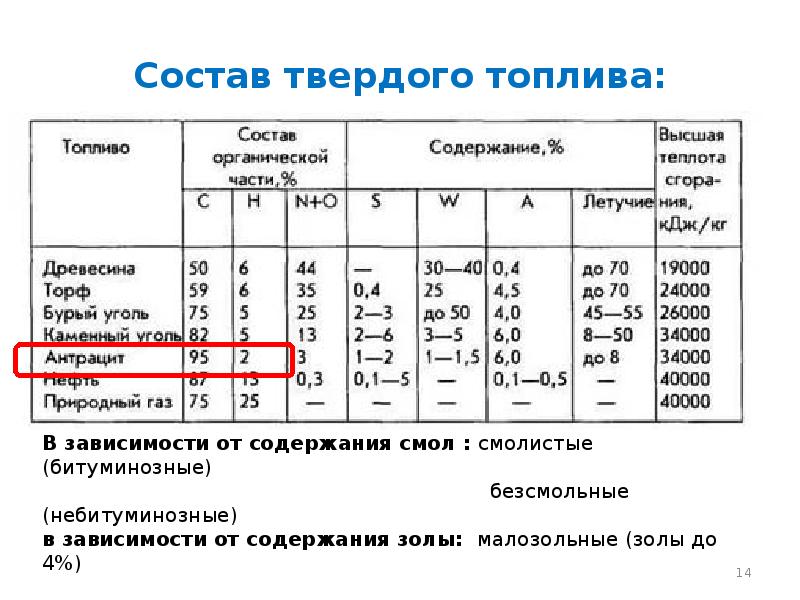
- 14. Состав твердого топлива:
- 15. Преимущества: Около 96% Н2 производится из ископаемых УВ (газ – 48%,
- 16. В зависимости от способа подвода теплоты процесс газификации делится на: В
- 17. Газификация угля C + H2O → CO + H2 (эндотермическая) C+
- 19. Термодинамические характеристики парокислородной газификации угля
- 22. Классификация процессов газификации угля:
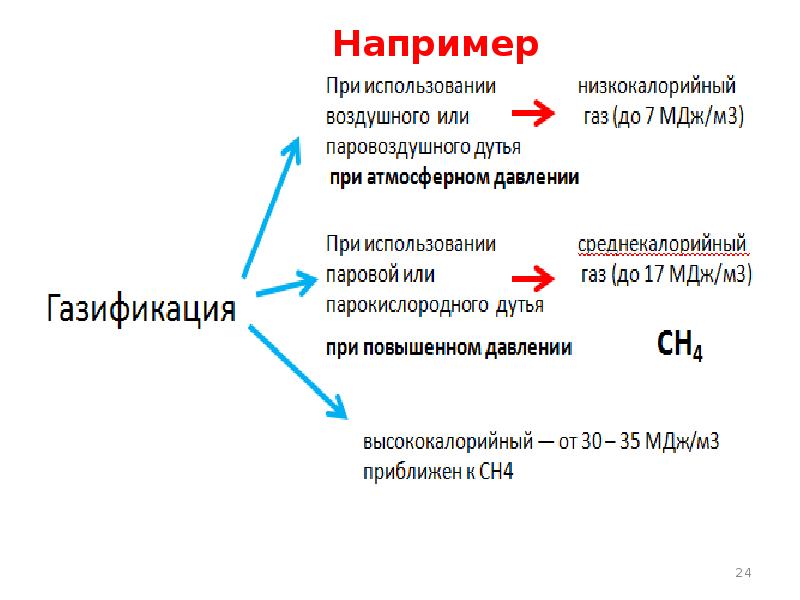
- 25. Низкокалорийный газ
- 26. Среднекалорийный газ По составу они представляют собой смеси оксидов углерода и
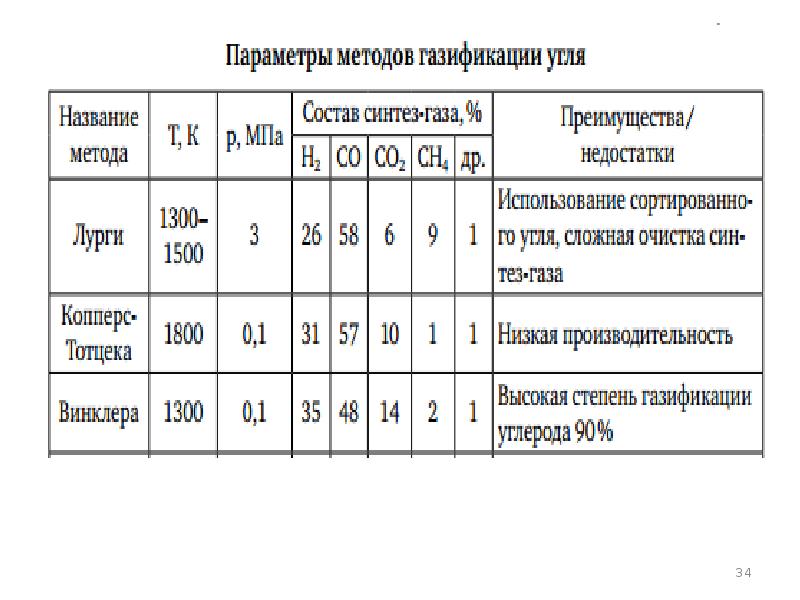
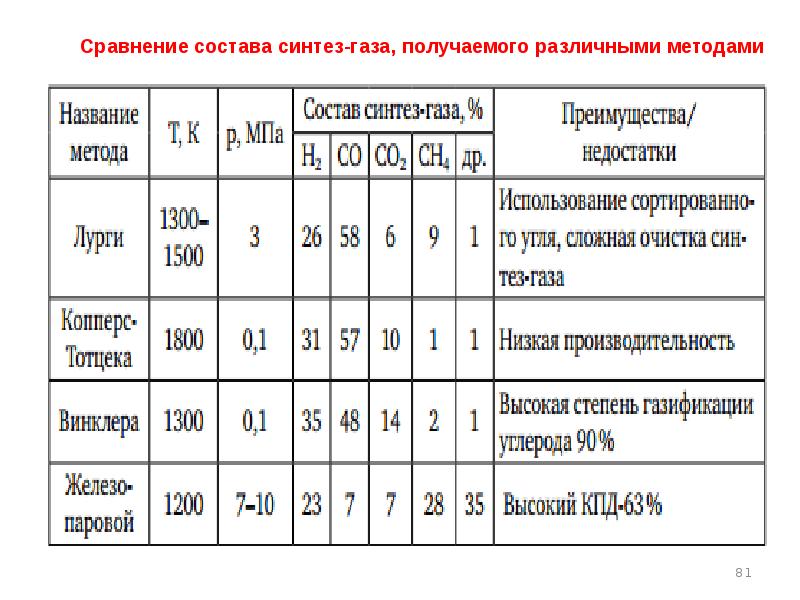
- 27. Наиболее современные газогенераторы Лурги Винклера Копперс-Тотцека Велман-Галуши
- 28. История создания газогенераторов: 1. Создание Фрицем Винклером (концерн BASF) в 1926
- 29. Пылеугольный принцип газификации с жидким шлакоудалением реализован в промышленных аппаратах Destec,
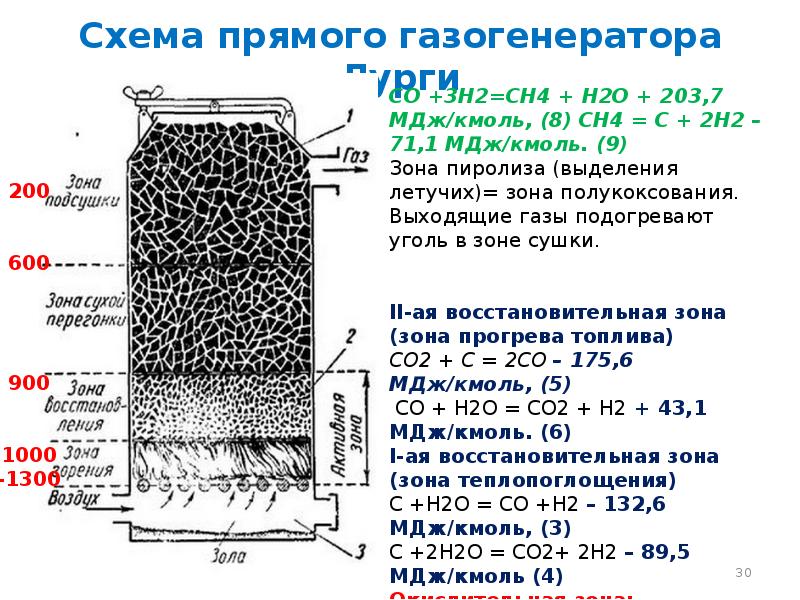
- 30. Схема прямого газогенератора Лурги
- 32. Минусы процесса
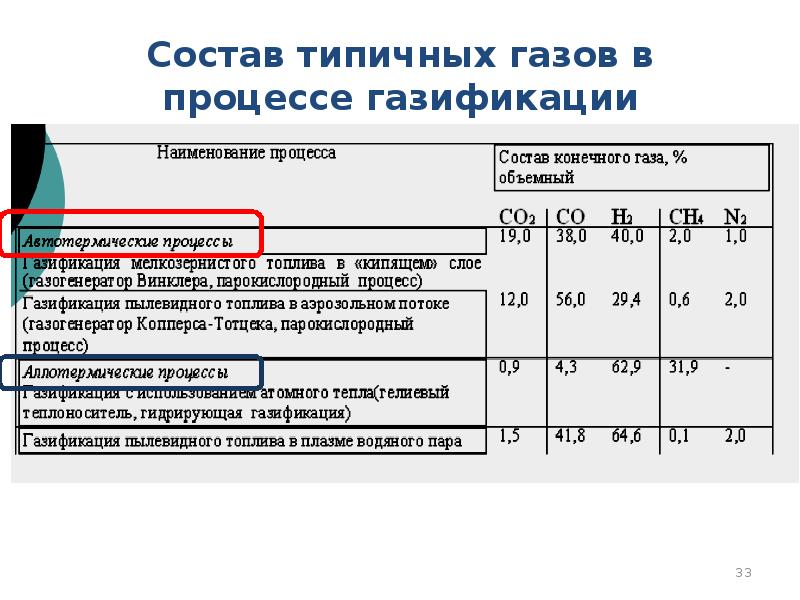
- 33. Состав типичных газов в процессе газификации
- 35. 1.2 Конверсия низших и высших УВ
- 36. В процессе конверсии метан окисляется по следующим основным реакциям: В процессе
- 37. Если требуется получить технически чистый Н2, проводят р-цию (1) или (3)
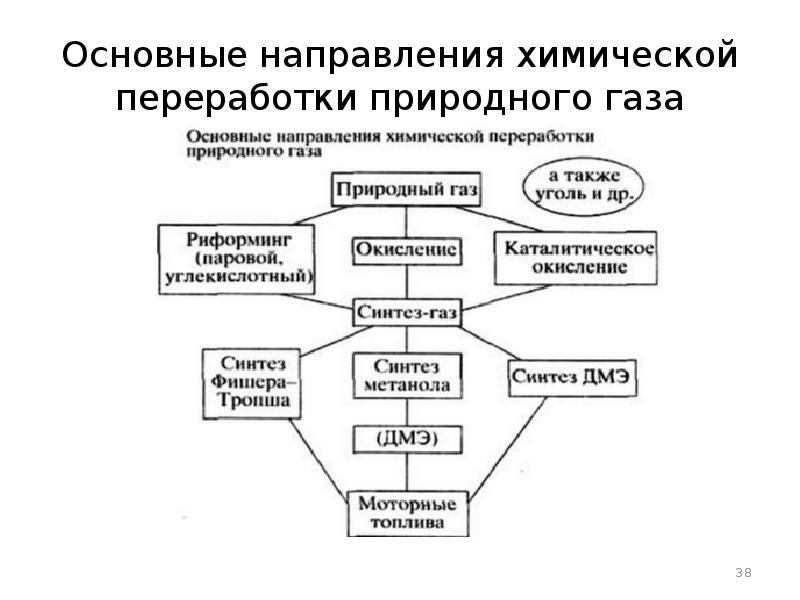
- 38. Основные направления химической переработки природного газа
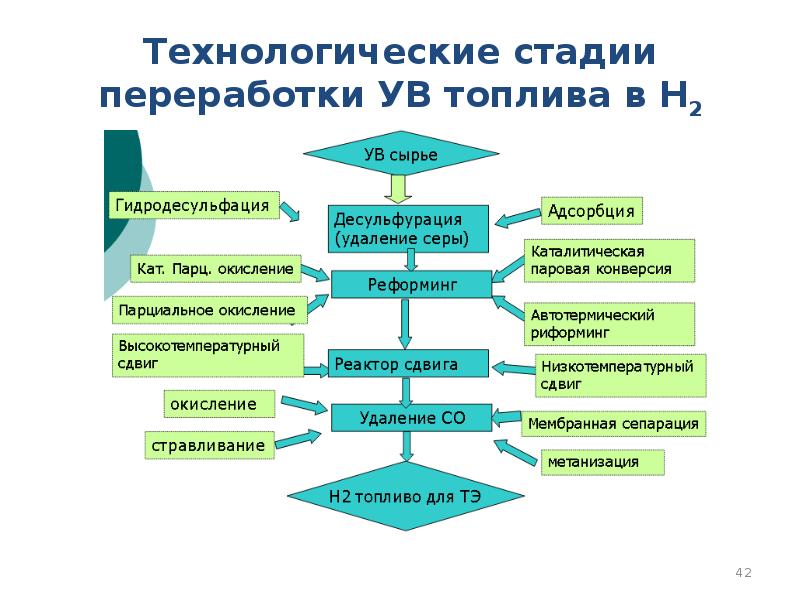
- 42. Технологические стадии переработки УВ топлива в Н2
- 43. Производство водорода
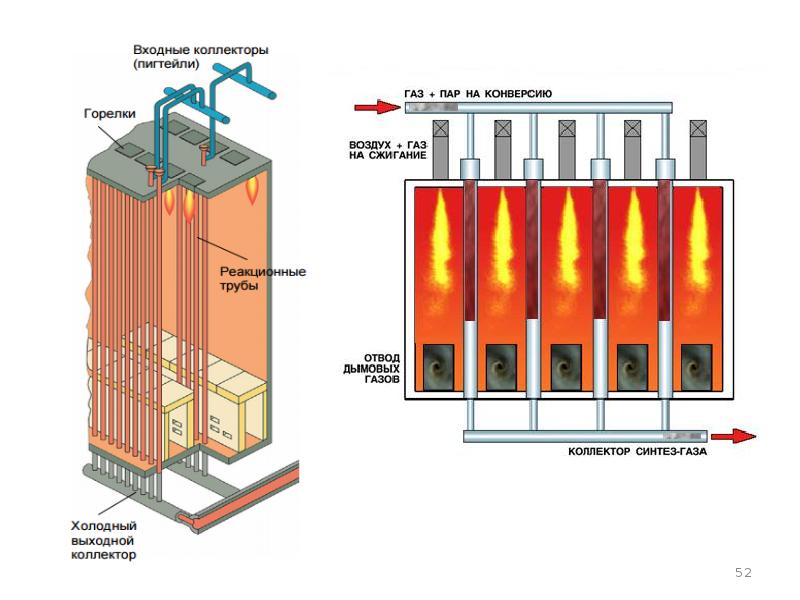
- 44. Паровая конверсия УВ (паровой риформинг)
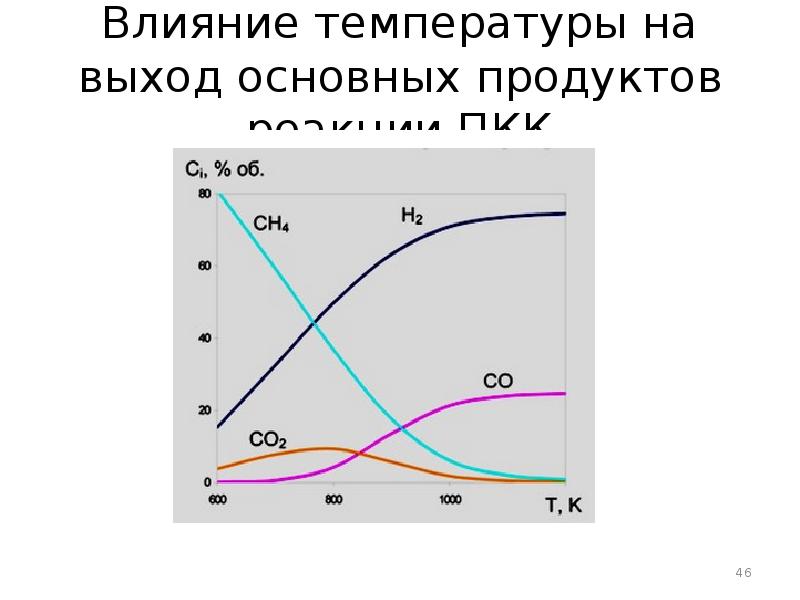
- 46. Влияние температуры на выход основных продуктов реакции ПКК
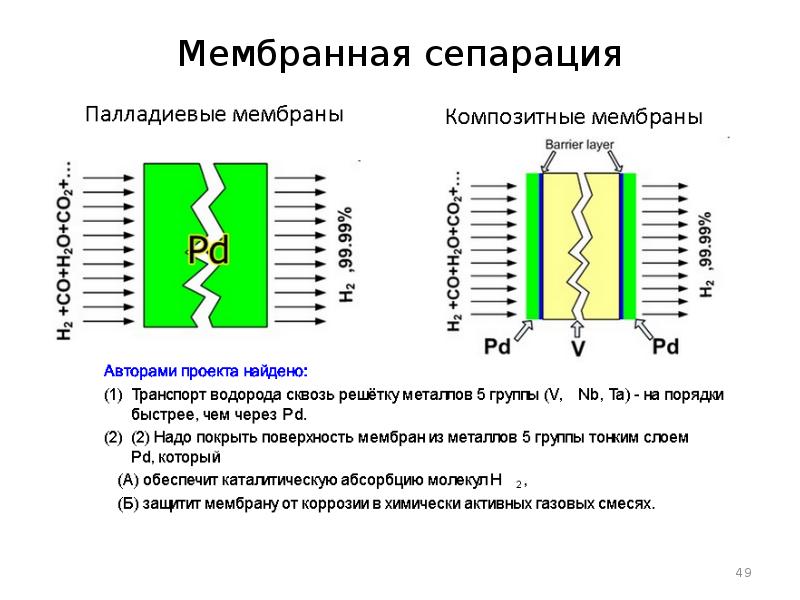
- 49. Мембранная сепарация
- 50. Паровая конверсия метана энергия активации разложения газовых гидратов метана составляет 333
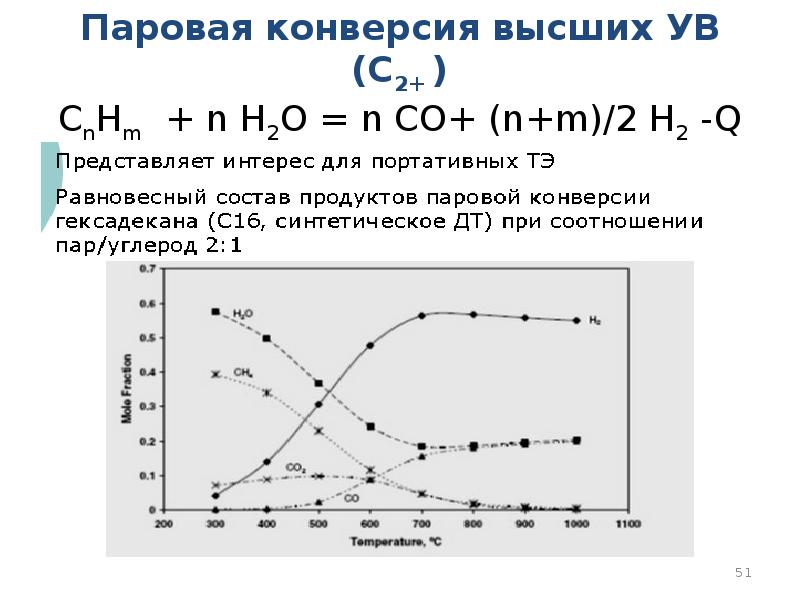
- 51. Паровая конверсия высших УВ (С2+ ) СnHm + n H2O =
- 54. Особенности восстановления и работы катализатора В свежем катализаторе никель находится в
- 55. Если Ni находится в виде соединении с Al2O3 (шпинели), то для
- 56. два существенных недостатка высокое содержание водорода в синтез-газе, что затрудняет его
- 57. Высокотемпературная конверсия СН4/ Кислородная конверсия (парциальное окисление)
- 58. два механизма парциального окисления метана: 1) последовательный механизм — глубокое
- 59. 2) прямой механизм — полная диссоциация метана и кислорода на поверхности:
- 60. Парокислородная конверсия (автотермический риформинг) СH4 + 0,5 О2 = CO+ 2
- 61. Углекислотная конверсия
- 62. Пароуглекислотная конверсия
- 63. Задачи риформинга:
- 64. Реакция сдвига – паровая конверсия СО водяным паром
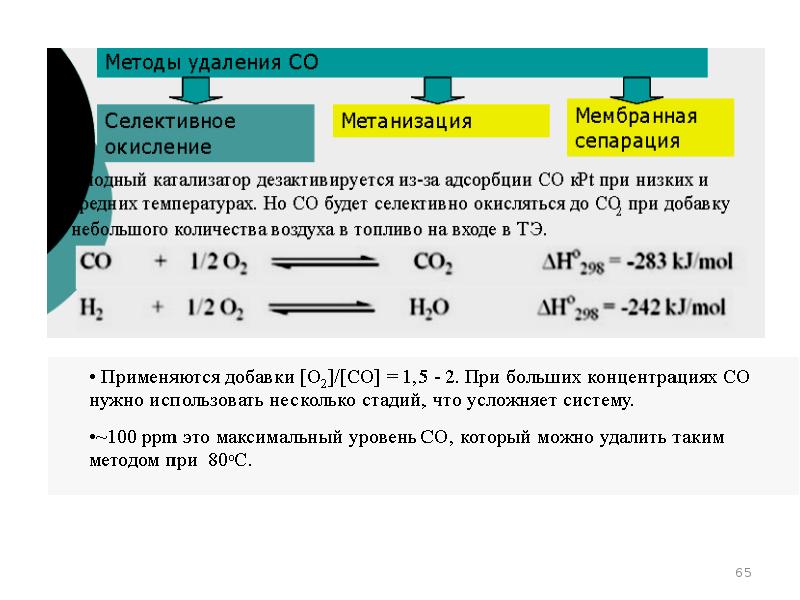
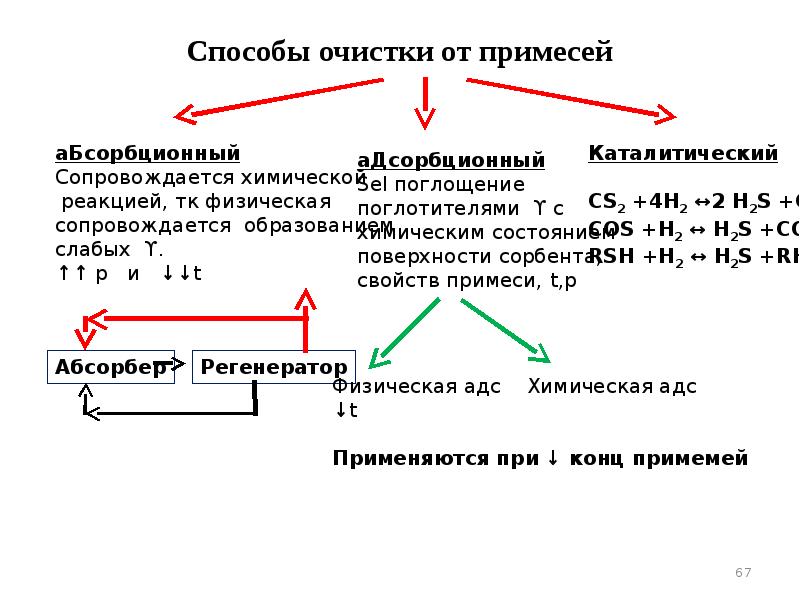
- 67. Способы очистки от примесей
- 68. Очистка природных газов от соединений серы. Углеводордные газы различных месторождений, кроме
- 69. Очистка от сернистых соединений Наиболее активный ↑коррозионная активность и агрессивность
- 70. Cтепень превращения меркаптана в меркаптид не превышает 80-85% даже при применении
- 71. Влияние амидов на степень извлечения меркаптановой серы
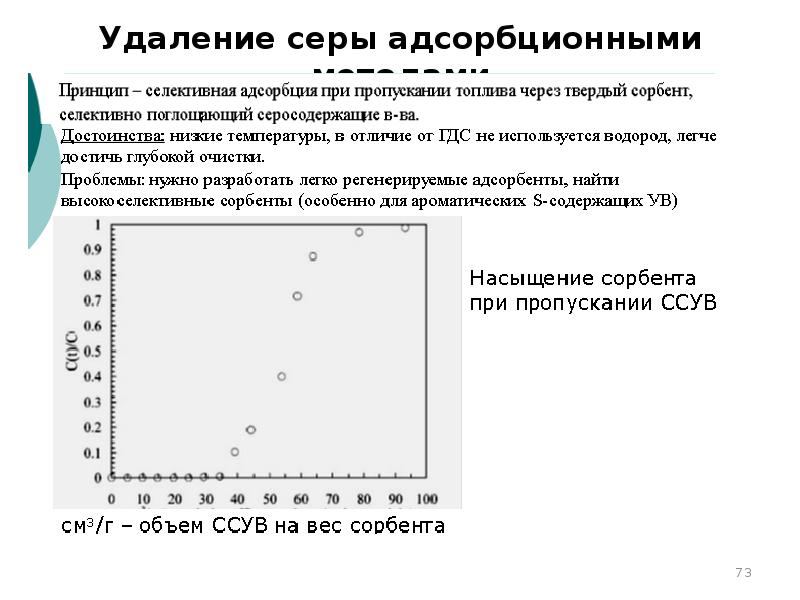
- 73. Удаление серы адсорбционными методами
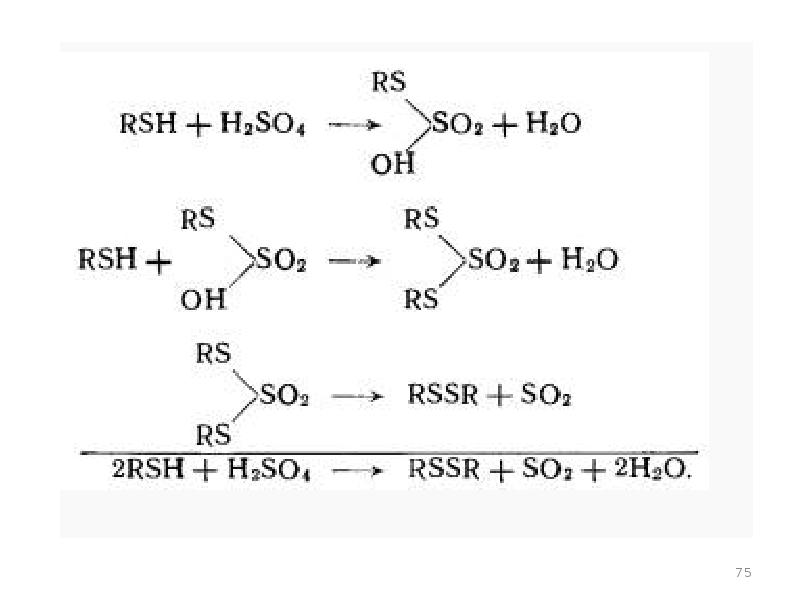
- 74. Реакции серосодержащих соединений. Сероводород окисляется с образованием элементарной серы и сернистого ангидрида:
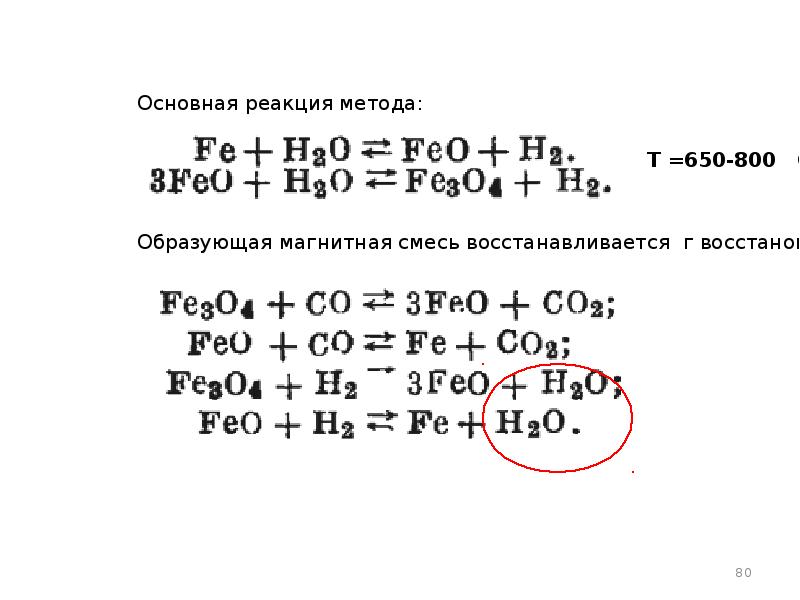
- 78. Железопаровой способ получения Н2
- 79. Аналогичный метод получения 1941-1945 Si+2NaOH+H20=Na2SiO3+2H2. За час этим способом можно
- 82. Установки получения водорода м-дом Электролиза применяют: Установки получения водорода м-дом Электролиза
- 83. Производство технического водорода электролизом воды, предназначенное для выпуска продукции марки “Б”
- 84. В процессе ЭХАВ происходят четыре основных процесса: 1) Электролитическое разложение
- 85. Чистая вода имеет удельную электрическую проводимость 0,055 микроОм при 25°С, дистиллированная
- 86. Физико-химические основы процесса
- 88. Таким образом:
- 89. Постановление Госгортехнадзора РФ от 06.06.2003 N 75 "Об утверждении Правил безопасности
- 91. Основные электродные процессы при электролизе Выделение Н2 на катоде и
- 92. В нейтральной и кислой среде на аноде происходит поляризация и
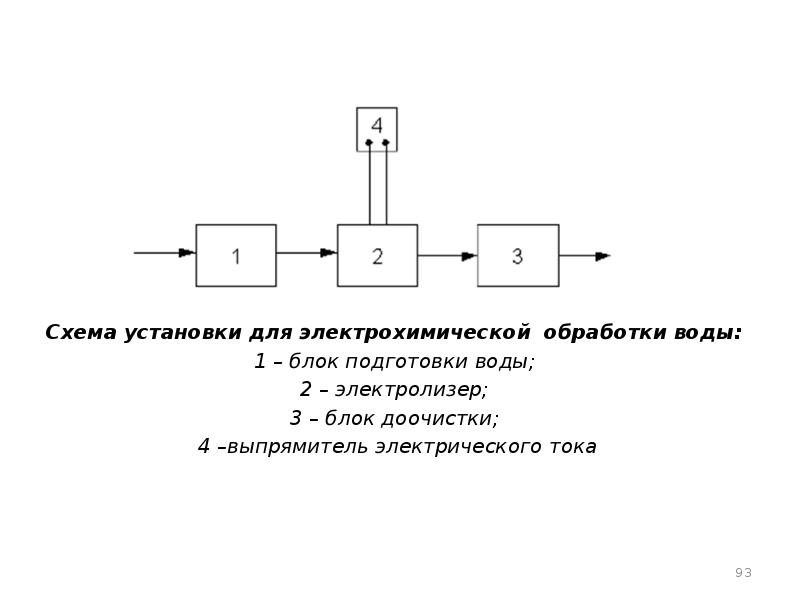
- 93. Схема установки для электрохимической обработки воды: 1 – блок подготовки
- 94. Количество вещества, прореагировавшего на электродах при пропускании постоянного электрического тока по
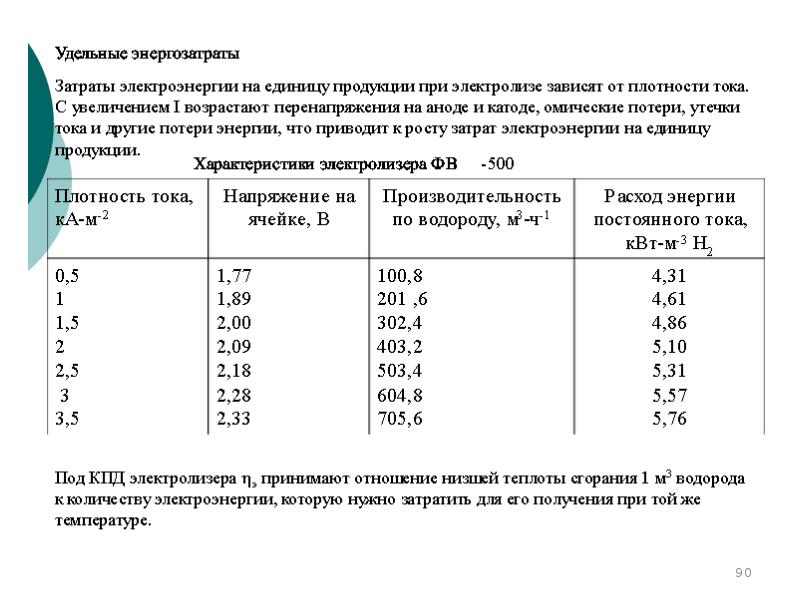
- 95. Потребляемая мощность, Вт, электролизера определяется по зависимости: Потребляемая мощность, Вт, электролизера
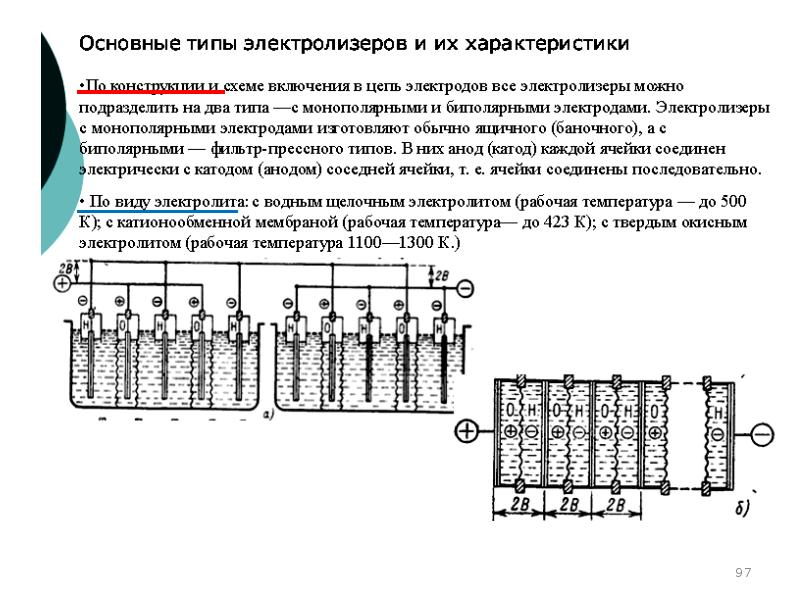
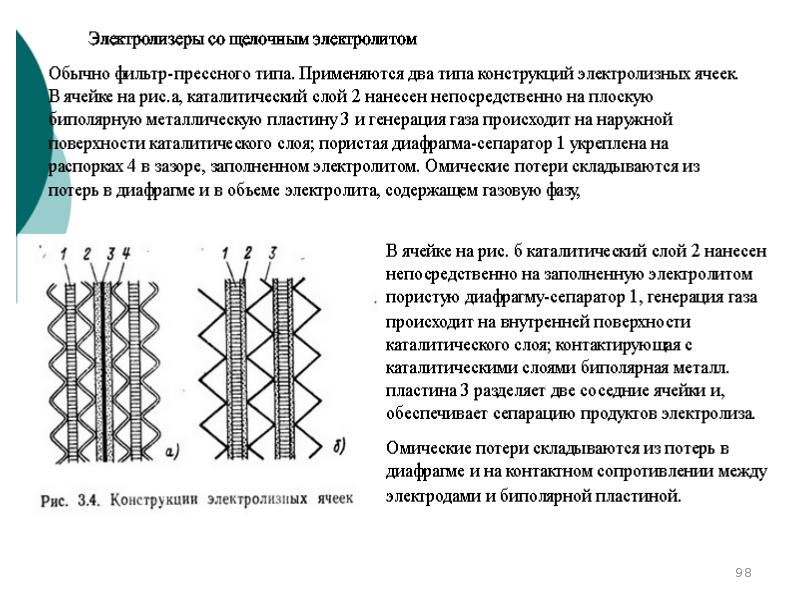
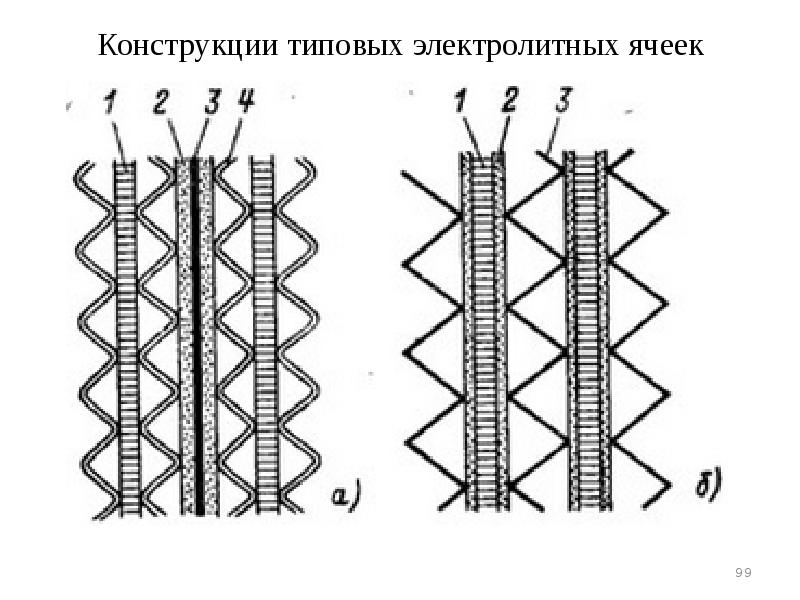
- 99. Конструкции типовых электролитных ячеек
- 102. Проблемы при использовании разного типа диафрагм
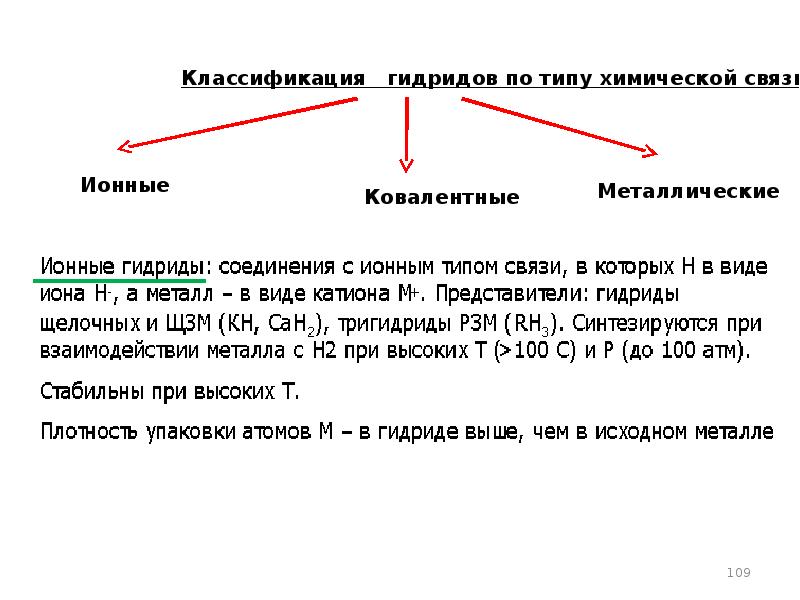
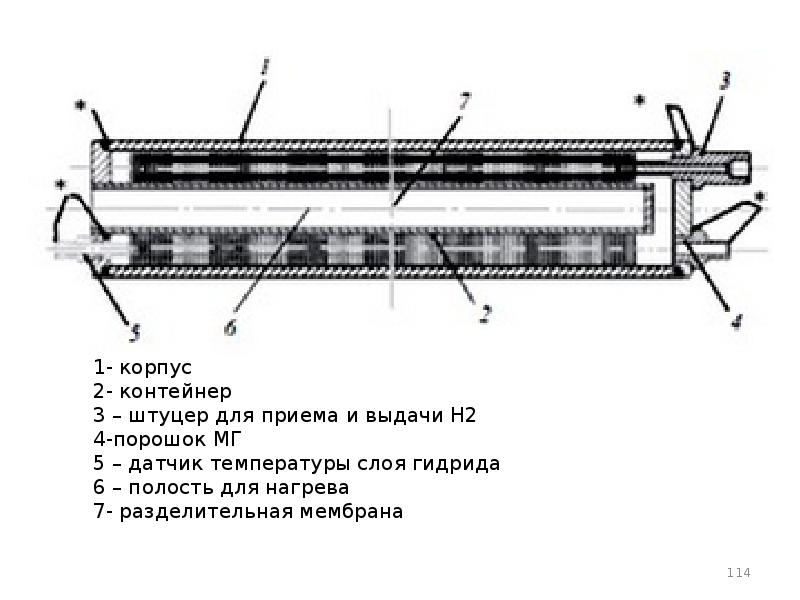
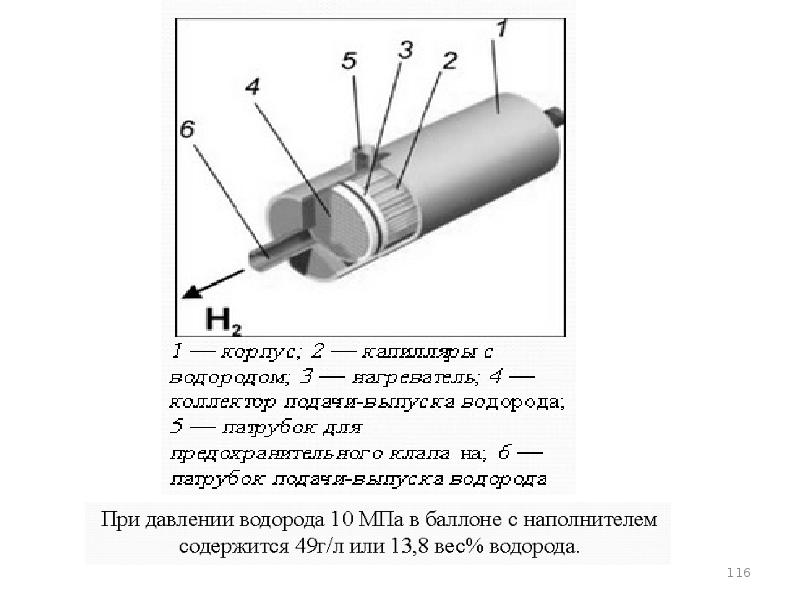
- 106. Металлогидриды
- 107. Интерметаллические соединения (ИМС)
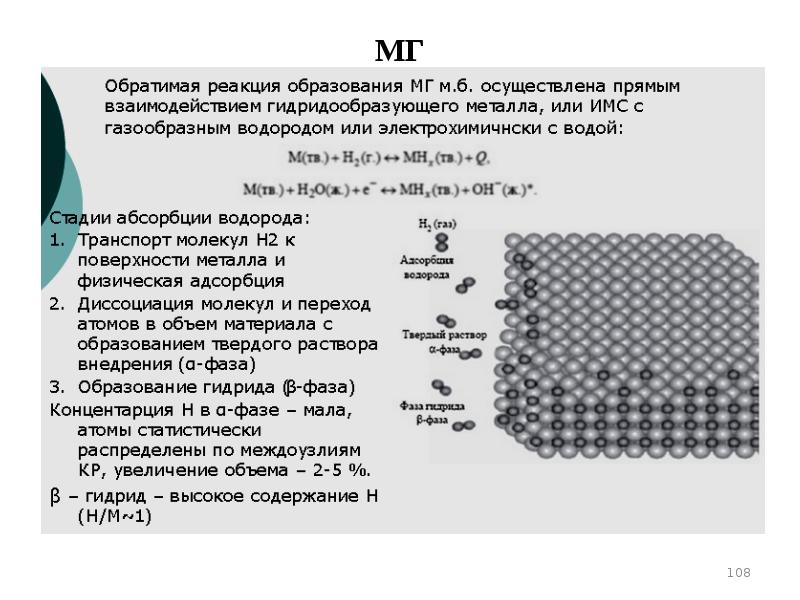
- 108. МГ
- 120. http://isjaee.hydrogen.ru/pdf/12_2005tarasov.pdf http://isjaee.hydrogen.ru/pdf/12_2005tarasov.pdf
- 121. Скачать презентацию






















































































Слайды и текст этой презентации
Похожие презентации





























