Распределение Максвелла. Распределение Больцмана презентация
Содержание
- 2. Распределение Максвелла В лекции 16 было введено понятие о вероятностях для
- 3. Распределение Максвелла В геометрическом смысле это означает вероятность того, что в
- 4. Распределение Максвелла Закон распределения молекул по скоростям был получен в конце
- 5. Распределение Максвелла Для непрерывной случайной величины, каковой является скорость молекулы, можно
- 6. Распределение Максвелла Аналогично можно ввести функции распределения f(vх), f(vy) и f(vz)
- 7. Распределение Максвелла В силу хаотичности молекулярного движения, каждая из функций распределения
- 8. Распределение Максвелла Обладание тем или иным значением одной компоненты скорости никак
- 9. Распределение Максвелла Для плотностей вероятностей f(vх), f(vy) и f(vz) получаем
- 10. Распределение Максвелла Поскольку , для производной получим следующее значение .
- 11. Распределение Максвелла Из равенства (17.8) следует, что функции различных аргументов совпадают
- 12. Распределение Максвелла Проведем интегрирование) четырех уравнений вида Вначале разделим
- 13. Распределение Максвелла Окончательно получаем . Тем же путем получим выражения
- 14. Распределение Максвелла Постоянная Z0 может быть найдена из условия
- 15. Распределение Максвелла Отсюда получаем для Между Z и Z0
- 16. Распределение Максвелла Окончательно получаем для функций распределения следующие выражения , ,
- 17. Распределение Максвелла Перейдем теперь к определению константы α. В лекции 16
- 18. Распределение Максвелла В соответствии с теорией вероятностей . В
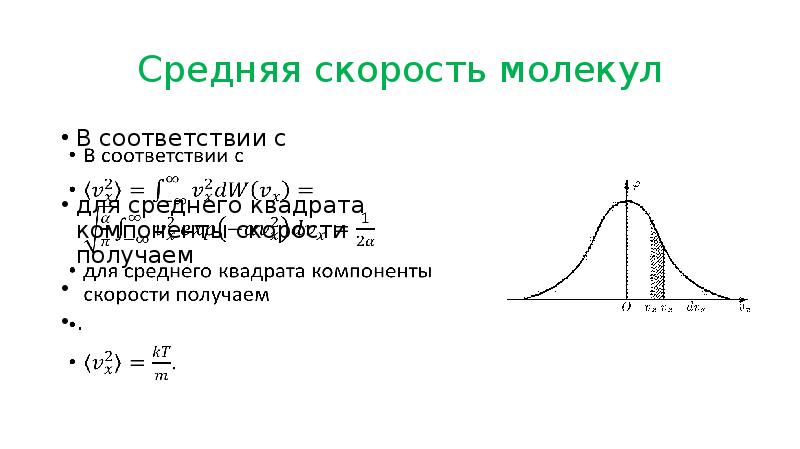
- 19. Средняя скорость молекул Вероятность молекул газа иметь компонент скорости (например, )
- 20. Средняя скорость молекул Среднее значение компоненты скорости можно вычислить по формуле
- 21. Средняя скорость молекул В соответствии с для среднего квадрата компоненты
- 22. Средняя скорость молекул Отсюда легко получить выражение для средней энергии движения
- 23. Средняя скорость молекул Вероятность найти в газе молекулу со скоростью равна
- 24. Средняя скорость молекул Нашей дальнейшей задачей является нахождения среднего модуля скорости
- 25. Средняя скорость молекул Распределение по скоростям в сферических координатах . (17.24)
- 26. Средняя скорость молекул . В итоге мы получаем вероятность найти
- 27. Средняя скорость молекул В геометрическом смысле это выражение определяет вероятность того,
- 28. Средняя скорость молекул Теперь мы можем найти средний модуль скорости (среднюю
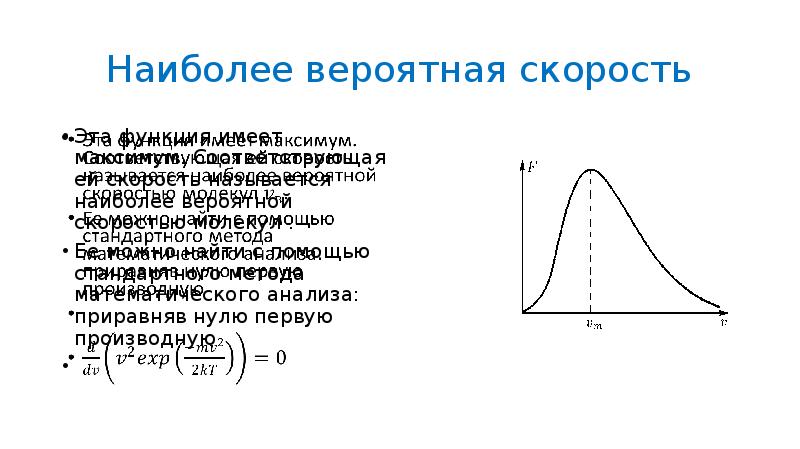
- 29. Наиболее вероятная скорость Эта функция имеет максимум. Соответствующая ей скорость называется
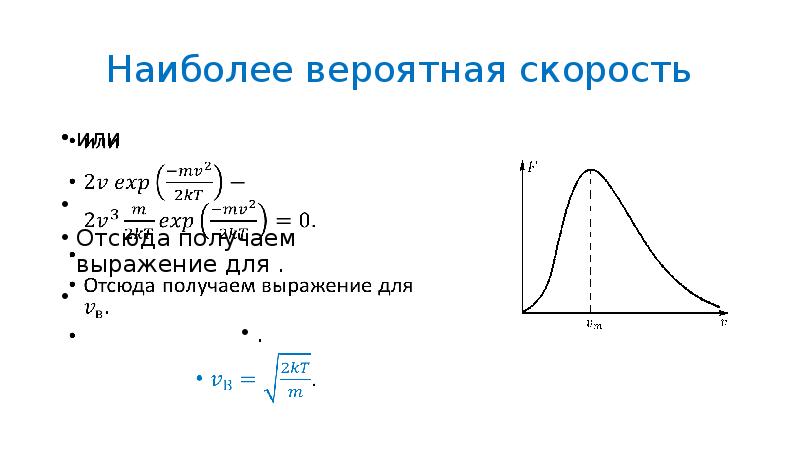
- 30. Наиболее вероятная скорость или Отсюда получаем выражение для .
- 31. Наиболее вероятная скорость Введя относительную скорость , как отношение скорости молекулы
- 32. Наиболее вероятная скорость
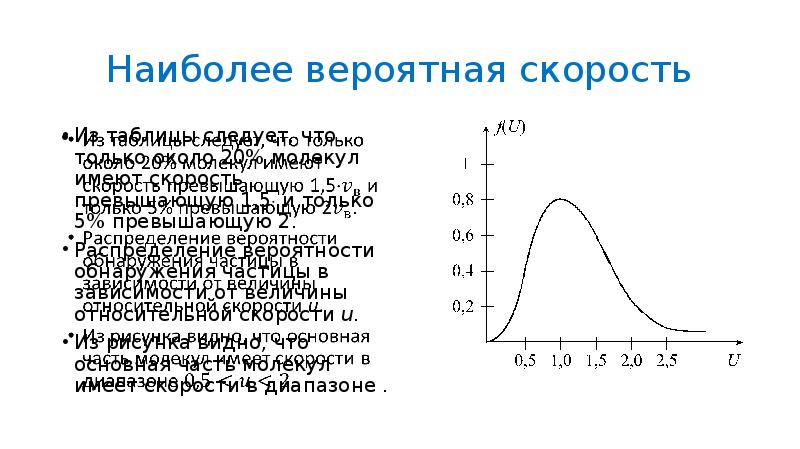
- 33. Наиболее вероятная скорость Из таблицы следует, что только около 20% молекул
- 34. Молекулярные пучки (потоки) Надем поток молекул в вакуум через малое отверстие
- 35. Молекулярные пучки (потоки) Если отверстие находится в стенке лежащей в плоскости
- 36. Молекулярные пучки (потоки) Количество молекул dj, имеющих компоненту скорости от и
- 37. Молекулярные пучки (потоки) Полный поток через отверстие J можно получить, интегрируя
- 38. Молекулярные пучки (потоки) Распределение молекул в потоке по скоростям отличается от
- 39. Молекулярные пучки (потоки) , , .
- 40. Молекулярные пучки (потоки) Значения средних величин в потоке больше, чем у
- 41. Закон равнораспределения энергии по степеням свободы Как мы уже отмечали, средняя
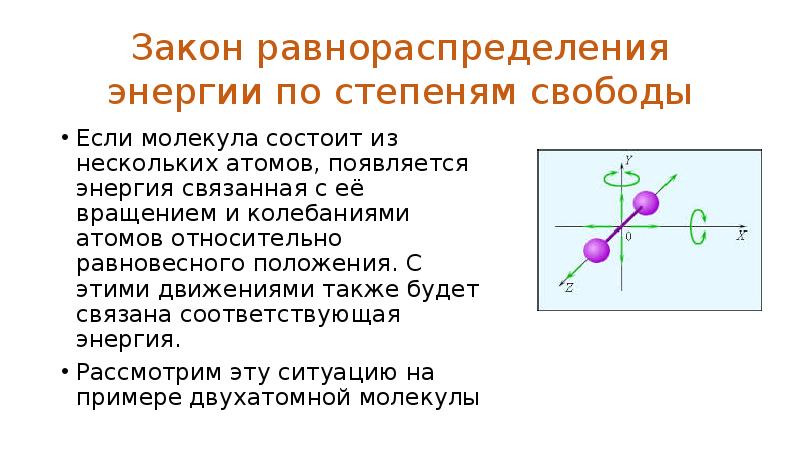
- 42. Закон равнораспределения энергии по степеням свободы Если молекула состоит из нескольких
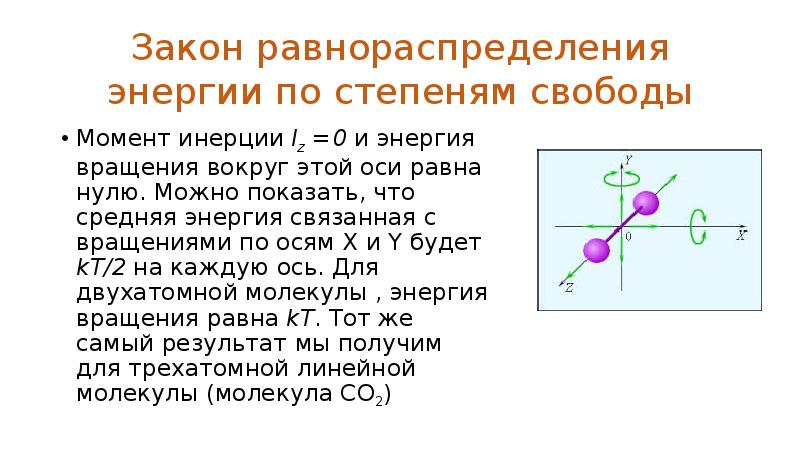
- 43. Закон равнораспределения энергии по степеням свободы Момент инерции Iz =0 и
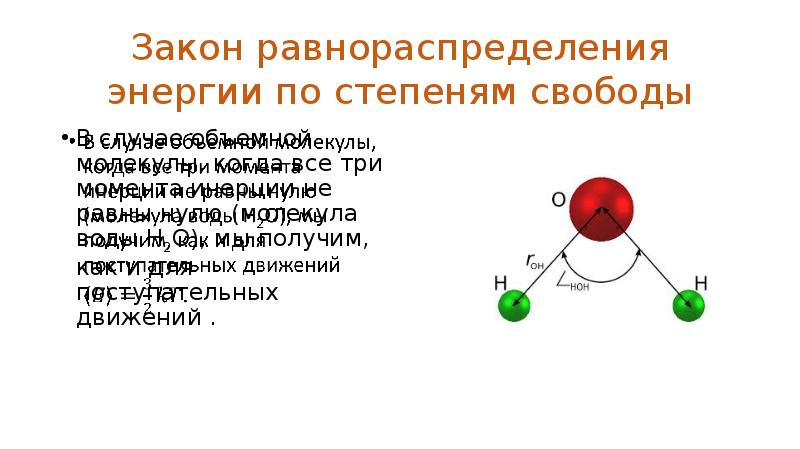
- 44. Закон равнораспределения энергии по степеням свободы В случае объемной молекулы, когда
- 45. Закон равнораспределения энергии по степеням свободы При колебаниях атомов в молекуле
- 46. Закон равнораспределения энергии по степеням свободы Квантовая природа молекулярных движений вносит
- 47. Барометрическая формула На практике часто приходится иметь дело с газом, находящимся
- 48. Барометрическая формула Будем рассматривать газ в сосуде высотой h, с температурой,
- 49. Барометрическая формула С другой стороны, вес газа равен просто весу всех
- 50. Барометрическая формула Приравнивая получим Если газ идеальный, то р
- 51. Барометрическая формула Интегрируя, получаем зависимость плотности от высоты: . Полное
- 52. Барометрическая формула Для условий земной атмосферы h0 10 км. Сооружаемые
- 53. Барометрическая формула Необходимо подчеркнуть, что формула применима только к изотермической "тонкой"
- 54. Барометрическая формула Воздух представляет собой смесь газов, молекулы которых имеют различную
- 55. Распределение Больцмана Распределению молекул по высоте можно придать несколько иной вид.
- 56. Распределение Больцмана В произвольной системе координат распределение (17.42) будет иметь вид
- 57. Распределение Больцмана Это распределение может использоваться для произвольного типа взаимодействия (то
- 58. Распределение Больцмана Это распределение называется распределением Больцмана. Нормировочная постоянная в
- 59. Центрифугирование, разделение изотопов Центрифугирование нашло широкое применение в химии и биологии
- 60. Центрифугирование, разделение изотопов на частицы действует центробежная сила. Соответствующая потенциальная энергия
- 61. Центрифугирование, разделение изотопов Для концентрации частиц получается формула .
- 62. Центрифугирование, разделение изотопов Из формулы следует, что концентрация тяжелых частиц у
- 63. До следующей лекции
- 64. Скачать презентацию
























































Слайды и текст этой презентации
Скачать презентацию на тему Распределение Максвелла. Распределение Больцмана можно ниже:
Похожие презентации





























