Растворение сплавов. Коррозия презентация
Содержание
- 2. Сплавы могут быть твердыми растворами, интерметаллидами и механическими смесями (эвтектические). Растворение
- 3. Селективность растворения - это преимущественный переход в раствор электроотрицательного компонента
- 4. АА и АВ молярные массы А и В, [A]o и [B]o
- 5. Селективное растворение обычно имеет место для сплавов, компоненты которых имеют существенно
- 6. Для тугоплавких сплавов с низкой [A]o СР обычно лимитируется нестационарной твердофазной
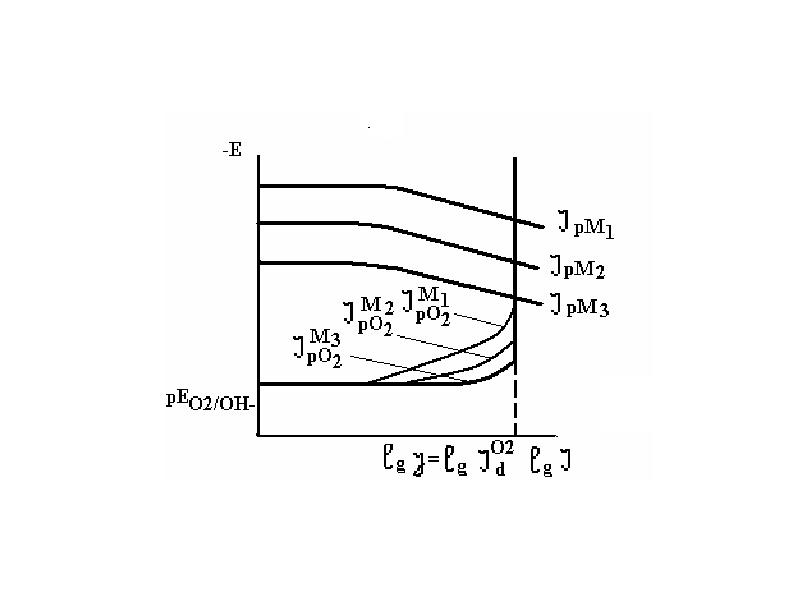
- 7. Для сплавов с высокой [A]o, наряду с растворением А, возможна фазовая
- 8. Равномерное растворение При РР сплава, когда его поверхность практически состоит
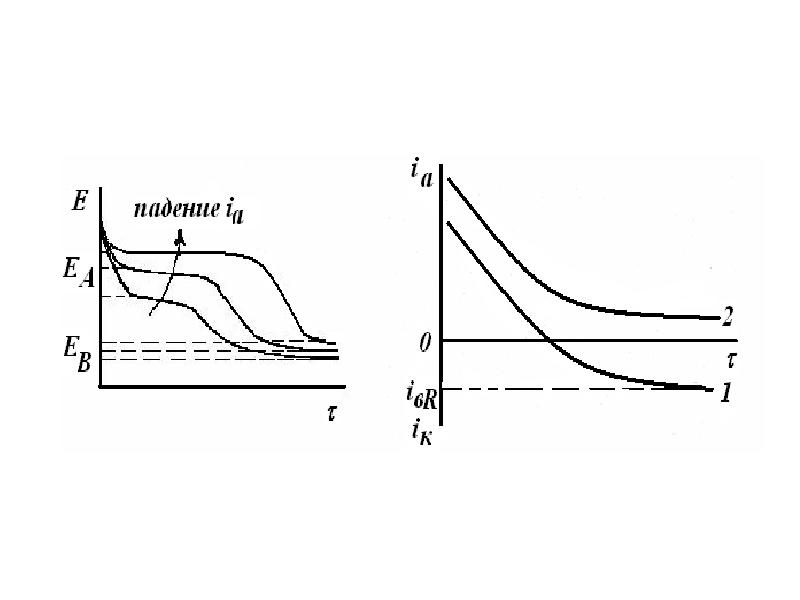
- 10. Для анодной хронопотенциограммы при ia=const Для анодной хронопотенциограммы при ia=const
- 11. Хроноамперограммы (E=const, i3=0) имеют вид I при EB>E>EA и вид 2
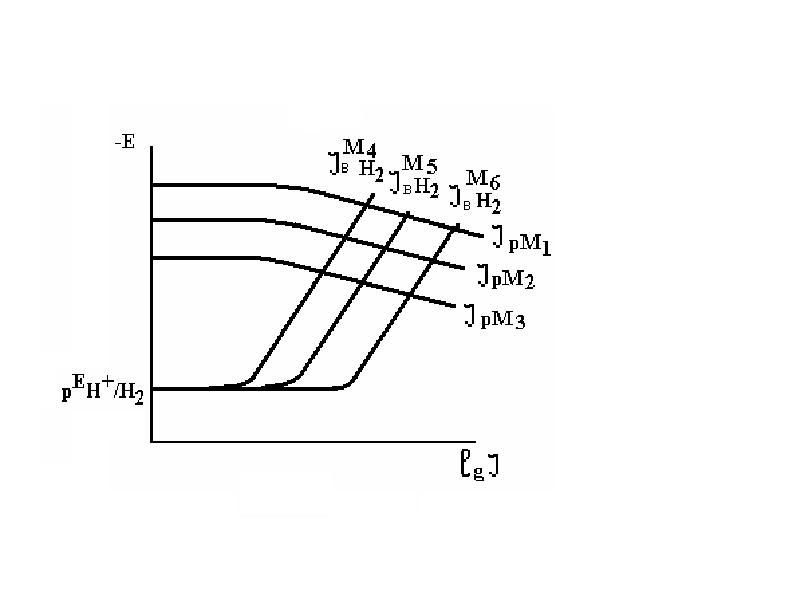
- 12. ВАЖНЕЙШИЕ ВИДЫ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ Различия процессов, протекающих с кислородной
- 13. Кислородная деполяризация Кислородная деполяризация при коррозии большинства технически важных
- 14. Скорость коррозии в нейтральных средах практически не зависит от природы основного
- 16. Водородная деполяризация Протекает с кинетическим контролем, j существенно зависит от
- 18. Атмосферная коррозия Самый распространенный вид и протекает под тонкими пленками электролита.
- 19. Подземная коррозия Вызывается окислителями (О2, Н3О+) и бывает грунтовой или блуждающими
- 20. Коррозия в морской и пресной воде Особенности процесса -
- 21. Коррозия в водно-органических средах В протонных средах процесс
- 22. Коррозия в двухфазных системах углеводород-электролит Подразделяются на эмульсионные и
- 23. Таким образом, фаза углеводорода является аккумулятором кислорода и сероводорода. Поэтому коррозия
- 24. Скачать презентацию



![АА и АВ молярные массы А и В, [A]o и [B]o АА и АВ молярные массы А и В, [A]o и [B]o](/documents_3/6a1f0045958a898077736e831ec33681/img3.jpg)

![Для тугоплавких сплавов с низкой [A]o СР обычно лимитируется нестационарной твердофазной Для тугоплавких сплавов с низкой [A]o СР обычно лимитируется нестационарной твердофазной](/documents_3/6a1f0045958a898077736e831ec33681/img5.jpg)
![Для сплавов с высокой [A]o, наряду с растворением А, возможна фазовая Для сплавов с высокой [A]o, наряду с растворением А, возможна фазовая](/documents_3/6a1f0045958a898077736e831ec33681/img6.jpg)













Слайды и текст этой презентации
Похожие презентации