Растворы презентация
Содержание
- 2. РАСТВОРЫ Состоят из: - растворителя (компонент, присутствующий в растворе в
- 3. РАСТВОРЫ Состав растворов описывается с помощью концентрации -
- 4. РАСТВОРЫ Образование растворов - сложный физико-химический процесс Сопровождается: увеличением энтропии
- 5. РАСТВОРЫ Физическая теория растворов процесс растворения - распределение частиц
- 6. РАСТВОРЫ Химическая теория процесс растворения - образование смеси неустойчивых
- 7. РАСТВОРЫ Современная теория При растворении - изменение свойств растворителя и
- 8. РАСТВОРЫ Современная теория Процесс растворения – взаимодействие частиц разной полярности
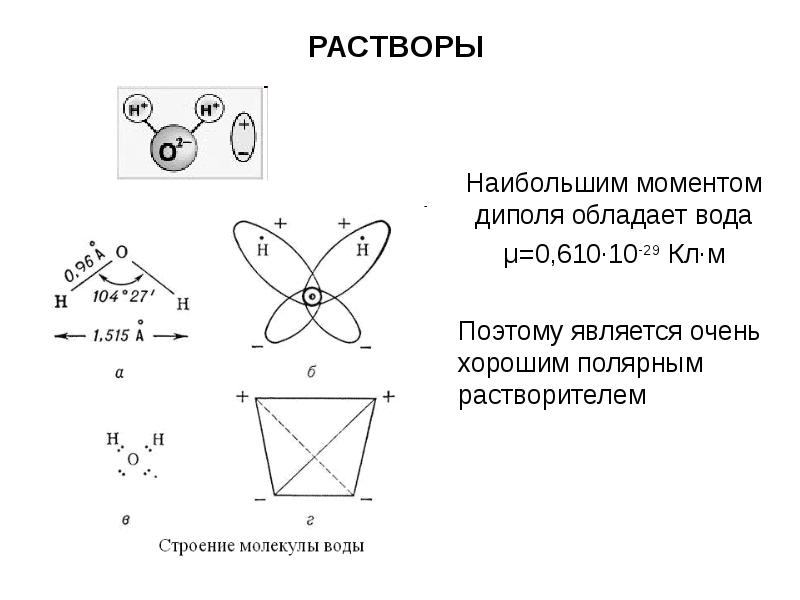
- 9. РАСТВОРЫ Наибольшим моментом диполя обладает вода μ=0,610·10-29 Кл·м Поэтому является
- 10. РАСТВОРЫ Растворимость газов в газах Газообразное состояние характеризуется слабым взаимодействием
- 11. РАСТВОРЫ Растворимость газов в жидкостях Зависит от: природы газа и
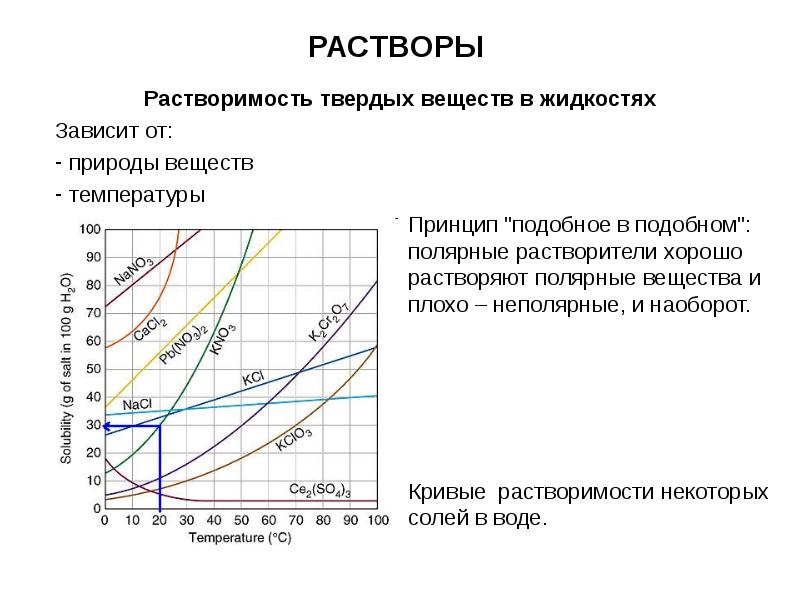
- 12. РАСТВОРЫ Растворимость твердых веществ в жидкостях Зависит от: природы веществ
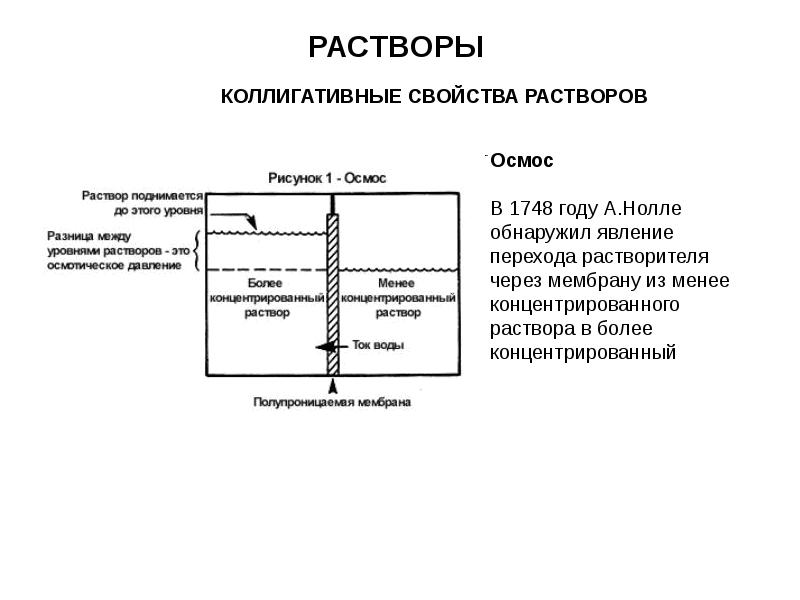
- 13. РАСТВОРЫ КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ
- 14. РАСТВОРЫ КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ
- 15. РАСТВОРЫ Значение осмоса Важную роль во многих биологических процессах при
- 16. РАСТВОРЫ Первый закон Рауля: Парциальное давление насыщенного пара компонента раствора
- 17. РАСТВОРЫ Температура кристаллизации разбавленных растворов Температура начала кристаллизации - начало
- 18. РАСТВОРЫ Температура кипения растворов нелетучего вещества всегда выше, чем температура
- 19. РАСТВОРЫ Т.о., второй закон Рауля можно в наиболее общем виде
- 20. Скачать презентацию
















Слайды и текст этой презентации
Похожие презентации





























