Реакции замещения презентация
Содержание
- 2. Генри Кавендиш Основные труды Кавендиша относятся к химии газов и различным
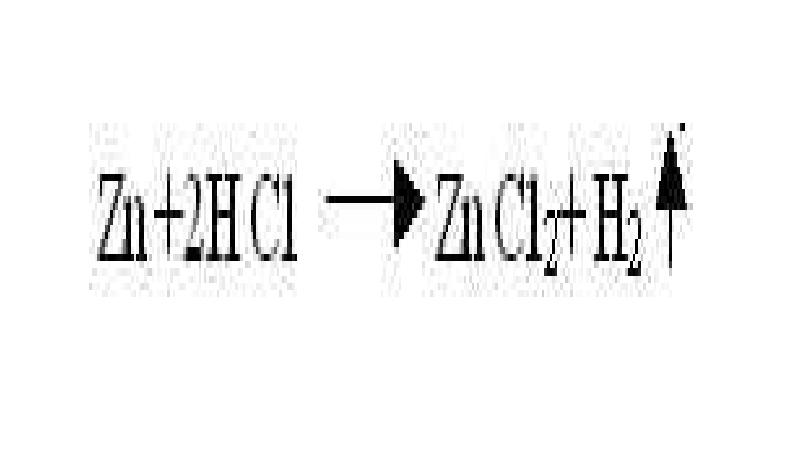
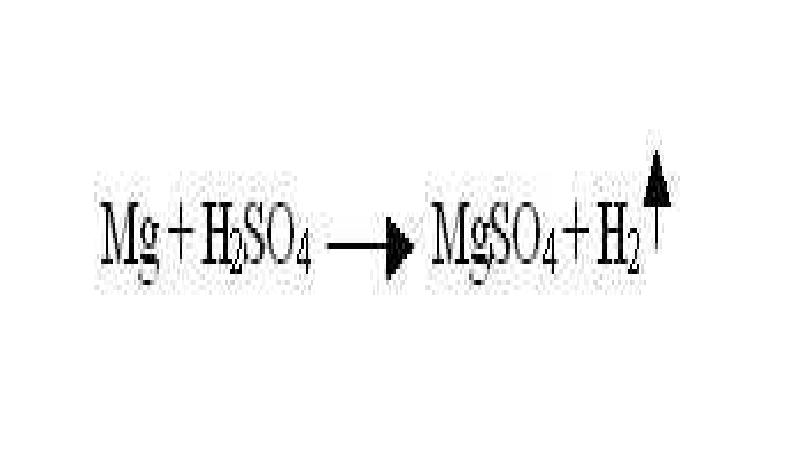
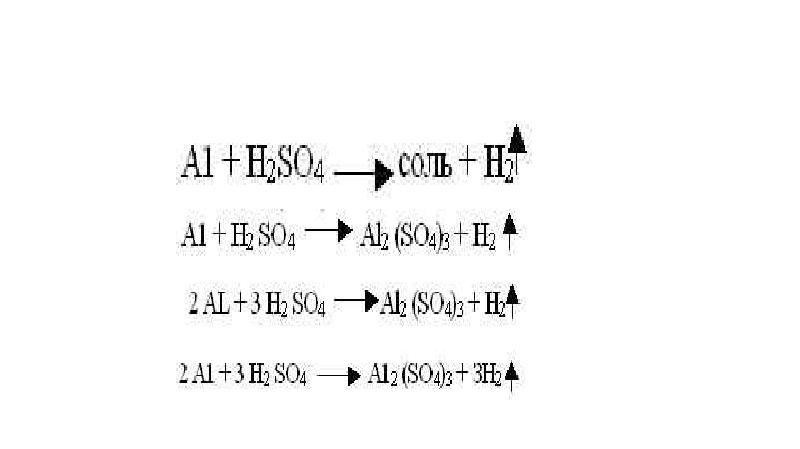
- 5. Реакции замещения - реакции между простыми и сложными веществами, при протекании
- 8. Электрохимический ряд напряжений металлов
- 9. Электрохимический ряд напряжений металлов
- 10. Правила ряда напряжения: 1) если металл стоит в этом ряду до
- 11. 2) если металл стоит в ряду напряжений до металла соли, то
- 13. 2 Al+3CuCl₂=2AlCl₃+ 3Cu
- 14. Cu+2AgNO₃=2Ag+Cu(NO₃)₂
- 16. 2Fe+3CL₂=2FeCl₃ - реакция соединения 2Fe+3CL₂=2FeCl₃ - реакция соединения Fe+CuCl₂=FeCl₂+Cu – реакция
- 17. Д/З: §16 (учебник Рудзитис Г.Е. 8кл.) Упражнение 5-6 стр.47
- 18. Скачать презентацию








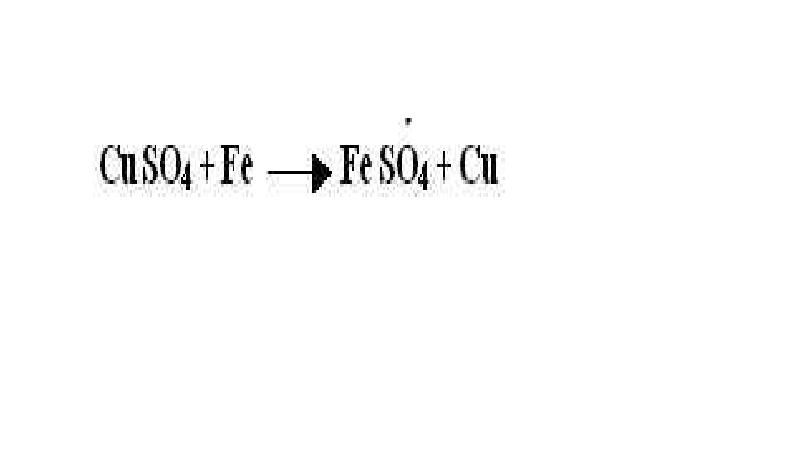
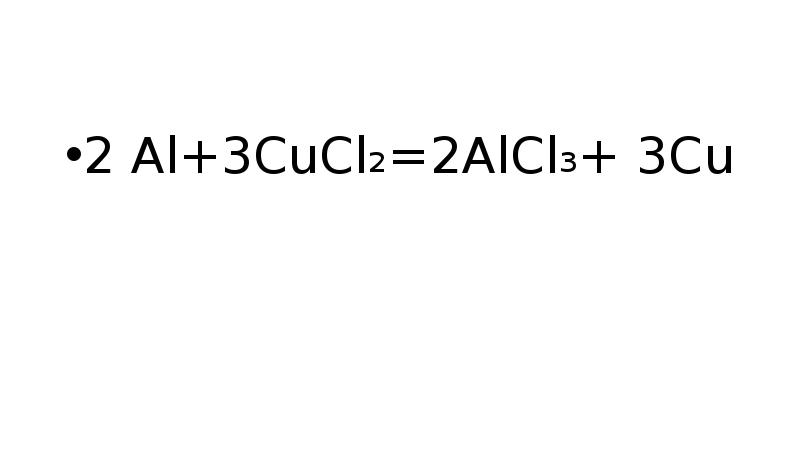
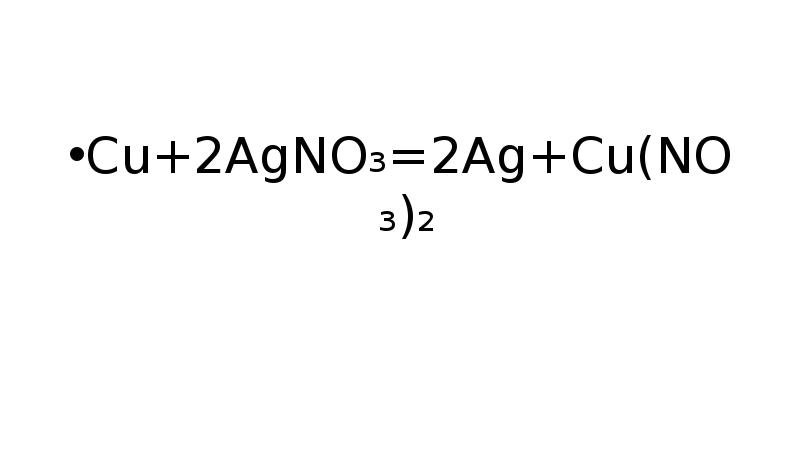
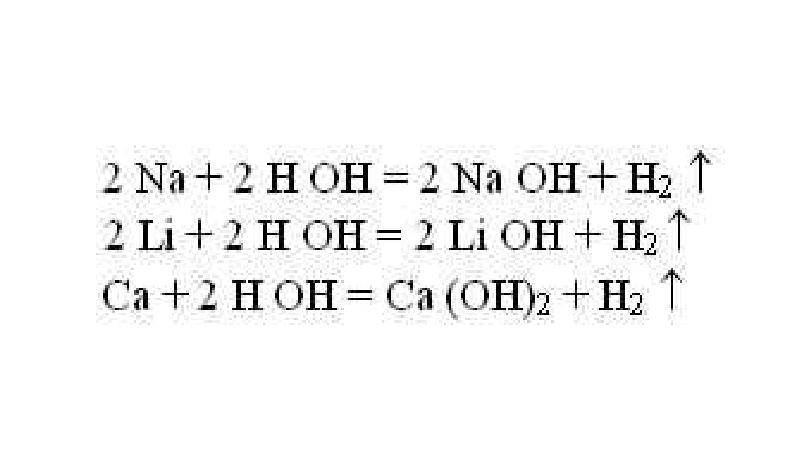


Слайды и текст этой презентации
Похожие презентации





























