Редкоземельные металлы презентация
Содержание
- 2. Редкоземельные металлы (или редкие земли, сокр. REE) — группа из 17
- 3. Скандий Скандий — лёгкий металл серебристого цвета с характерным жёлтым отливом.
- 4. Иттрий — металл светло-серого цвета. Это редкоземельный химический элемент, имеющий атомный
- 5. Лантан Лантан- — блестящий металл серебристо-белого цвета Температура кипения лантана
- 6. Це́рий. Церий представляет собой серебристо-белый вязкий и ковкий металл, легко
- 7. Празеодим Празеодим — светло-серый металл. Температура кипения 3785 K, Температура плавления
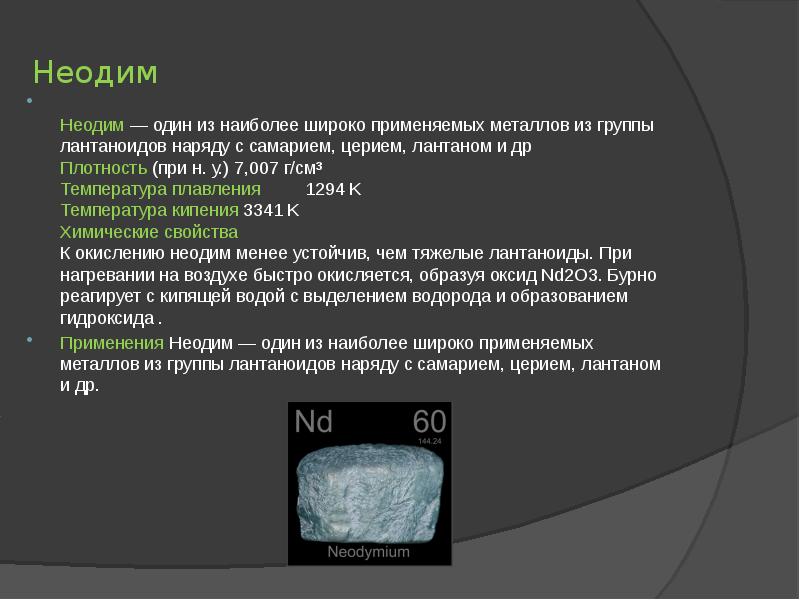
- 8. Неодим Неодим — один из наиболее широко применяемых металлов из группы
- 9. ПРОМЕ́ТИЙ ПРОМЕ́ТИЙ - радиоактивный металл серебристо-белого цвета Температура плавления 1170°C,
- 10. Самарий. Самарий — серебристо-желтый металл Температура плавления 1350 K Температура кипения
- 11. Европий Европий — серебристо-белый металл. В чистом виде — мягкий серебристо-белый
- 12. Гадолиний Плотность (при н. у.) 7,900 г/см³ Температура плавления 1586 K
- 13. Тербий Плотность (при н. у.) 8,229 г/см³ Температура плавления 1 629
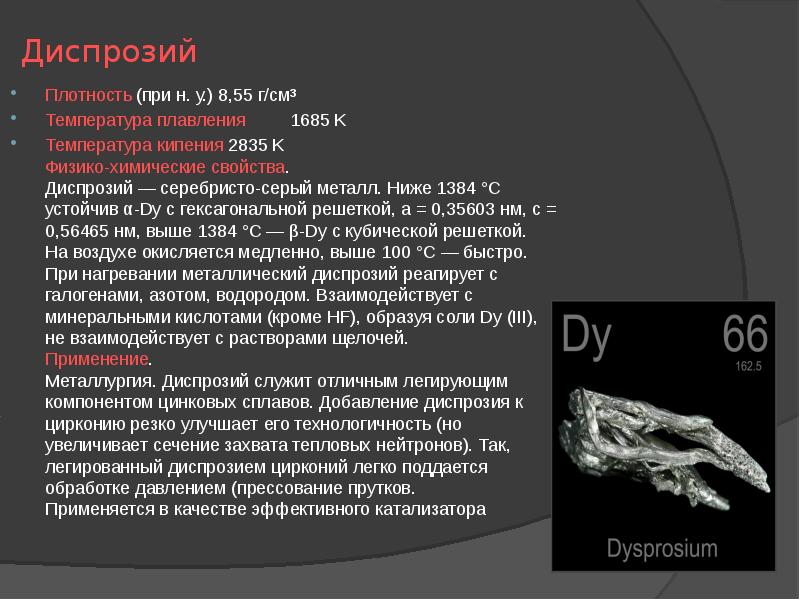
- 14. Диспрозий Плотность (при н. у.) 8,55 г/см³ Температура плавления 1685 K
- 15. Гольмий Плотность (при н. у.) 8,795 г/см³ Температура плавления 1 747
- 16. Эрбий Плотность (при н. у.) 9,06 г/см³ Температура плавления 1 802
- 17. Тулий Температура плавления 1818 K Температура кипения 2220 K Плотность (при
- 18. Иттербий Температура плавления 1097 K Температура кипения 1466 K Плотность (при
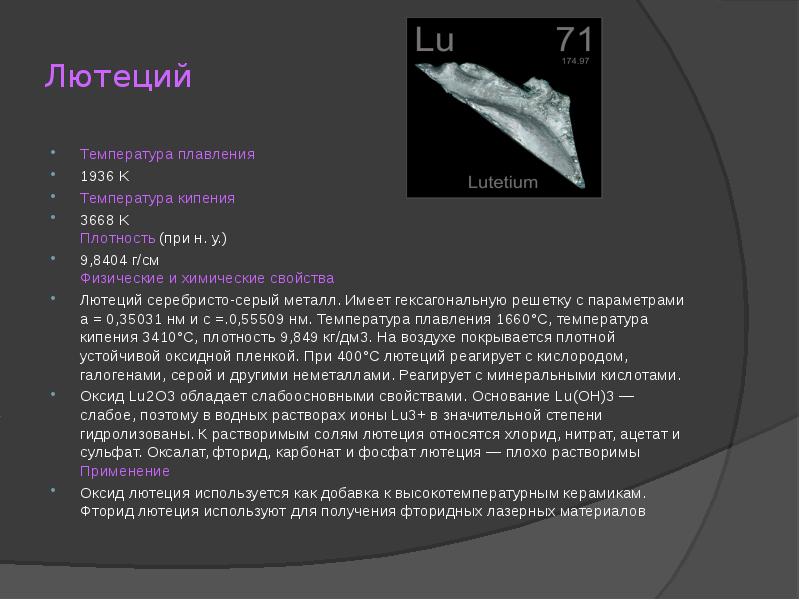
- 19. Лютеций Температура плавления 1936 K Температура кипения 3668 K Плотность (при
- 20. Скачать презентацию
















Слайды и текст этой презентации
Похожие презентации





























