Розчинник презентация
Содержание
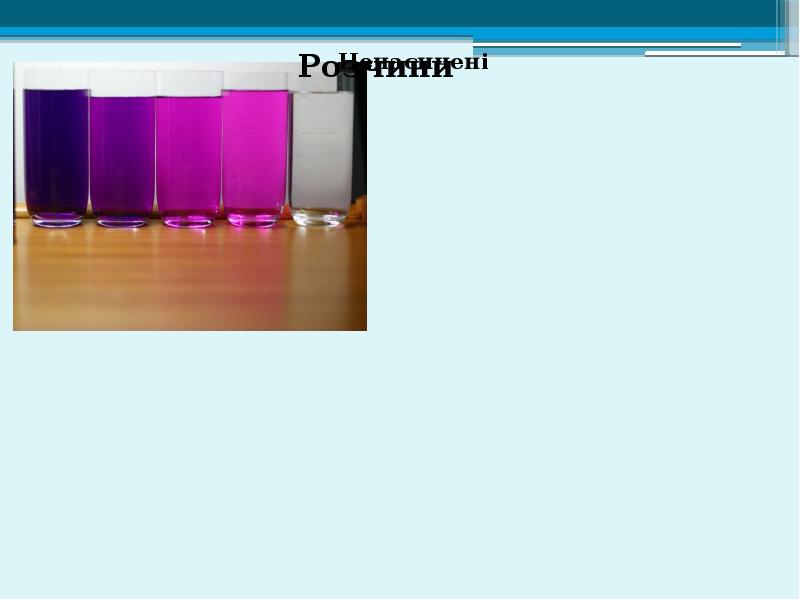
- 2. Розчини - однорідна багатокомпонентна система, що складається з розчинника, розчинених речовин
- 4. Процес взаємодії розчинника і розчиненої речовини називається сольватацією, якщо розчинником є
- 6. Розчинністю - називається здатність речовини розчинятися в тому чи іншому розчиннику.
- 8. Чинники, що впливають на розчинність
- 9. Концентрація розчинів Масова частка розчиненої речовини - це безрозмірна величина,що дорівнює
- 10. Дисперсні системи – це системи, в яких одна речовина рівномірно розподілено
- 11. Суспензії - це дисперсні системи, в яких дисперсної фазою є тверда
- 12. Емульсії - це дисперсні системи, в яких і дисперсна фаза і
- 13. Колоїдні розчини - це високодисперсні двофазні системи, що складаються з дисперсійного
- 15. Для осадження золю необхідно, щоб його частинки з'єдналися в більш великі
- 16. Колігативні властивості— властивості розчинів, які залежать від кількості частинок розчинених речовин
- 17. Зниження тиску насиченої пари розчину описується законом Рауля: відносне зниження тиску
- 18. Щоб кількісно оцінити збільшення температури кипіння і зменшення температури плавлення розчину,
- 19. Осмос— це спонтанний перехід чистого розчинника у розчин, відділений від нього
- 20. Причини застосування розчинів
- 21. Дякуємо за увагу!
- 22. Скачать презентацию



















Слайды и текст этой презентации
Похожие презентации





























