Скорость химических реакций. Химическое равновесие презентация












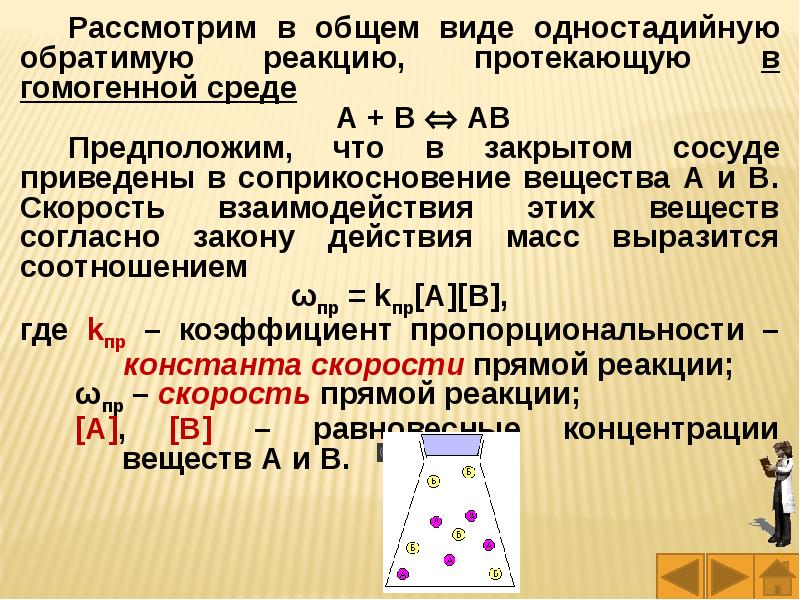



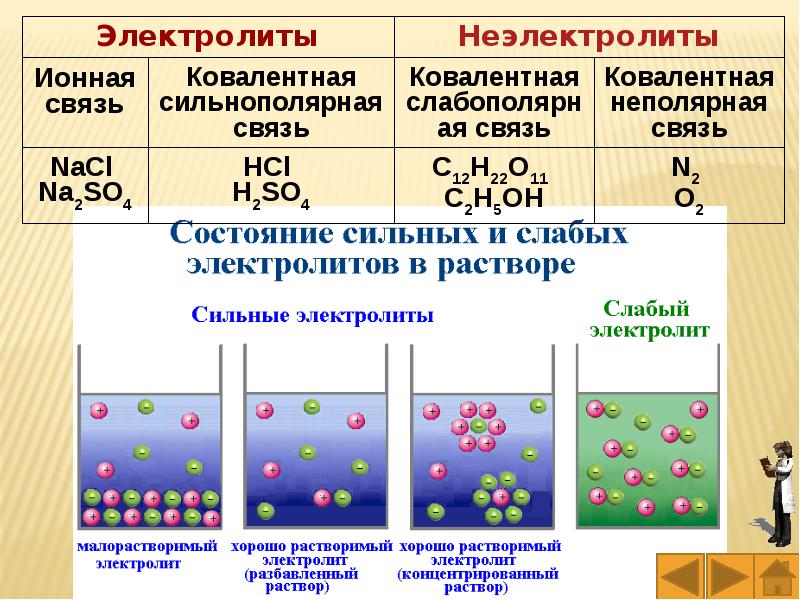
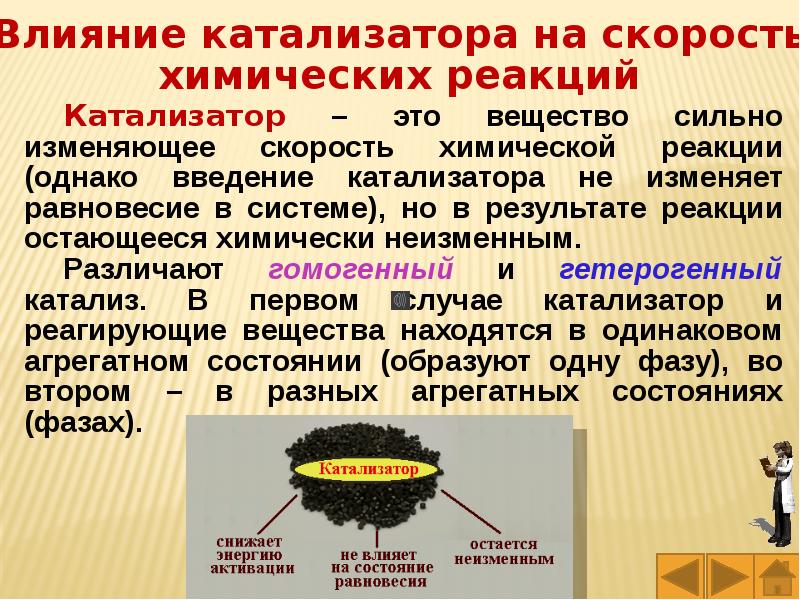

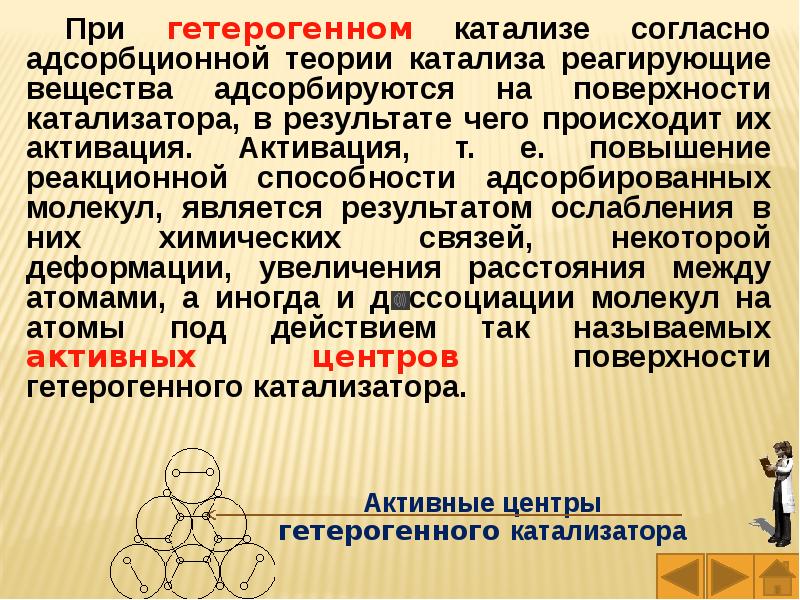











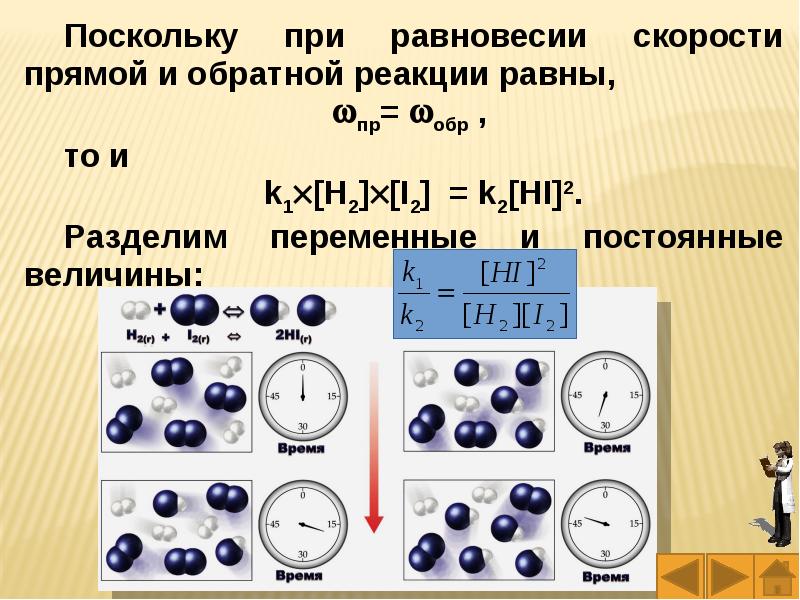
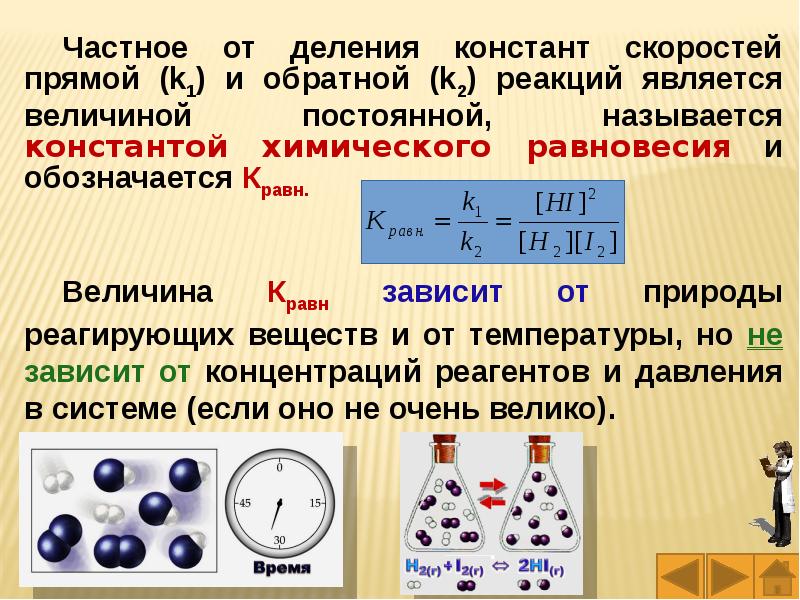

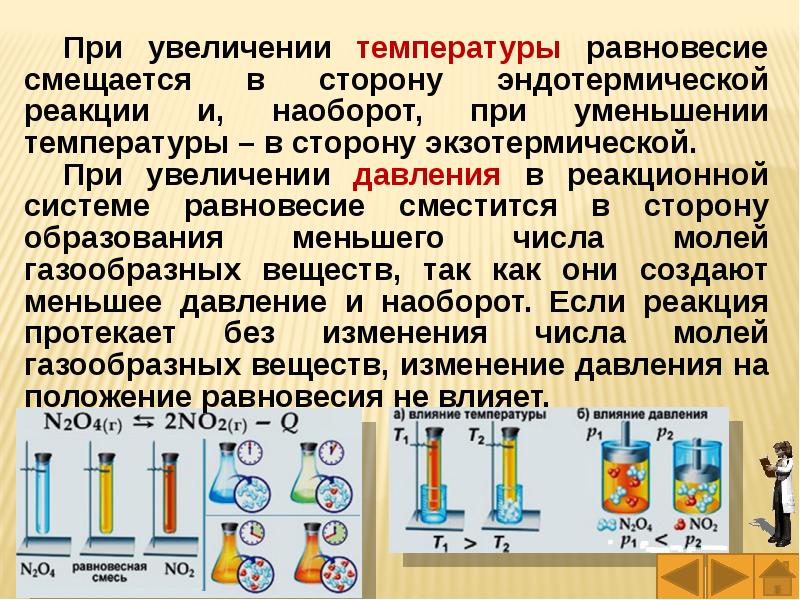

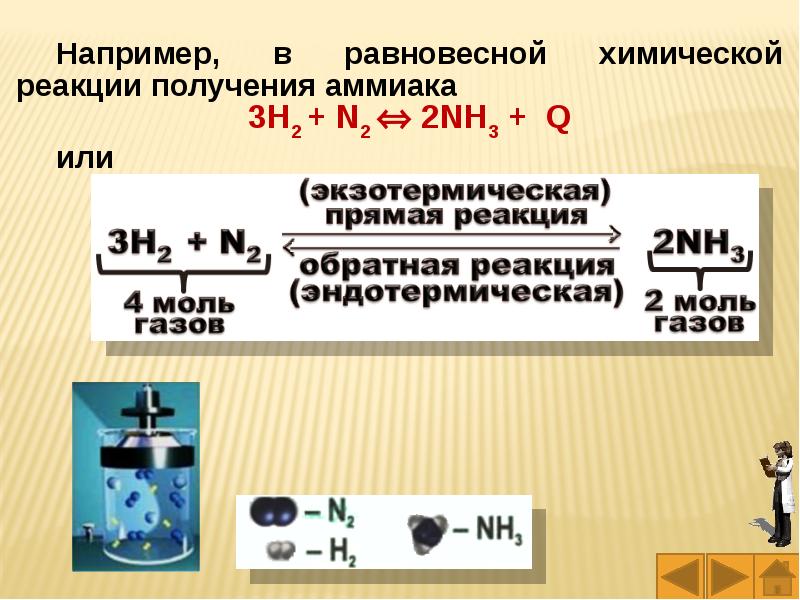
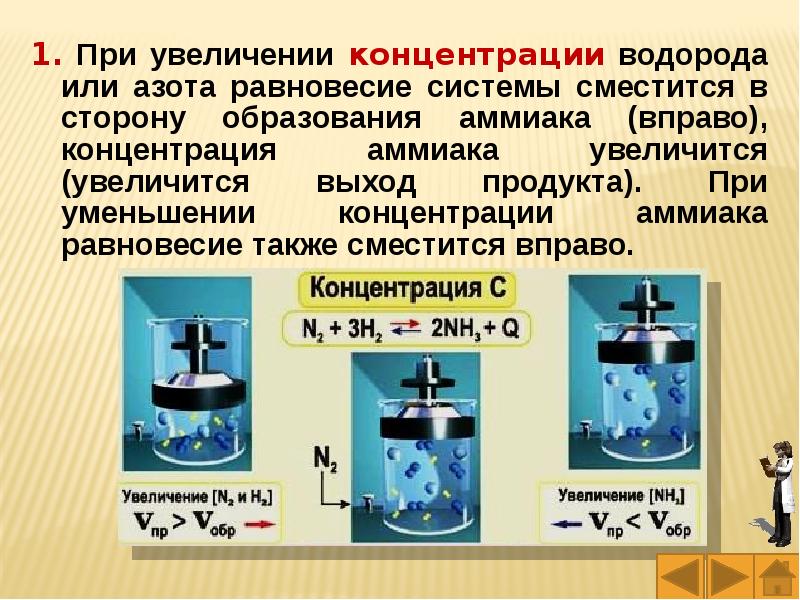
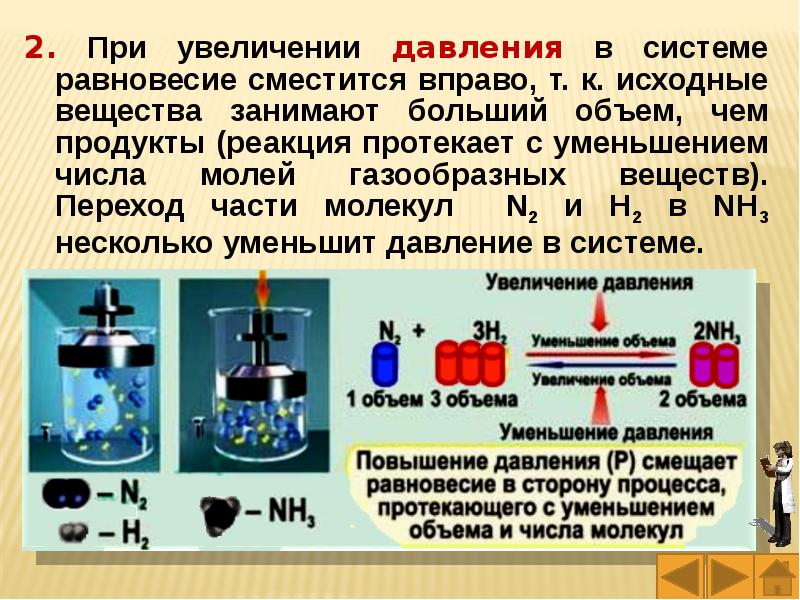




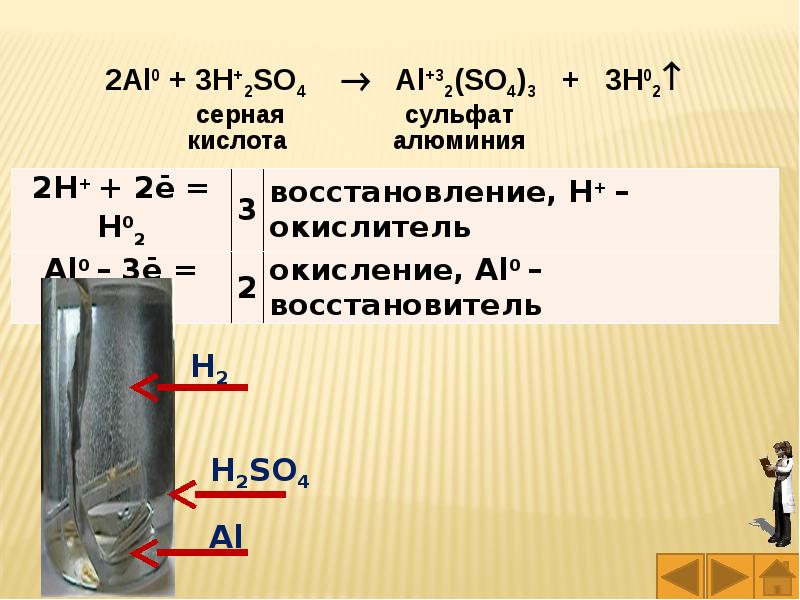
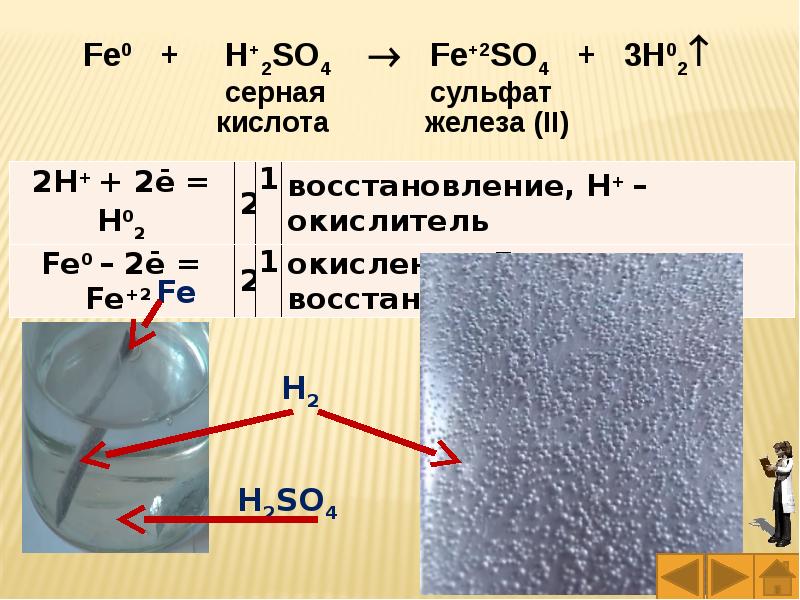





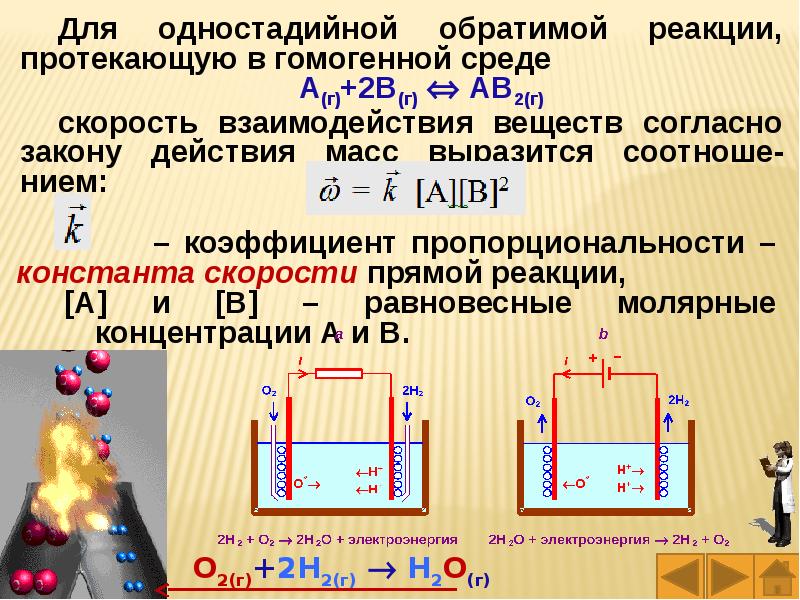




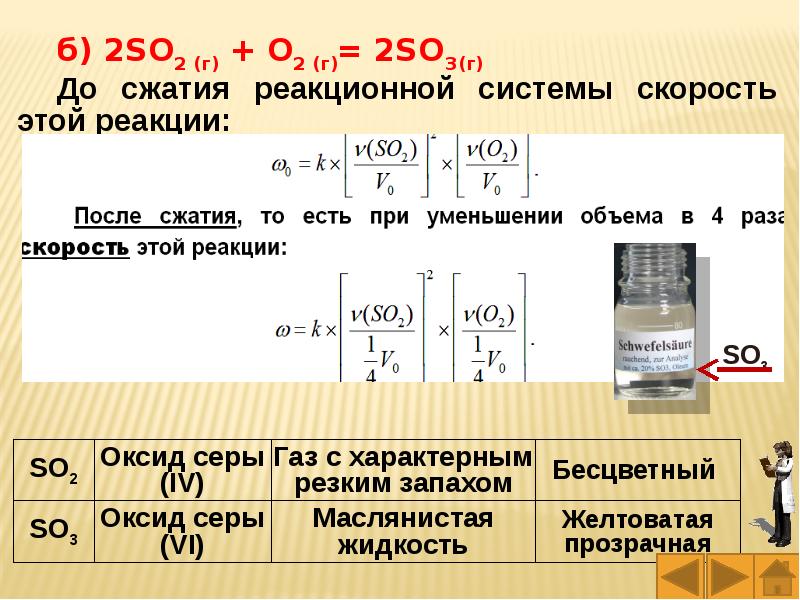


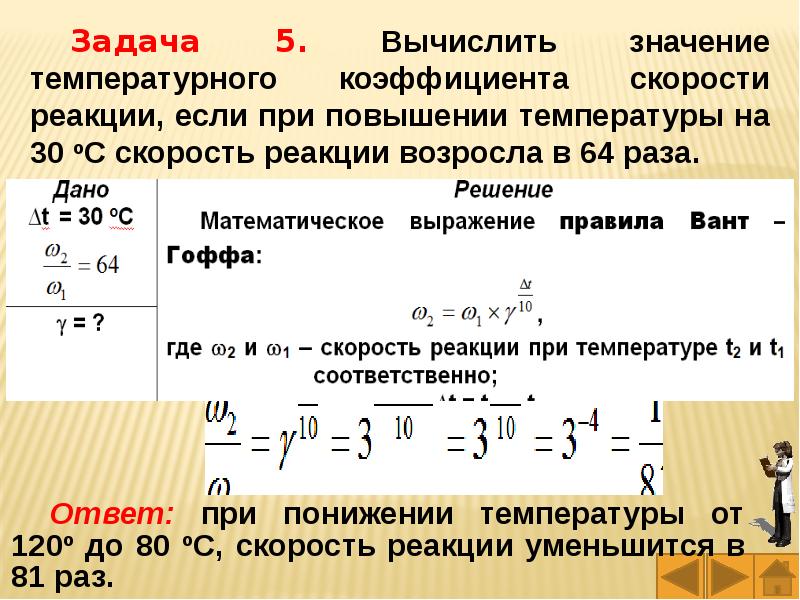

















Слайды и текст этой презентации
Скачать презентацию на тему Скорость химических реакций. Химическое равновесие можно ниже:
Похожие презентации





























