Соли аммония презентация
Содержание
- 2. СОСТАВ солей аммония Соли аммония - это сложные вещества, в состав которых
- 4. Физические свойства солей аммония Кристаллические вещества, хорошо растворимые в
- 5. Химические свойства солей аммония ОБЩИЕ С ДРУГИМИ СОЛЯМИ 1) Диссоциируют
- 6. Химические свойства солей аммония ОБЩИЕ С ДРУГИМИ СОЛЯМИ 3)
- 7. Химические свойства солей аммония СПЕЦИФИЧЕСКИЕ 1. При нагревании со щелочами
- 8. Химические свойства солей аммония СПЕЦИФИЧЕСКИЕ 2. Разлагаются при нагревании: a) если
- 9. Химические свойства солей аммония СПЕЦИФИЧЕСКИЕ 2. Разлагаются при нагревании: б)
- 10. Получение солей аммония Получают взаимодействием NH3 или NH4OH с кислотами: NH3
- 11. Применение солей аммония
- 12. Роль азотных соединений в жизни человека и общества велика, а применение
- 13. Применение солей аммония
- 14. Применение солей аммония
- 15. Применение солей аммония
- 16. Применение солей аммония
- 21. Скачать презентацию

















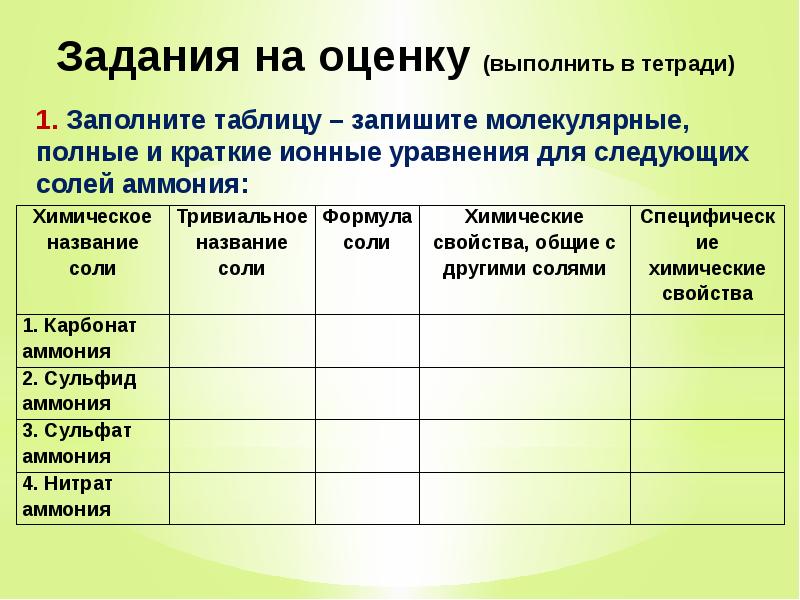


Слайды и текст этой презентации
Похожие презентации





























