Спектроскопические методы анализа. Методы атомной и молекулярной спектроскопии презентация
Содержание
- 2. ТЕМА ЛЕКЦИИ. ОБЩАЯ ХАРАКТЕРИСТИКА инструментальных методов анализа спектроскопические МЕТОДЫ анализа
- 3. План лекции: План лекции: 1.ВВЕДЕНИЕ.Особенности и области применения физико-химических методов анализа
- 4. Физико-химические методы анализа Применение подходов физической химии для целей качественного и
- 5. Физико-химические методы анализа Определение: Методы, использующие для получения химической информации физические
- 6. Инструментальные методы анализа Спектроскопические Хроматографические Электрохимические Радиометрические Термические Масс-спектрометрические
- 7. 1. Особенности и области применения физико-химических методов анализа
- 8. Особенности и области применения физико-химических методов анализа 1.Очень низкий предел обнаружения.
- 9. А) Спектральные и другие оптические методы; Атомно-абсорбционная спектроскопия; Атомно-эмиссионная спектроскопия;
- 10. 2.КЛАССИФИКАЦИЯ СПЕКТРОСКОПИ-ЧЕСКИХ МЕТОДОВ
- 11. СПЕКТРОСКОПИЯ Спектроскопия – (от лат. spectrum – образ, представление, skopeo –
- 12. СПЕКТРОМЕТРИЯ Спектрофотометрия – теория и практика измерения соответствующей интенсивности линии при
- 13. ПО ТИПУ ВзаимодействиЯ излучения с веществом 1. С поглощением излучения (ААС,ИК,КР,
- 14. КЛАССИФИКАЦИЯ ПО ТИПУ ЧАСТИЦ АТОМНАЯ
- 15. Спектроскопия с поглощением излучения Методы атомной спектроско-пии - ААС, (ЯМР, ЭПР)
- 16. Природа электро-магнитного излучения любой физический объект может быть описан как с
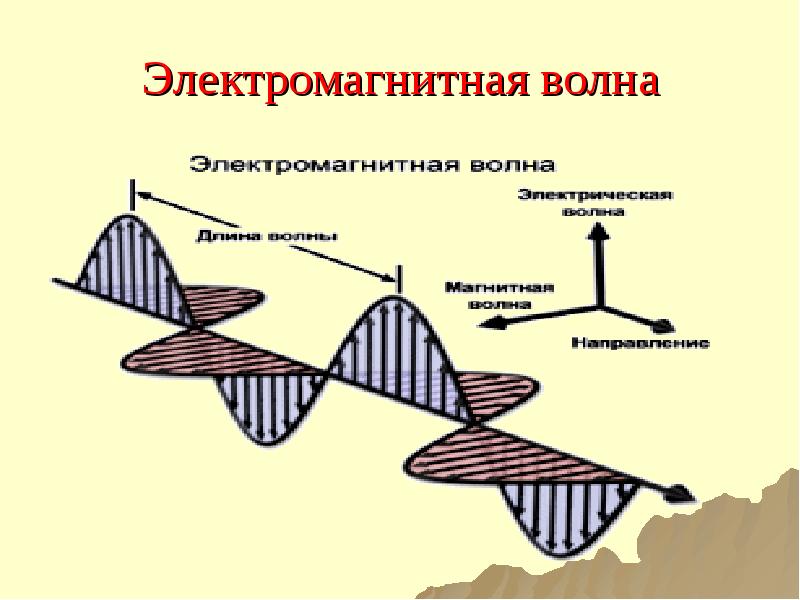
- 17. Электромагнитная волна
- 18. Основные параметры ЭМВ Длина волны (λ) ̶ расстояние, которое проходит волна
- 19. Основные параметры ЭМВ
- 20. Основные параметры ЭМВ
- 21. Взаимосвязь между волновой и корпускулярной природой ЭМИ
- 22. Длина волны для волнового числа 3330 см-1
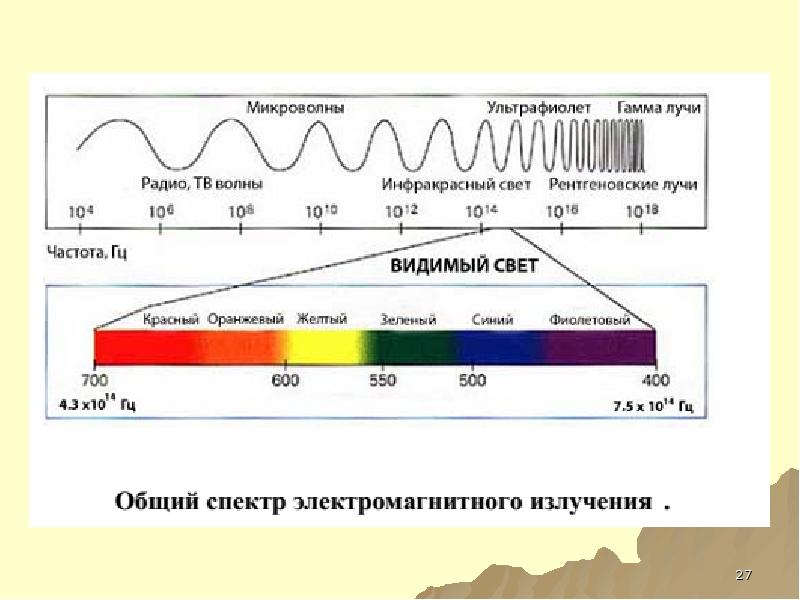
- 24. Спектр Электромагнитный спектр ̶ совокупность всех энергий ЭМИ. Спектр (спектроскопические методы
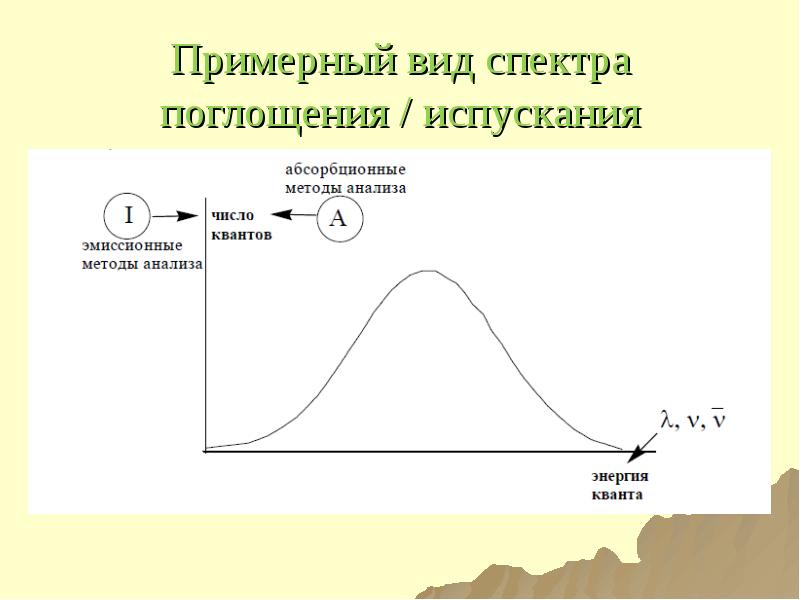
- 25. Примерный вид спектра поглощения / испускания
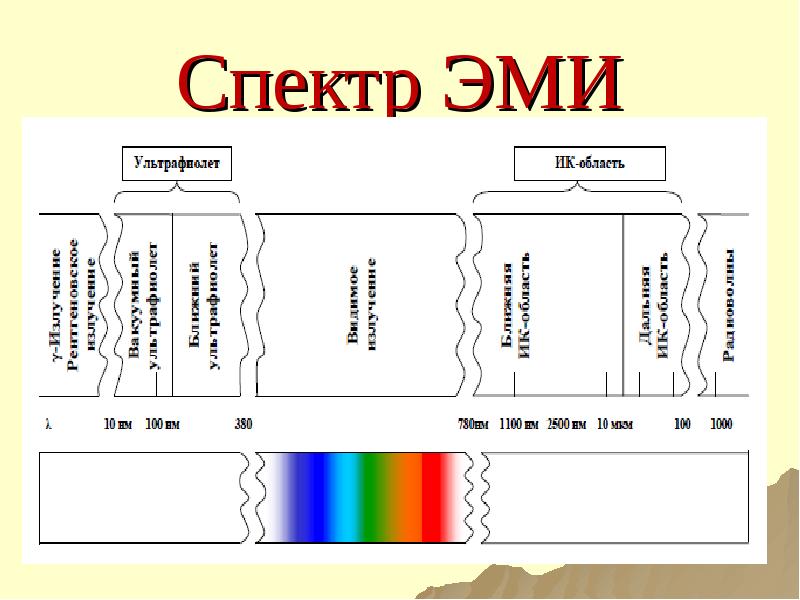
- 26. Спектр ЭМИ
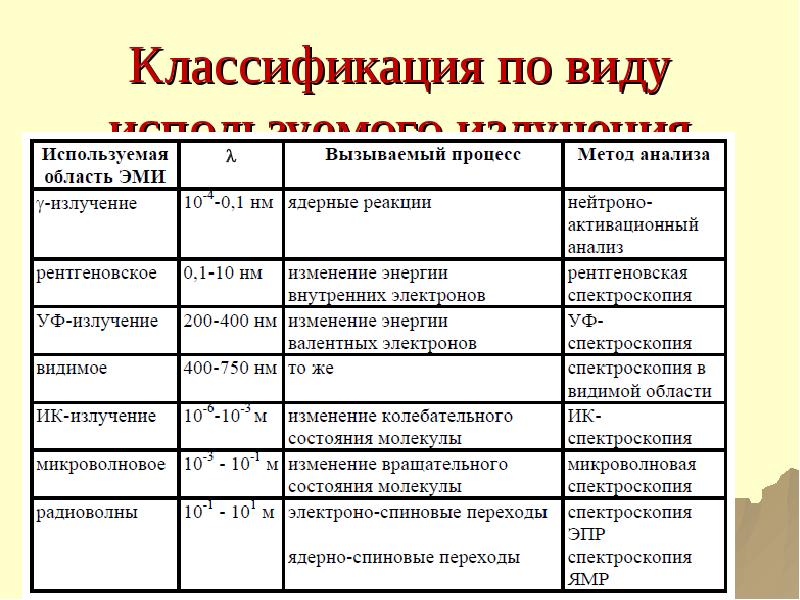
- 28. Классификация по виду используемого излучения
- 29. Классификация по виду частиц, взаимодействующих с ЭМИ. Атомные спектроскопические МА
- 30. Виды спектров Линейчатые Полосатые Непрерывные
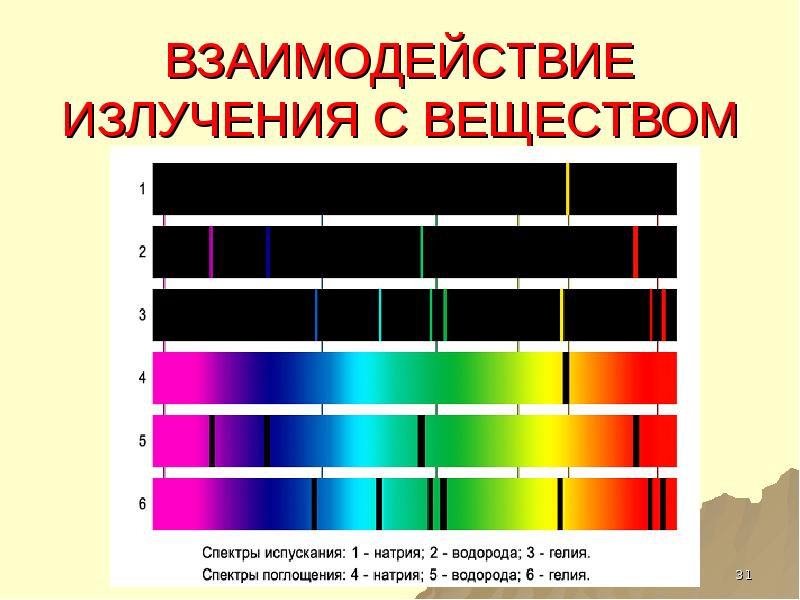
- 31. ВЗАИМОДЕЙСТВИЕ ИЗЛУЧЕНИЯ С ВЕЩЕСТВОМ
- 32. Методы атомной спектроскопии Поглощение (абсорбция) излучения - ААС
- 33. ЯМР - КРАТКО ЯДЕРНЫЙ МАГНИТНЫЙ РЕЗОНАНС, СПИН НЕЙТРОНА И ПРОТОНА КАК
- 34. Томограф
- 35. Методы атомной спектроскопии
- 36. Методы атомной спектроскопии Поглощение (абсорбция) излучения - ААС
- 37. ТЕМА ЛЕКЦИИ. АТОМНО-АБСОРБЦИОННАЯ СПЕКТРОМЕТРИЯ ПРИМЕНЕНИЕ В ФАРМАЦЕВТИЧЕСКОМ АНАЛИЗЕ
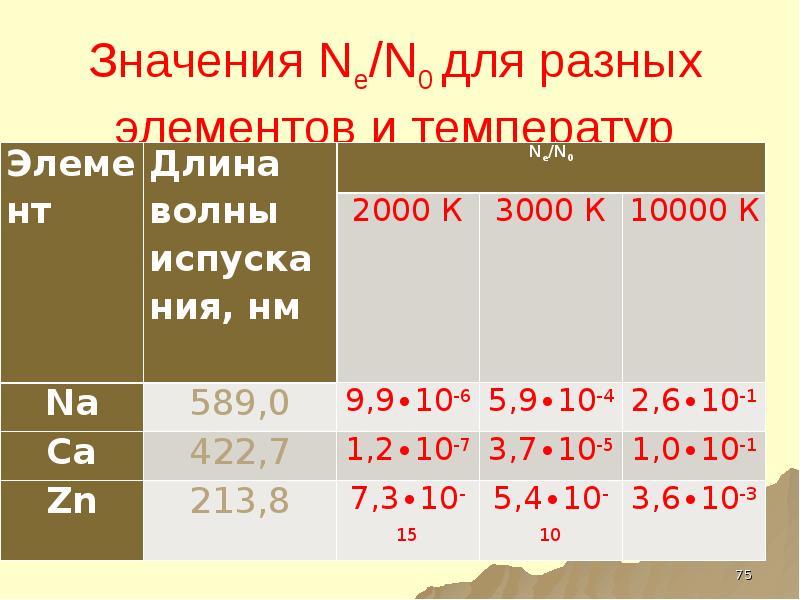
- 40. Соотношение числа атомов в основном и возбужденном состояниях – РАСПРЕДЕЛЕНИЕ БОЛЬЦМАНА
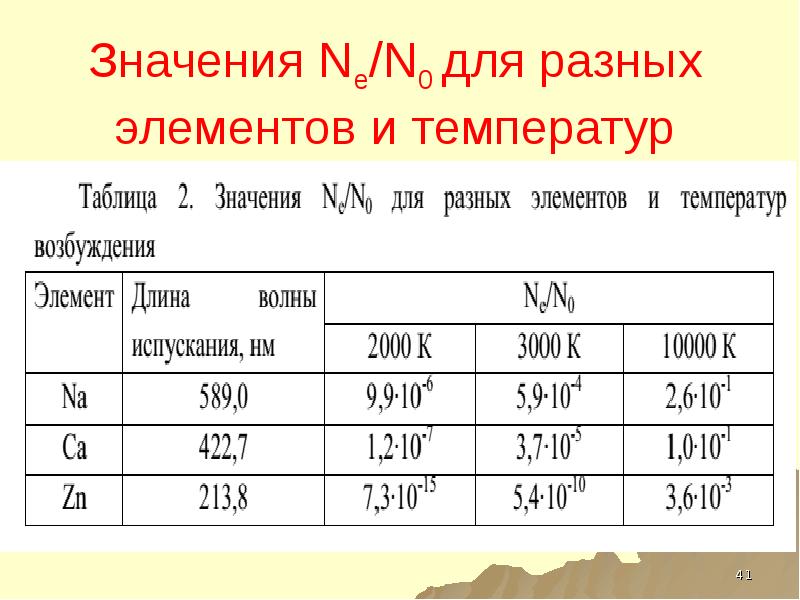
- 41. Значения Ne/N0 для разных элементов и температур возбуждения
- 42. ВЫВОД ЛИШЬ ОЧЕНЬ НЕБОЛЬШАЯ ЧАСТЬ АТОМОВ НАХОДИТСЯ В ВОЗБУЖДЕННОМ СОСТОЯНИИ
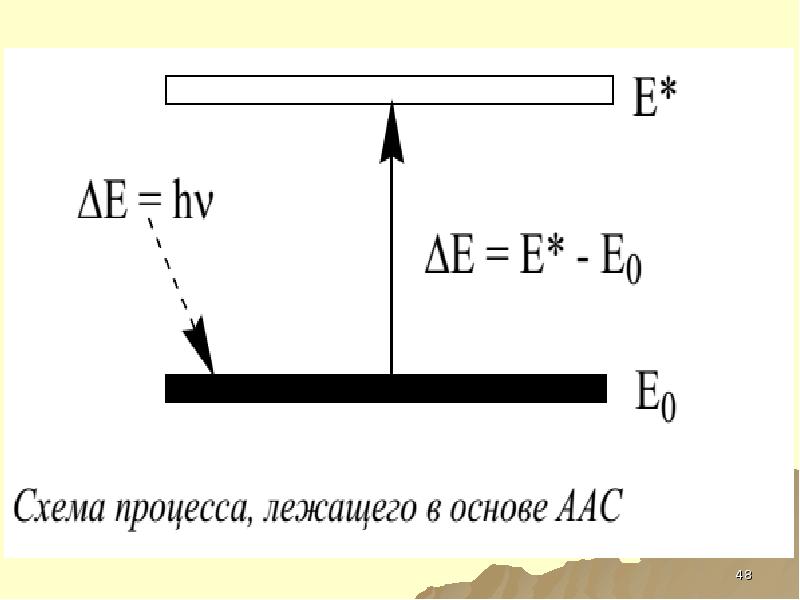
- 43. РЕЗОНАНСНАЯ ЛИНИЯ НАИБОЛЕЕ ИНТЕНСИВНАЯ ЛИНИЯ В СПЕКТРЕ ИСПУСКАЯНИЯ НАЗЫВАЕТСЯ РЕЗОНАНСНОЙ, КАК
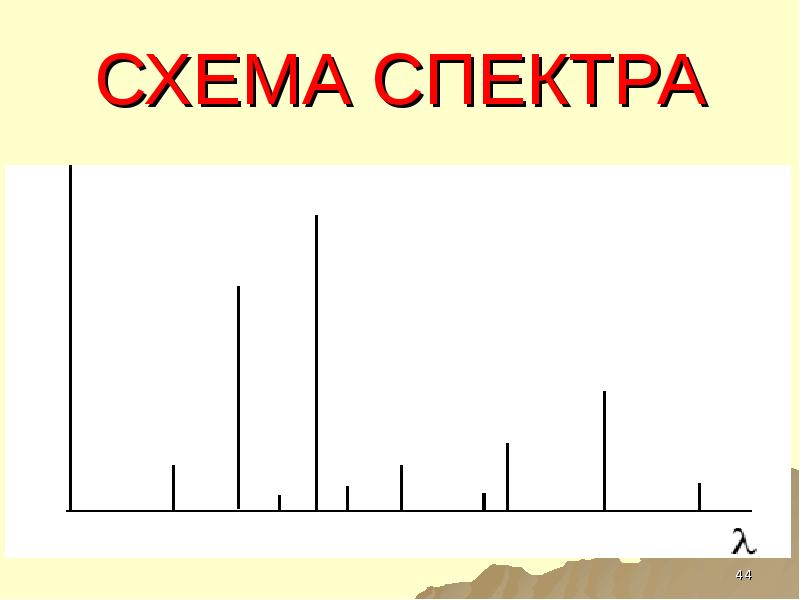
- 44. СХЕМА СПЕКТРА
- 45. ААС И АЭС ОБЩЕЕ – ЭЛЕКТРОННЫЕ ПЕРЕХОДЫ В АТОМЕ МЕЖДУ РАЗНЫМИ
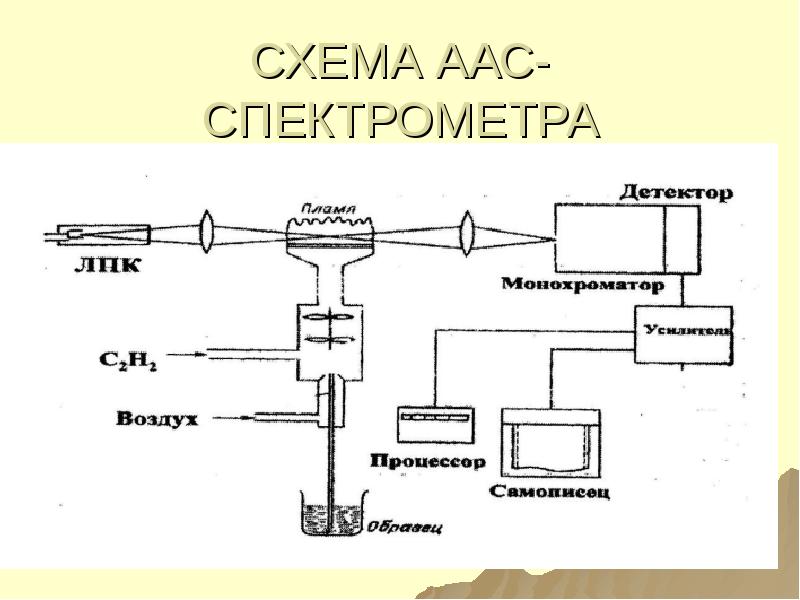
- 47. СХЕМА ААС- СПЕКТРОМЕТРА
- 49. Атомизаторы
- 50. ПЛАМЕННЫЙ АТОМИЗАТОР ИСПОЛЬЗУЕТСЯ ПЛАМЯ, ДОСТАТОЧНОЕ ДЛЯ ПОЛУЧЕНИЯ АТОМНОГО ПАРА ВЕЩЕСТВА, НО
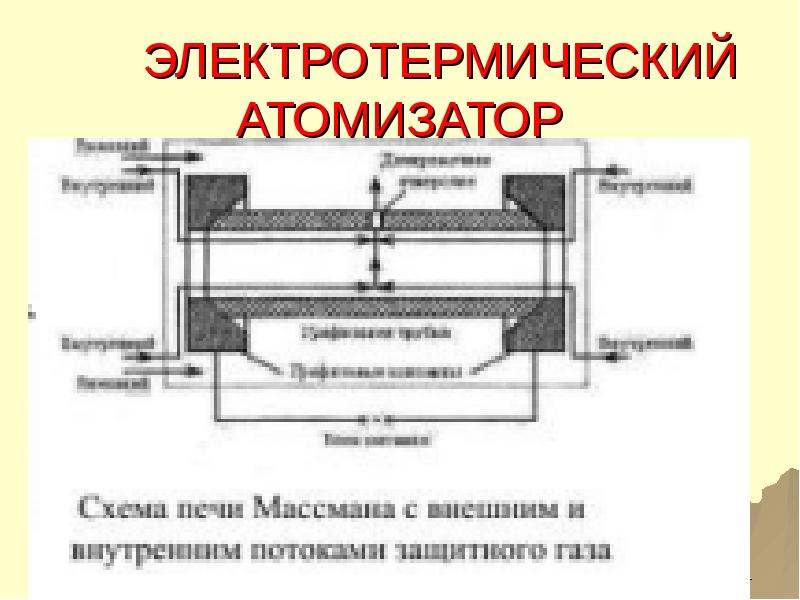
- 51. ЭЛЕКТРОТЕРМИЧЕСКИЙ АТОМИЗАТОР
- 52. ПРОЦЕССЫ В ЭЛЕКТРОТЕРМИЧЕСКОМ АТОМИЗАТОРЕ КАПЛЯ РАСТВОРА ИЛИ ТВЕРДЫЙ ОБРАЗЕЦ ПОДАЮТСЯ В
- 53. ИСТОЧНИКИ ИЗЛУЧЕНИЯ
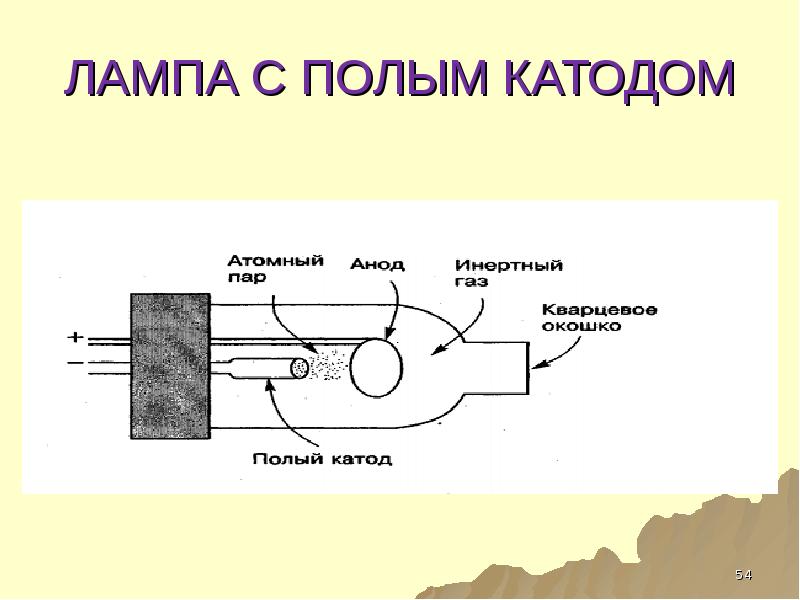
- 54. ЛАМПА С ПОЛЫМ КАТОДОМ
- 55. ВНЕШНИЙ ВИД ЛАМПЫ
- 58. ВВОД ПРОБЫ
- 59. УСТРОЙСТВО ВВОДА ПРОБЫ ДЛЯ ПЛАМЕННОЙ ГОРЕЛКИ
- 60. ГОРЕЛКА БОЙЛИНГА
- 61. ЭФФЕКТ ВЕНТУРИ
- 63. МЕТОД «ХОЛОДНОГО ПАРА» СОЕДИНЕНИЯ РТУТИ ПРВРАЩАЮТ В МЕТАЛЛИЧЕСКУЮ РТУТЬ, ЗАТЕМ ЕЕ
- 65. ГЕНЕРАЦИЯ ГИДРИДОВ
- 66. ПОМЕХИ В МЕТОДЕ ААС
- 67. ПОМЕХИ В МЕТОДЕ ААС СПЕКТРАЛЬНЫЕ; ФИЗИЧЕСКИЕ; ХИМИЧЕСКИЕ
- 68. КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ АНАЛИЗ В ААС
- 69. КАЧЕСТВЕННЫЙ В ААС ПОСКОЛЬКУ ОПРЕДЕЛЯЕМЫЙ ЭЛЕМЕНТ ЗАДАЕТСЯ ВЫБОРОМ ЛАМПЫ, МЕТОД ААС
- 70. КОЛИЧЕСТВЕННЫЙ АНАЛИЗ В ААС 1) МЕТОД ОДНОГО СТАНДАРТА;; 2) МЕТОД ДВУХ
- 71. ФАРМ. ПРИМЕНЕНИЕ
- 72. МЕТОД ААС ИСПОЛЬЗУЕТСЯ ДЛЯ ОПРЕДЛЕНИЯ СЛЕДОВЫХ КОЛИЧЕСТВ БОЛЕЕ 70 ЭЛЕМЕНТОВ, В
- 74. Атомно-эмиссионная спектрометрия
- 75. Значения Ne/N0 для разных элементов и температур возбуждения
- 76. Атомно-эмиссионная спектрометрия Спектрометрический метод анализа, основанный на измерении электромагнитного излучения оптического
- 77. ААС И АЭС ОБЩЕЕ – ЭЛЕКТРОННЫЕ ПЕРЕХОДЫ В АТОМЕ МЕЖДУ РАЗНЫМИ
- 78. Атомизаторы (источники возбуждения)
- 79. Виды атомизаторов в атомно-эмиссионной спектрометрии 1.Пламя, 2.электрическая дуга, 3.электрическая искра,
- 80. Пламенная фотометрия (фотометрия пламени) Вариант атомно-эмиссионной спектрометрии с пламенной атомизацией.
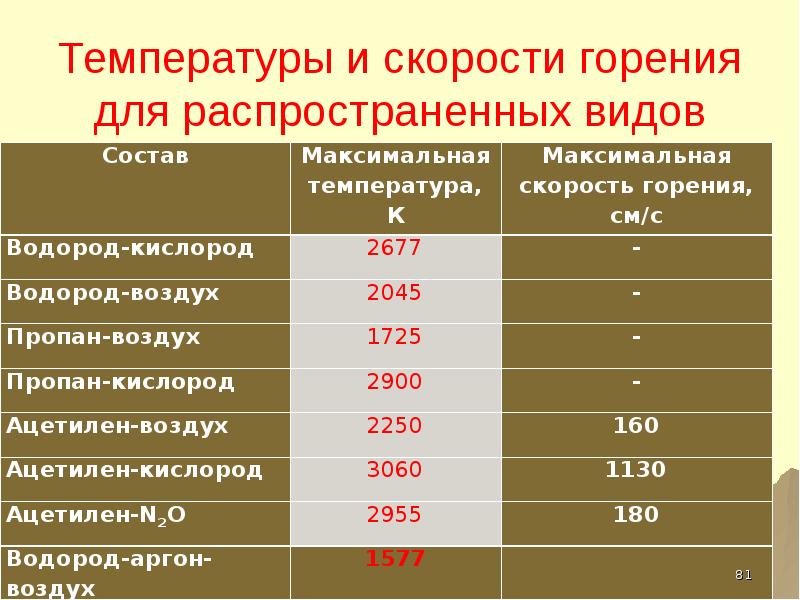
- 81. Температуры и скорости горения для распространенных видов пламени
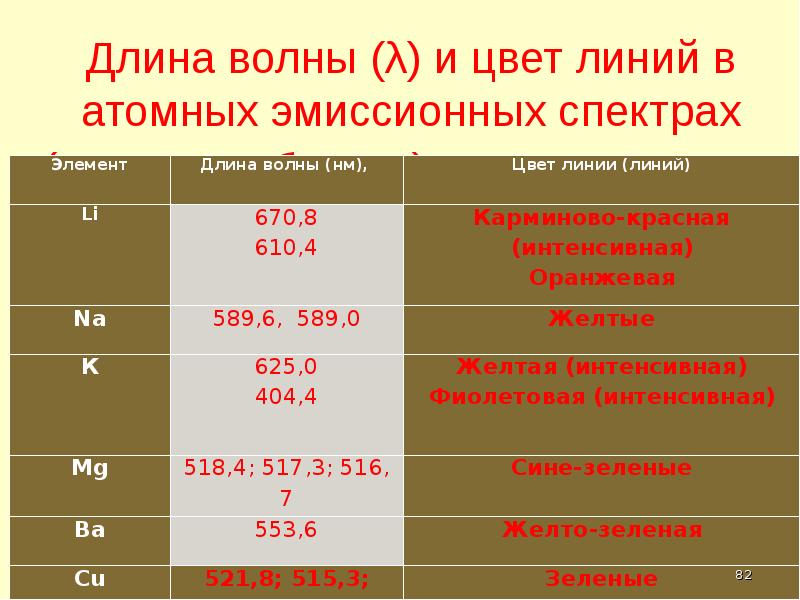
- 82. Длина волны (λ) и цвет линий в атомных эмиссионных спектрах (видимая
- 83. ЭЛЕКТРИЧЕСКАЯ ИСКРА При электрическом разряде развивается температура 7000оС-10000оС, что приводит
- 84. ЭЛЕКТРИЧЕСКАЯ ДУГА
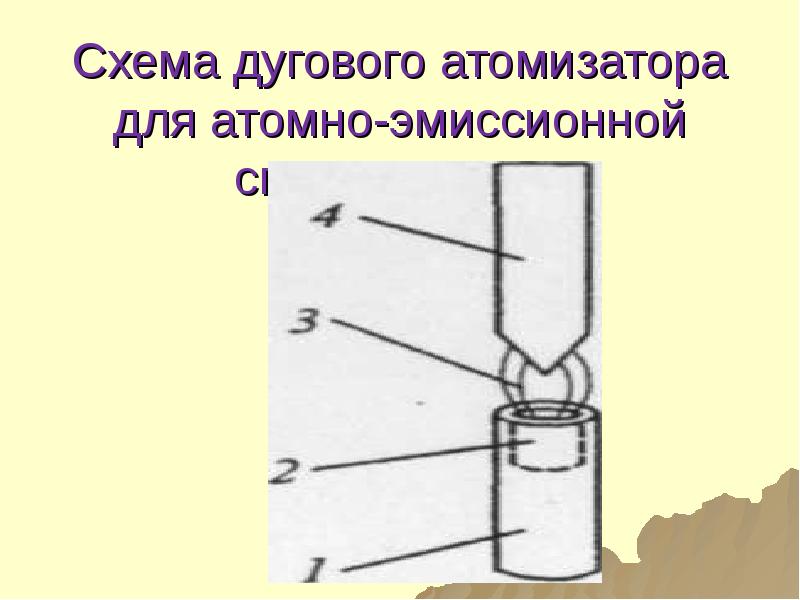
- 85. Схема дугового атомизатора для атомно-эмиссионной спектроскопии
- 86. Составные части 1- нижний электрод 2-углубление для пробы 3-зона электрического разряда
- 87. ОПРЕДЕЛЕНИЕ ПЛАЗМЫ ПЛАЗМА – ОСОБОЕ АГРЕГАТНОЕ СОСТОЯНИЕ ВЕЩЕСТВА, ПРЕДСТАВЛЯЕТ СОБОЙ ЧАСТИЧНО
- 88. ТЕМПЕРАТУРА ПЛАЗМЫ E~kT В зависимости от условий возбуждения ~104 К
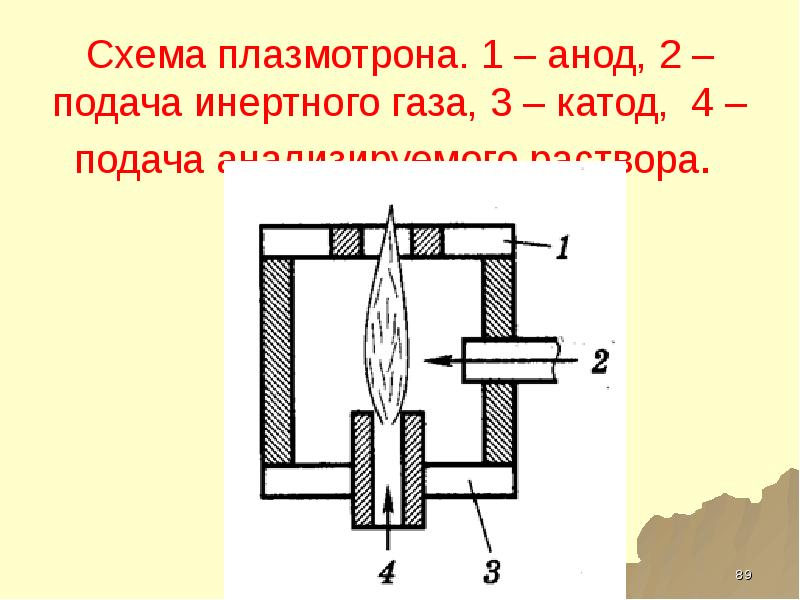
- 89. Схема плазмотрона. 1 – анод, 2 – подача инертного газа, 3
- 90. атомизатор с индуктивно связанной плазмой.
- 91. Составные части 1- зона наблюдения 2- индукционная катушка 3- кварцевая горелка
- 92. Внешний вид пламени в ICP
- 93. ПРЕИМУЩЕСТВА АЭС ИСП -одновременный многоэлементный анализ - гибкость в выборе
- 94. КОЛИЧЕСТВЕННЫЙ АНАЛИЗ В АЭС ОСНОВАН НА УРАВНЕНИИ ЛОМАКИНА - ШАЙБЕ
- 95. УРАВНЕНИЕ ЛОМАКИНА - ШАЙБЕ
- 96. ЛОРАФМИЧЕСКАЯ ФОРМА
- 97. РАСЧЕТНЫЙ МЕТОД ДОБАВОК
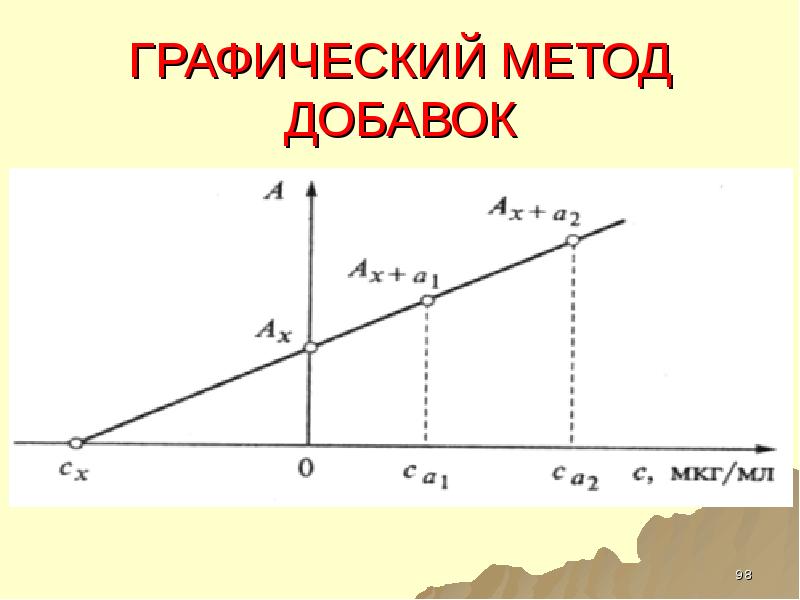
- 98. ГРАФИЧЕСКИЙ МЕТОД ДОБАВОК
- 99. СМЫСЛ ЭМПИРИЧЕСКИХ КОЭФФИЦИЕНТОВ a и b - эмпирические константы, которые характеризуют
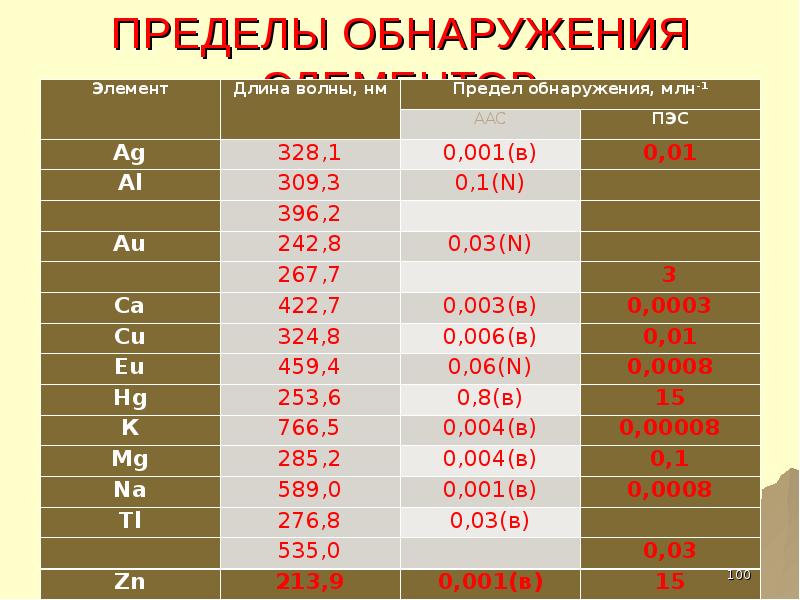
- 100. ПРЕДЕЛЫ ОБНАРУЖЕНИЯ ЭЛЕМЕНТОВ
- 101. Применение методов эмиссионной спектроскопии для фармацевтического анализа (УИРС-3)
- 102. МОЛЕКУЛЯРНАЯ СПЕКТРО - СКОПИЯ
- 103. МОЛЕКУЛЯРНАЯ Абсорбционная спектроскопия (УФ-ВИД (УВИ) и ИК-спектроскопия). Применение в фарм.анализе
- 104. План лекции: План лекции: Электронная (УФ-видимая) спектроскопия 1.1 УФ-сигнал, 1.2.
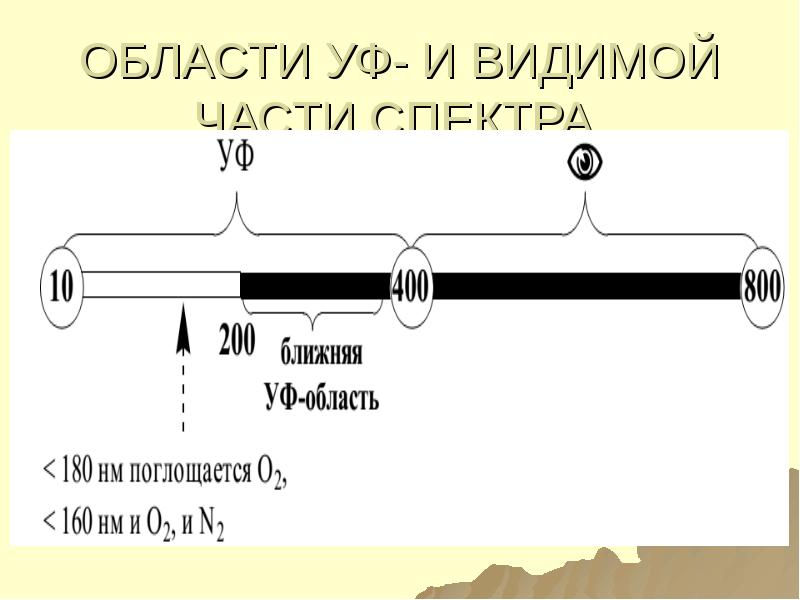
- 105. ИСПОЛЬЗУЕМЫЕ ОБЛАСТИ ЭМИ 1) СПЕКТРОСКОПИЯ (СПЕКТРОФОТОМЕТРИЯ) В УВИ ОБЛАСТИ СПЕКТРА: ближняя
- 106. ОБЛАСТИ УФ- И ВИДИМОЙ ЧАСТИ СПЕКТРА
- 107. УФ-спектроскопия (синонимы) Поскольку происходят электронные переходы в УФ- и видимой областях,
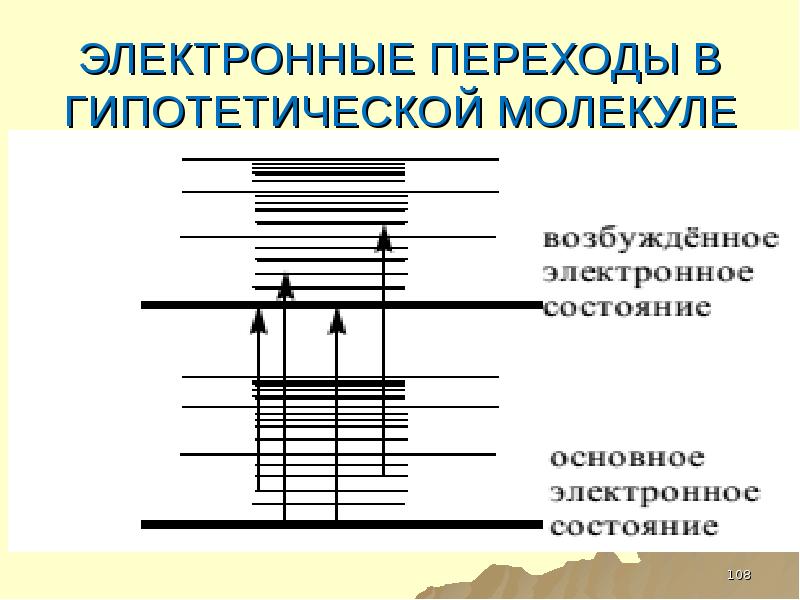
- 108. ЭЛЕКТРОННЫЕ ПЕРЕХОДЫ В ГИПОТЕТИЧЕСКОЙ МОЛЕКУЛЕ
- 109. ТАКИМ ОБРАЗОМ КАЖДОМУ ЭЛЕКТРОННОМУ УРОВНЮ СООТВЕСТВУЕТ НЕСКОЛЬКО КОЛЕБАТЕЛЬНЫХ УРОВНЕЙ ЭНЕРГИИ, ТЕ,
- 110. ЭНЕРГИИ ПЕРЕХОДОВ
- 111. ДВА ВИДА СПЕКТРОСКОПИИ УВИ- СПЕКТРО-СКОПИЯ (ЭЛЕКТРОННЫЕ ПЕРЕХОДЫ)
- 112. ДВА ВАРИАНТА ИЗМЕРЕНИЯ ПОГЛОЩЕНИЯ ЭМИ 1) ВО ВСЕМ ДИАПАЗОНЕ УВИ; I=f(λ)
- 113. ОСНОВНЫЕ И ДОПОЛНИТЕЛЬНЫЕ ЦВЕТА ЦВЕТ ПРОЗРАЧНОЙ ПОГЛОЩАЮЩЕЙ СРЕДЫ ОБУСЛОВЛЕН ПОГЛОЩЕНИЕМ ЭМИ
- 114. Цвета и интервалы длин волн в спектре поглощения белого света (Г.
- 115. ОСНОВНОЙ ЗАКОН СВЕТО-ПОГЛОЩЕНИЯ – БУГЕРА-ЛАМБЕРТА-БЕРА
- 116. В ЛОГАРИФМИЧЕСКОЙ ФОРМЕ В ЭКСПОНЕНЦИАЛЬНОЙ ФОРМЕ
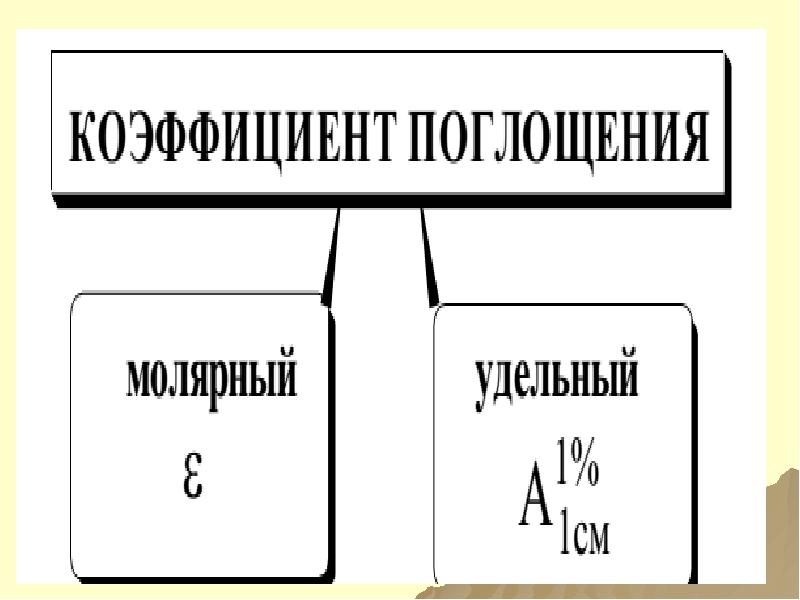
- 118. МОЛЯРНЫЙ КОЭФФИЦИЕНТ ПОГЛОЩЕНИЯ ε
- 119. КОЭФФИЦИЕНТЫ ПОГЛОЩЕНИЯ МОЛЯРНЫЙ
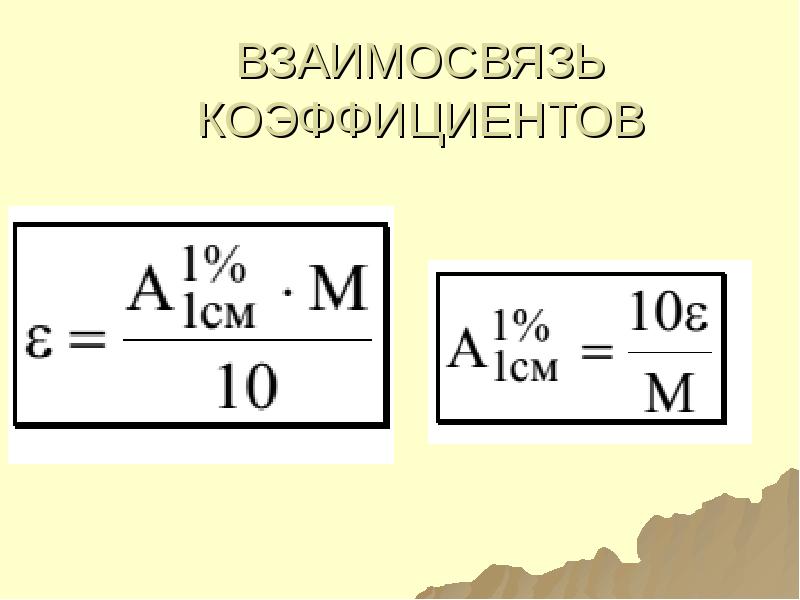
- 120. ВЗАИМОСВЯЗЬ КОЭФФИЦИЕНТОВ ПОГЛОЩЕНИЯ
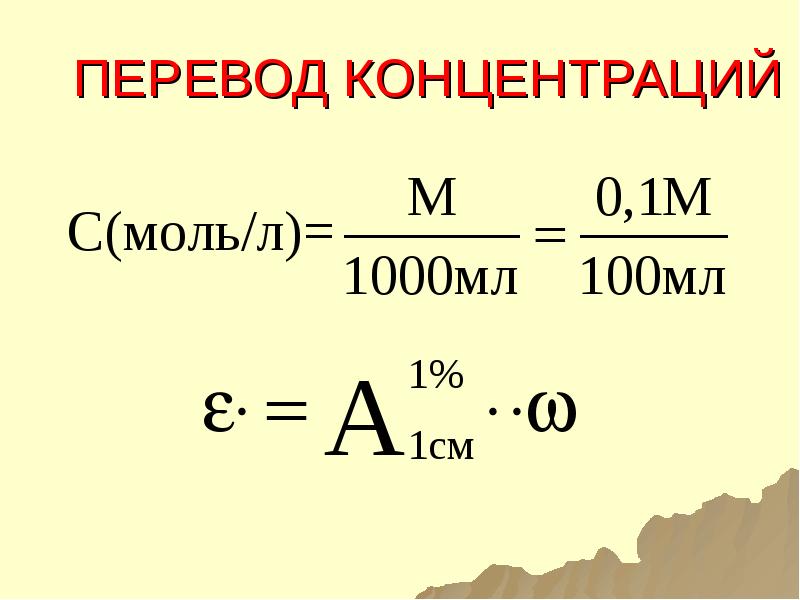
- 121. ПЕРЕВОД КОНЦЕНТРАЦИЙ
- 122. ПЕРЕВОД КОНЦЕНТРАЦИЙ
- 123. ВЗАИМОСВЯЗЬ КОЭФФИЦИЕНТОВ
- 124. ЗАКОН БУГЕРА-ЛАМБЕРТА-БЕРА УВИ (МАС) ЯВЛЯЕТСЯ БЕЗЭТАЛОННЫМ МЕТОДОМ, Т.Е. МОЖНО РАССЧИТЫВАТЬ КОНЦЕНТРАЦИИ
- 125. ПРИРОДА ПОГЛОЩЕНИЯ ЭМИ ВЕЩЕСТВОМ
- 126. Интенсивность переходов ε Критерий – молярный коэффициент поглощения ε (ε π---π-*
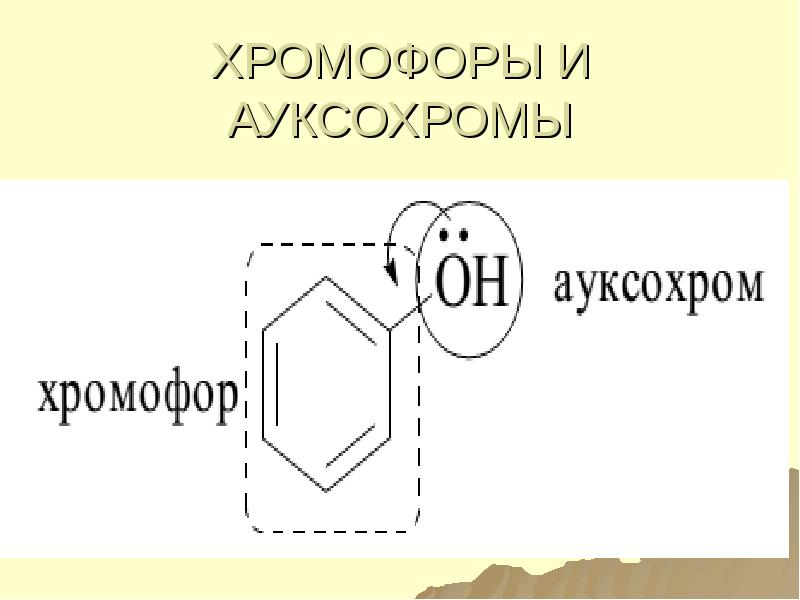
- 127. Поглощение УФ-вид излучения Поглощающие группы – хромофоры. Поглощающие молекулы- хромогены.
- 128. Ауксохромы – А - гидроксильные группы, аминогруппы, атомы галогенов (n
- 129. ХРОМОФОРЫ И АУКСОХРОМЫ
- 130. ЭФФКТЫ АУКСОХРОМОВ ГИПЕРХРОМНЫЙ – ГИПОХРОМНЫЙ ЭФФЕКТ ГИПСОХРОМНЫЙ, БАТОХРОМНЫЙ СДВИГ
- 131. Сдвиг максимума поглощения Батохромный сдвиг – в сторону более длинных волн
- 132. Спектр электромагнитного излучения
- 133. Эффекты ауксохромов Гиперхромный эффект– ε увеличивается Гипохромный эффект - ε уменьшается
- 134. Поглощение изолированных хромофоров Если хромофоры разделены двумя (и более) одинарными
- 135. Поглощение сопряженными хромофорами (=-=-=-) Батохромный сдвиг Гиперхромный эффект
- 136. Поглощение хромофорами
- 138. Поглощение бензола С6Н6 –(λ=200нм, ε=69000) интенсивная + +(λ=230-270нм, ε=170) слабая полоса
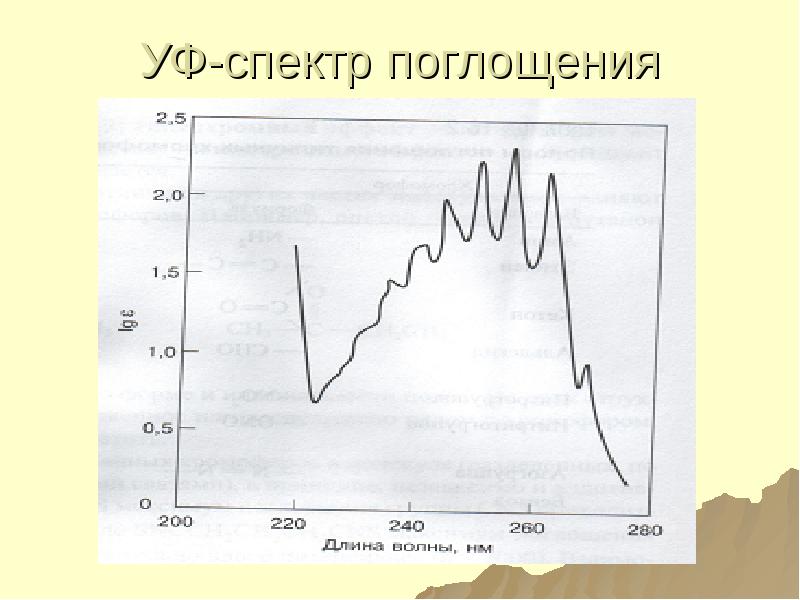
- 139. УФ-спектр поглощения бензола
- 140. Поглощение ароматическими системами (производными бензола, сопряженными системами) (-ОН) , (-ОСН3), (-NH2),
- 141. Поглощение индикаторов Сопряженная система – следовательно сдвиг в «красную сторону», т.е.
- 142. Поглощение излучения неорганическими хелатами
- 143. Комплексы с переносом заряда Перенос электрона с лиганда на металл или
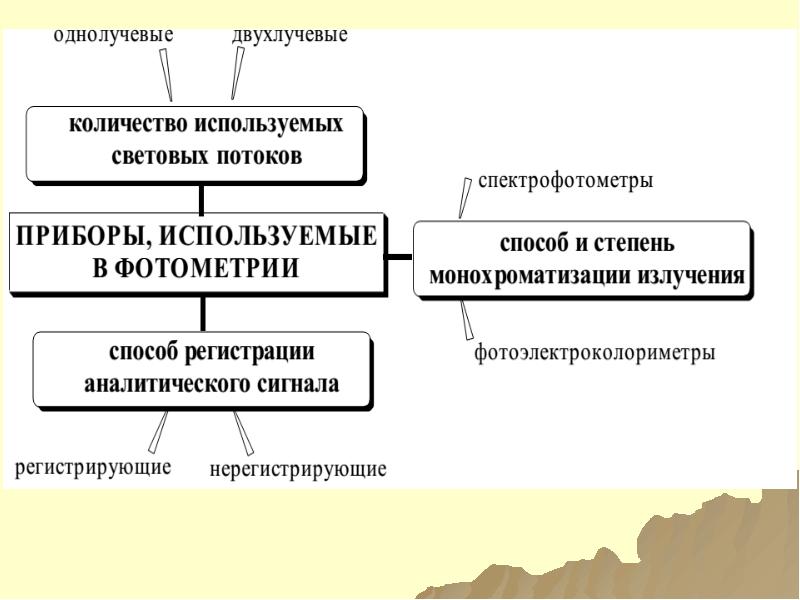
- 144. ФОТОМЕТРИЯ ПРЯМАЯ
- 145. ТРЕБОВАНИЯ В ФОТОМЕТР.РЕАКЦИЯМ
- 146. ФОТОМЕТРИЧЕСКИЕ РЕАКЦИИ ФОТО-МЕТРИЧЕС-КИЕ РЕАКЦИИ
- 147. КОЛИЧЕСТВЕННЫЙ АНАЛИЗ ОСНОВАН ЗА ЗАКОНЕ БУГЕРА-ЛАМБЕТРА-БЕРА МЕТОДО ОДНОГО СТАНДАРТА; МЕТОД ДОБАВОК;
- 150. МЕТОД ФИРОРДТА
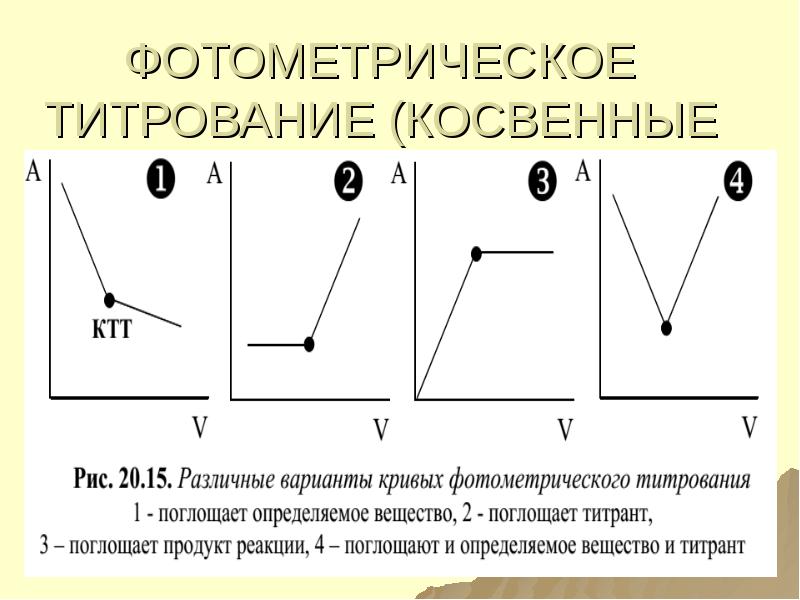
- 151. ФОТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ (КОСВЕННЫЕ МЕТОДЫ)
- 152. ОТНОСИТЕЛЬНАЯ ОПТИЧЕСКАЯ ПЛОТНОСТЬ
- 153. МЕТОДЫ РАСЧЕТА КОНЦЕНТРАЦИЙ 1) ГРАФИЧЕСКИЙ; 2) РАСЧЕТНЫЙ
- 154. Фармацевтический анализ (УФ-спектроскопия)
- 155. Применяется в клиническом анализе Барбитураты в щелочном растворе (λ=252нм) NADH (λ=340нм)
- 156. Ограничения закона Бугера-Ламберта-Бера. 1. Справедлив для монохроматического света 2. Коэффициент
- 157. ЛЮМИНЕСЦЕНЦИЯ ЭМИССИОННАЯ МОЛЕКУЛЯРНАЯ СПЕКТРОСКОПИЯ
- 158. Определение люминесценции Люминесценция – это излучение, превышающее тепловое при данной температуре
- 159. Люминесценция Испускание ЭЛЕКТРОМАГНИТНОГО излучения оптического диапазона, возникающие в результате электронного перехода
- 160. Люминесцентная спектрометрия Группа эмиссионных спектроскометрических методов анализа, основанных на явлении
- 161. Люминофоры Кристаллофосфорами называют сложные неорганические кристаллы, способные люминесцировать.
- 162. ИЗЛУЧАТЕЛЬНЫЕ ПЕРЕХОДЫ Переходы при излучении атомов
- 163. По длительности послесвечения люминеценция делится Флуоресценция, т.е. затухание люминесценции происходит очень
- 164. Причина различий – механизм возбуждения атомов Квантовые числа электронов в атоме:
- 165. Флуоресценция Излучательный переход между состояниями, имеющими одинаковую мультиплетность.
- 166. Время жизни триплетного состояния Время жизни триплетного состояния – 10-3-102сек. Следова-тельно
- 167. Фосфоресценция Излучательный переход между состояниями, имеющими разную мультиплетность.
- 168. БЕЗ-ИЗЛУЧАТЕЛЬНЫЕ ПЕРЕХОДЫ Переходы при излучении атомов
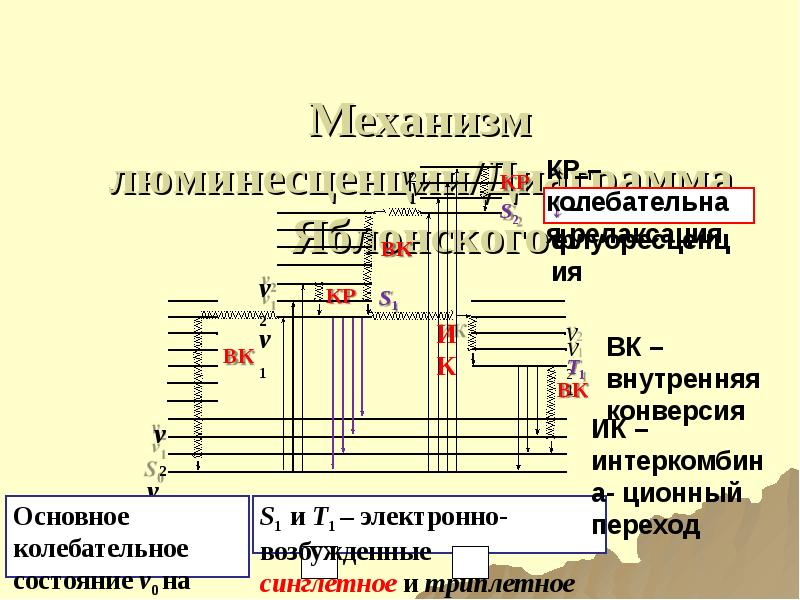
- 169. Механизм люминесценции/Диаграмма Яблонского
- 170. Основные виды люминесценции по способу возбуждения атомов
- 171. Фотолюминесценция – возбуждение происходит в результате поглощения молекулами или атомами вещества
- 172. Катодолюминесценция – возбуждение производится электронным ударом по атомам или молекулам вещества
- 173. Электролюминесценция – возбуждение атомов и молекул производится электрическим полем.
- 174. Рентгенолюминесценция возбуждение производится рентгеновскими лучами
- 175. Хемилюминесценция в результате химической реакции между молекулами А и В
- 176. Биолюминесценция – возбуждение молекул происходит в результате биохимических реакций, протекающих в
- 177. Тушение флуоресценции – ТЕМПЕРАТУРНОЕ И КОНЦЕНТРАЦИОННОЕ
- 178. Основные законы люминесценции
- 179. Правило М.Каши Спектр люминесценции не зависит от длины волны возбуждающего света
- 180. Правило Стокса-Ломмеля Как правило, спектр люминесценции в целом и его максимум
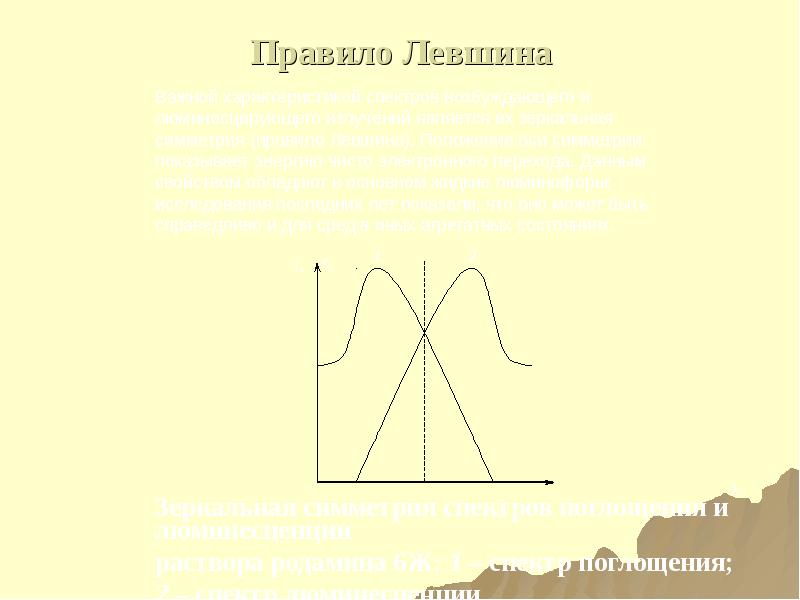
- 181. Правило В.Л.Левшина Для многих веществ нормированные спектры поглощения (только самая длинноволновая
- 182. Правило Левшина
- 183. Уравнение Ломакина-Шайбе Зависимость между интенсивностью атомно-эмиссионных спектральных линий и концентрацией элемента
- 184. Эффект Шпольского Превращение спектра флуоресценции органического вещества в линейчатый при помещении
- 185. Энергетические характеристики эмиссии
- 186. Квантовый выход Отношение числа испускаемых фотонов к числу поглощаемых.
- 187. Энергетический выход Отношение энергии излучаемого света к энергии поглощаемого
- 188. Применение методов эмиссионной спектроскопии для фармацевтического анализа (УИРС-3)
- 189. Люминесцентное титрование Люминесцентное титрование как отдельный вид титрования не существует, он
- 190. Достоинства метода Высокая специфичность по отношению к данной реакции. Высокая селективность
- 191. Люминесцентное титрование Хемилюминесцентные индикаторы излучают собственный свет в процессе окислительно-восстановительных реакций, при
- 192. ПРИМЕР Хорошие результаты получены при титровании в присутствии хемилюминесцентных индикаторов. В щелочной
- 193. ПРИМЕР В аналитической практике хемилюминесцентные реакции используют: 1) для установления точки
- 194. Иодометрическое титрование сульфитов изучено наиболее полно и широко применяется. Кольтгоф рекомендует
- 195. Хемилюминесцентные индикаторы могут быть использованы для определения содержания кислот в темноокрашенных
- 196. Недостатки метода Не многие в-ва способны люминесцировать Тонкий подбор индикатора к
- 197. Скачать презентацию




























































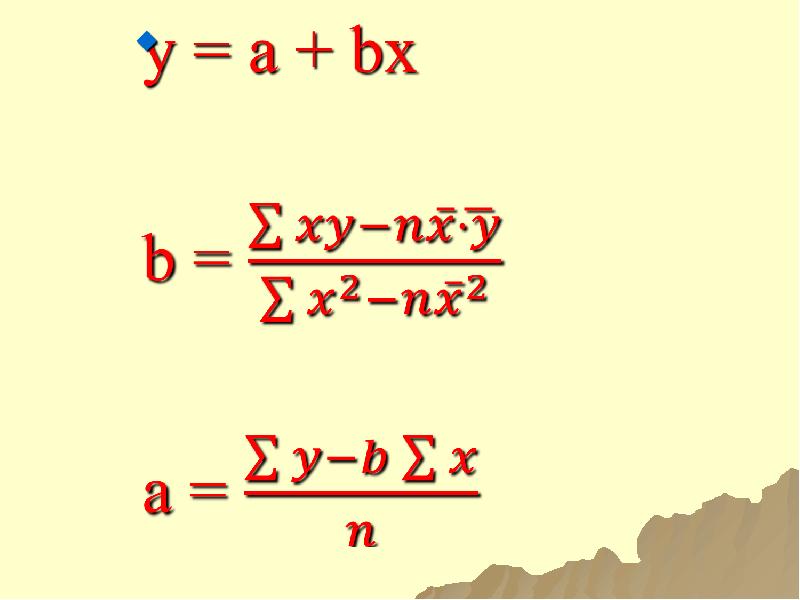









































































































Слайды и текст этой презентации
Скачать презентацию на тему Спектроскопические методы анализа. Методы атомной и молекулярной спектроскопии можно ниже:
Похожие презентации





























