Строение атома. Периодический закон презентация
Содержание
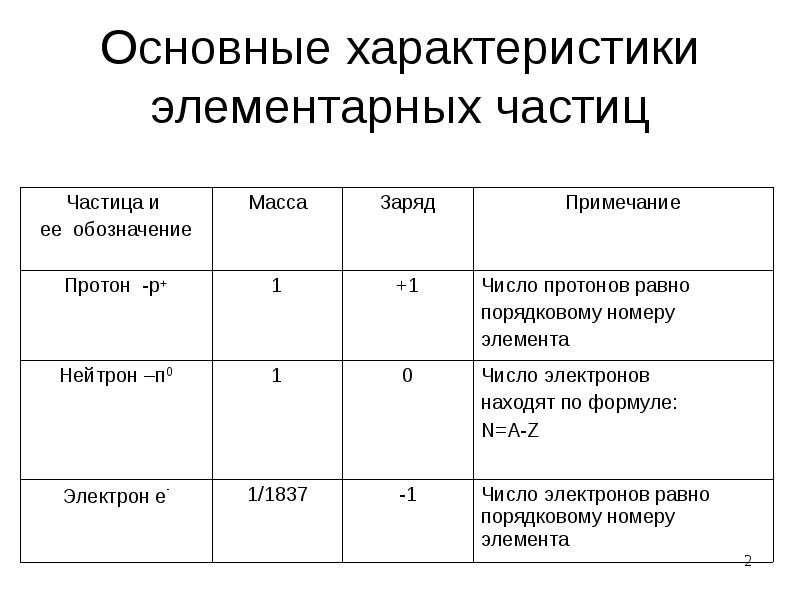
- 2. Основные характеристики элементарных частиц
- 3. Главное квантовое число(n) n - 1, 2, 3,…, определяет энергию электрона
- 4. Орбитальное квантовое число (l) харак-ет форму электронного облака l = 0,
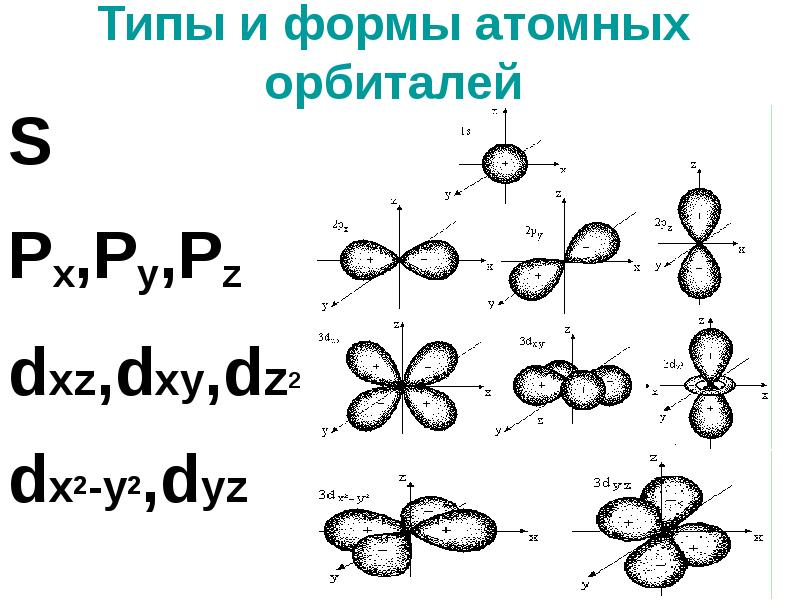
- 5. Типы и формы атомных орбиталей S Px,Py,Pz dxz,dxy,dz2 dx2-y2,dyz
- 6. Магнитное квантовое число (ml) характеризует Магнитное квантовое число (ml) характеризует ориентацию
- 7. Спиновое квантовое число (ms) характеризует собственный магнитный момент электрона, который или
- 8. Атомная орбиталь (АО) это состояние электрона в атоме, которое описывается волновой
- 9. Закономерности формирования электронных структур Принцип наименьшей энергии: электрон размещается на АО
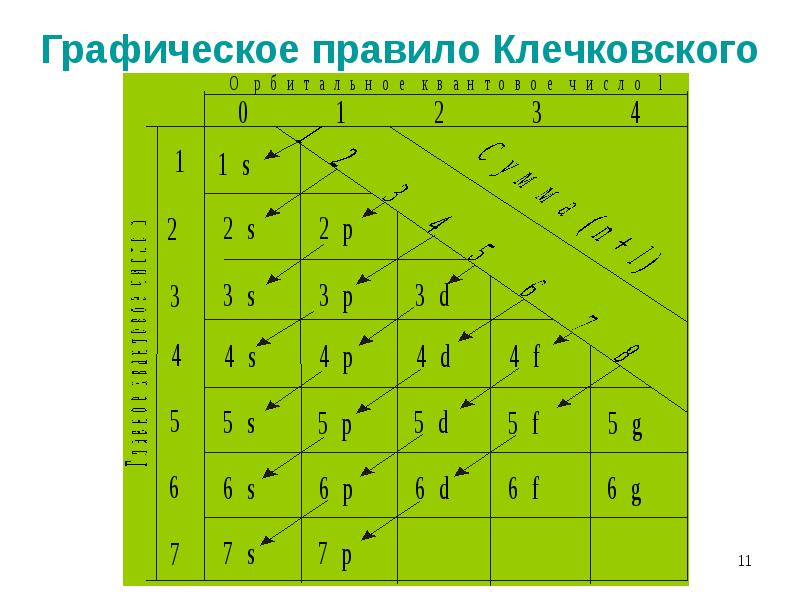
- 10. Правила Клечковского Ниже по энергии находится та орбиталь для которой сумма
- 11. Графическое правило Клечковского
- 12. Последовательность заполнения АО по правилам Клечковского 1sι 2s2pι 3s3pι 4s3d4pι 5s4d5pι
- 13. Способы изображения электронных структур Электронная формула Графическая структура Энергетическая диаграмма
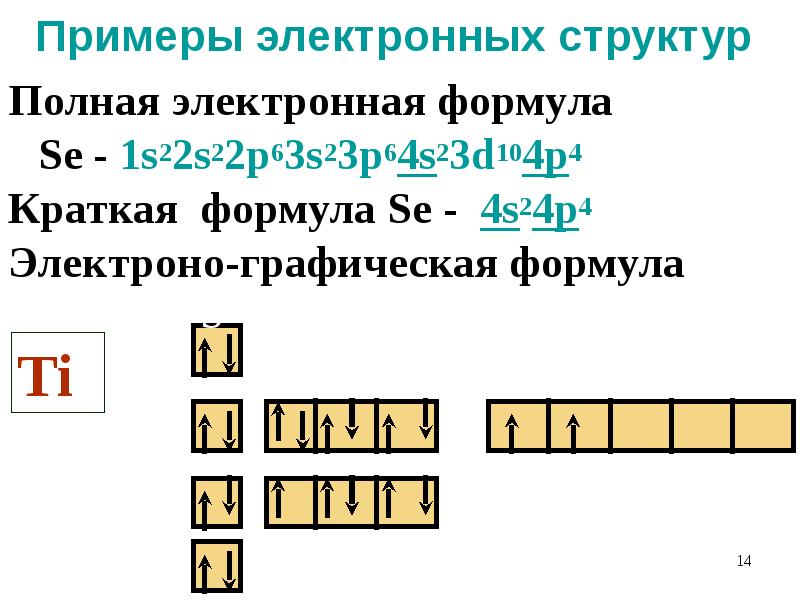
- 14. Примеры электронных структур Полная электронная формула Se - 1s22s22p63s23p64s23d104p4
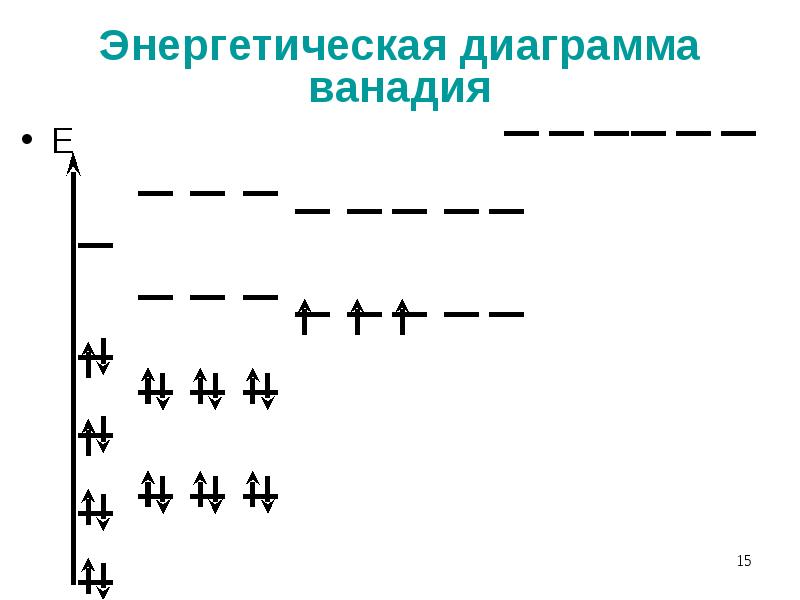
- 15. Энергетическая диаграмма ванадия Е
- 16. Maксимальная емкость подуровня: Maксимальная емкость подуровня: 2(2l+1)e Максимальная емкость
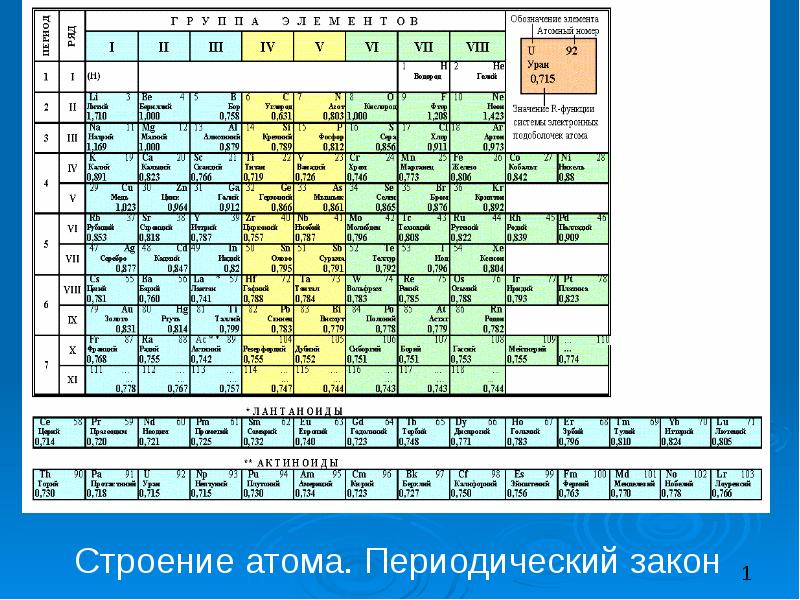
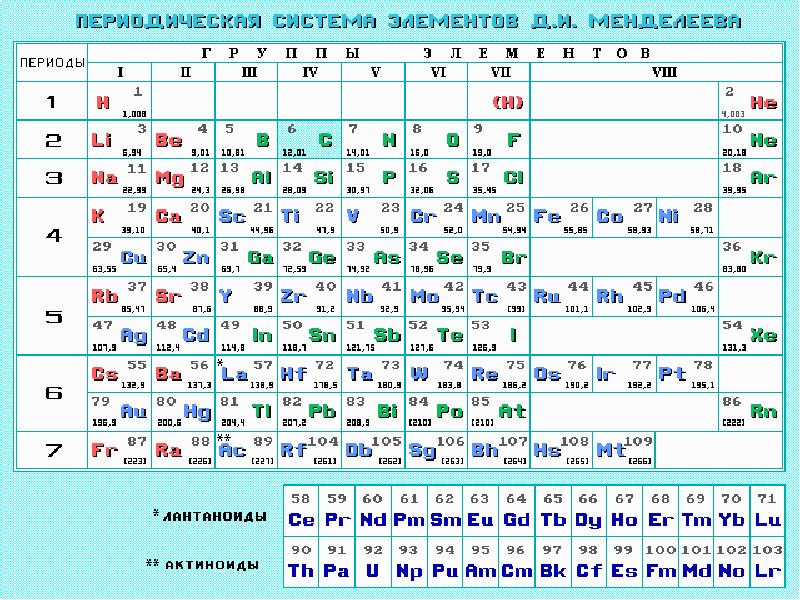
- 17. Периодическая система элементов Д.И. Менделеева (1869г.) Свойства элементов, а также
- 18. Неясные моменты В чем причина периодичности? Почему элементы одной группы
- 19. Периодический закон Свойства элементов, а также формы и свойства их
- 20. Причина периодичности Определенная последовательность формирования электронных оболочек (принципы и правила Паули,
- 21. Короткие периоды 1 период (n=1): (2n2) 2 элемента (1s2) 2 период
- 22. Длинные периоды 4 период (n=4): (2n2 -2*7) 18 элементов (4s23d104p6) 5
- 23. Период - горизонтальная последовательность эл-тов, атомы которых имеют равное число энергетических
- 24. Группа - вертикальная последовательность элементов с однотипной электроной конфигурацией атомов, равным
- 26. Периодичность свойств элементов атомные и ионные радиусы энергия ионизации сродство
- 27. Валентность Валентность определяется электронами внешнего уровня, поэтому высшая валентность элементов главных
- 28. Периодичность свойств простых веществ и соединений температура плавления и кипения длина
- 29. Атомные и ионные радиусы химических элементов Орбитальный радиус атома (иона) –
- 31. Эффективные радиусы Эффективные радиусы атомов и ионов определяют по межъядерным расст-ям
- 32. Ковалентные радиусы - это эффективные радиусы, определяемые по межъядерным расстояниям в
- 33. Энергия и потенциал ионизации атомов Энергия ионизации – это энергия, необходимая
- 34. Сродство к электрону это энергия, выделяющаяся или поглощающаяся при захвате электрона
- 35. Периодические свойства соединений основно-кислотные свойства оксидов и гидроксидов: в периодах
- 37. Скачать презентацию





























Слайды и текст этой презентации
Скачать презентацию на тему Строение атома. Периодический закон можно ниже:
Похожие презентации





























