Структурная организация белковой молекулы презентация
Содержание
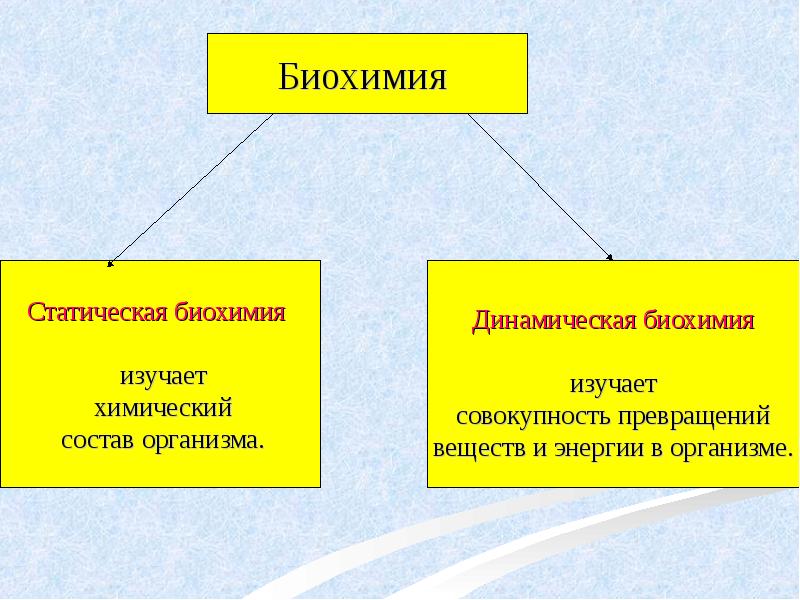
- 2. Биохимия –
- 4. В зависимости от объекта исследования выделяют биохимию человека и животных, биохимию
- 5. Разделы биохимии эволюционная биохимия, энзимология, биохимия витаминов, квантовая биохимия, молекулярная биология,
- 6. Клиническая биохимия раздел биохимии, изучающий изменения биохимических процессов в организме человека
- 7. Значение клинической биохимии На современном этапе развития медицины возросло значение биохимических
- 8. Разделы клинической биохимии клиническая энзимология, клиническая нейрохимия, клиническая витаминология.
- 9. Биохимические исследования позволяют выявить причину заболевания, предложить рациональный и эффективный путь
- 10. Основные достижения биохимии определён химический состав клеток, тканей, организма, открыта двойная
- 11. Генная терапия Дефицит аденозиндезаминазы ведёт к развитию иммунодефицита.
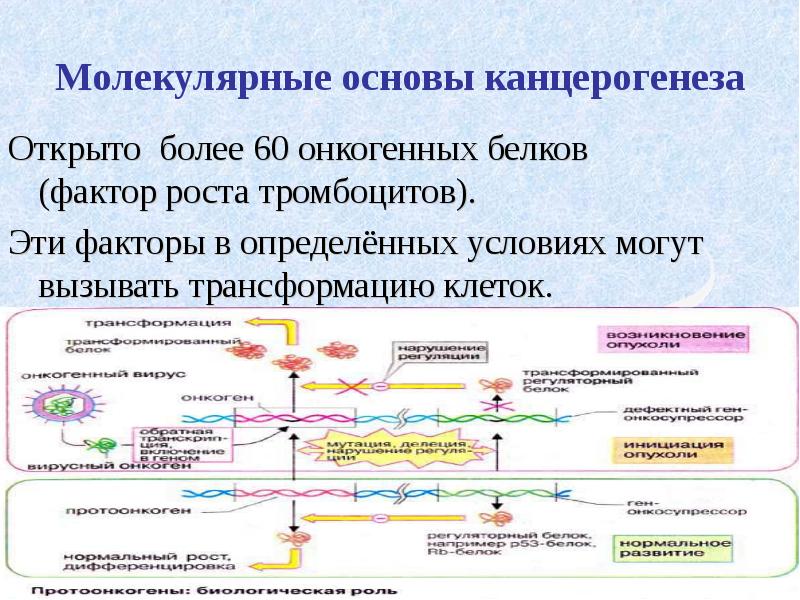
- 12. Молекулярные основы канцерогенеза Открыто более 60 онкогенных белков (фактор роста тромбоцитов).
- 13. Молекулярные механизмы иммунитета Применяется
- 14. Главные направления развития в области биохимии биологические мембраны и биоэнергетика, биосинтез
- 15. Белки высокомолекулярные азотсодержащие органические вещества, молекулы которых построены из остатков
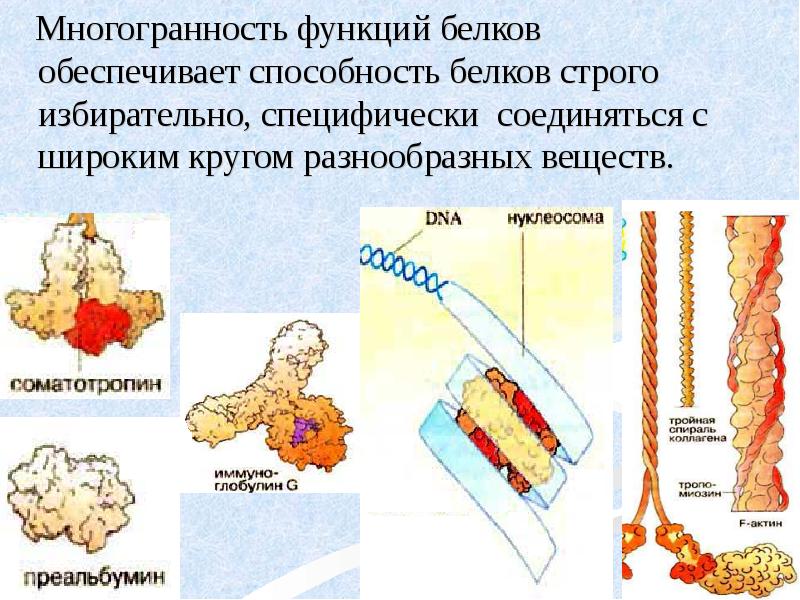
- 16. Многогранность функций белков обеспечивает способность белков строго избирательно, специфически соединяться с
- 17. На долю белков приходится - 70-80 % в: мышцах,
- 18. Состав белков Помимо углерода, кислорода, водорода, входящих в состав почти всех
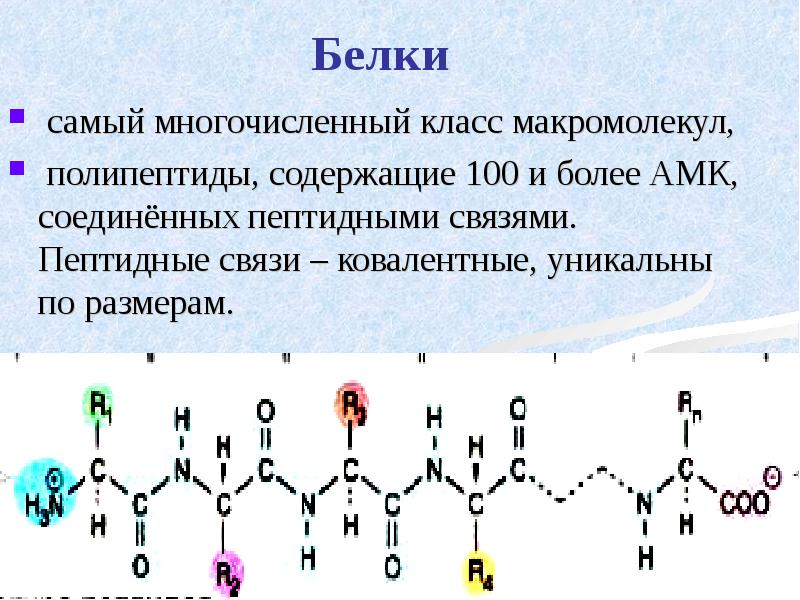
- 19. Белки самый многочисленный класс макромолекул, полипептиды, содержащие 100 и более АМК,
- 20. Специфические особенности белков определяются длиной пептидной цепи, различиями АМК состава,
- 21. Аминокислотный состав белков Помимо 20 АМК в некоторых белках обнаружены и
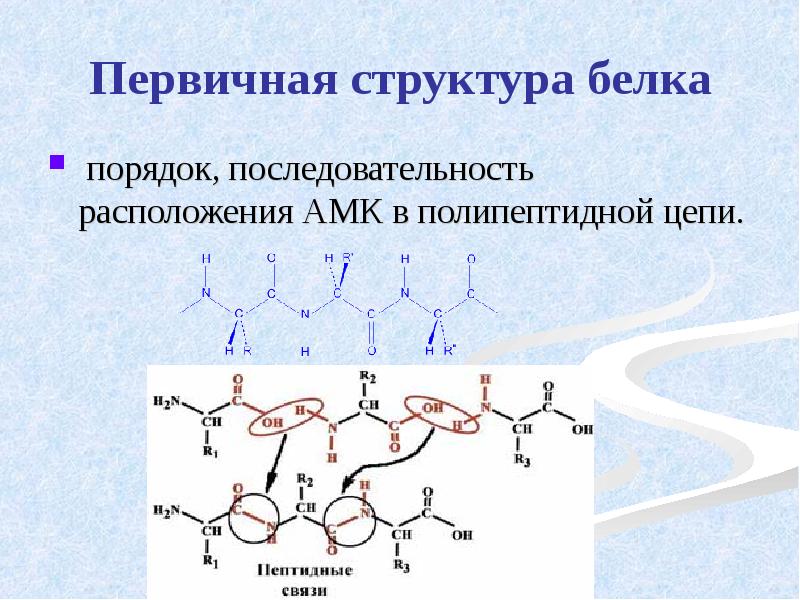
- 22. Первичная структура белка порядок, последовательность расположения АМК в полипептидной цепи.
- 23. Свойства первичной структуры белка уникальна, детерминирована генетически, её стабильность обеспечивается в
- 24. По частоте обнаружения АМК делят на постоянно встречающиеся, изредка встречающиеся.
- 25. Для определения АМК состава белки гидролизуют. Гидролизат: в АМК анализатов, с
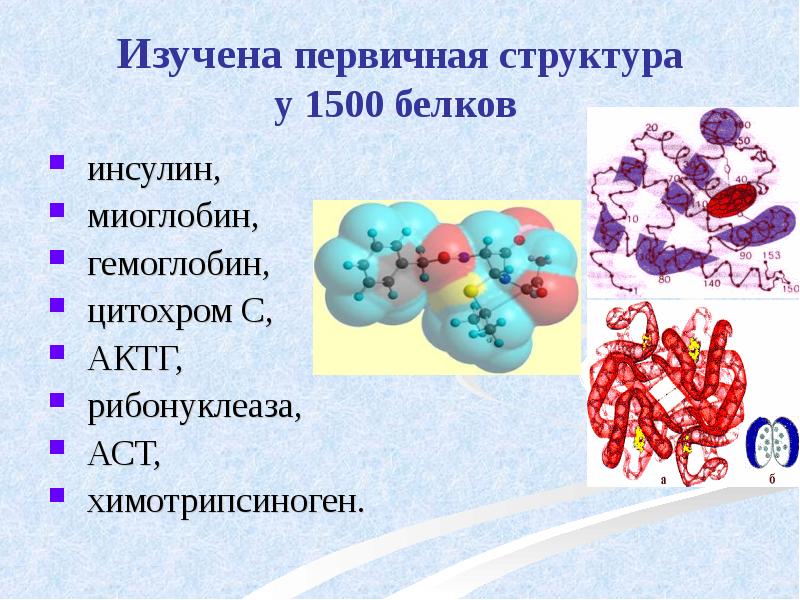
- 26. Изучена первичная структура у 1500 белков инсулин, миоглобин, гемоглобин, цитохром
- 27. Даже небольшие изменения первичной структуры изменяют свойства белков. HbA1 - у
- 28. Вторичная структура пространственное расположение полипептидной цепи, поддерживаемое водородными связями С=О …
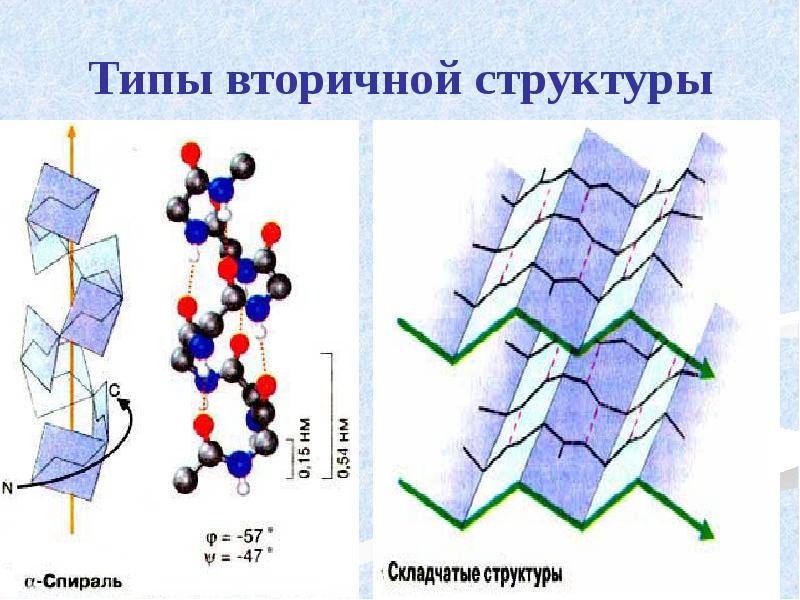
- 29. Типы вторичной структуры
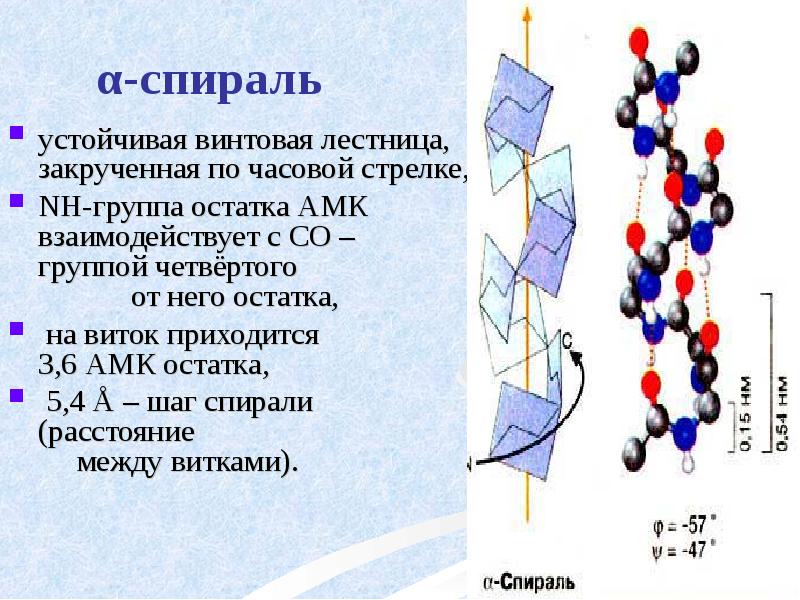
- 30. α-спираль устойчивая винтовая лестница, закрученная
- 31. АМК формирующие α-спираль: ала, лей, глн, цис, фен, тир, три, мет,
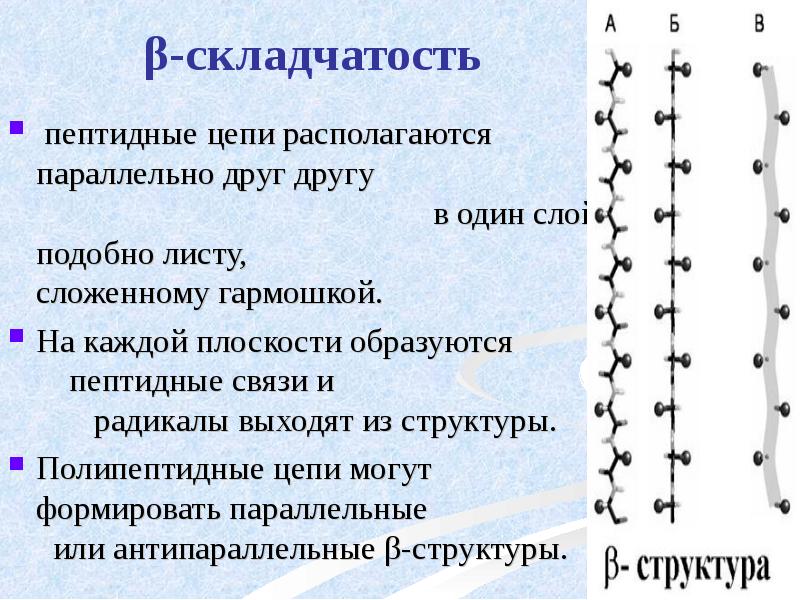
- 32. β-складчатость пептидные цепи располагаются параллельно
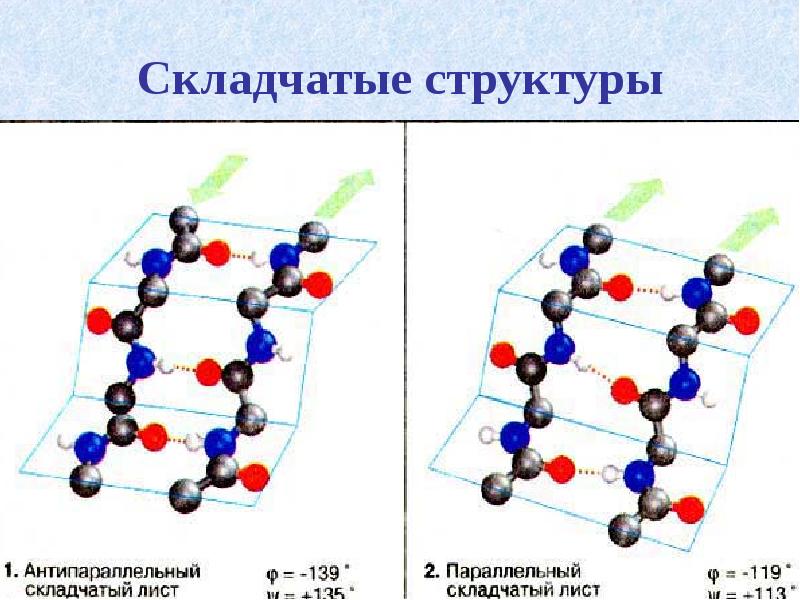
- 33. Складчатые структуры
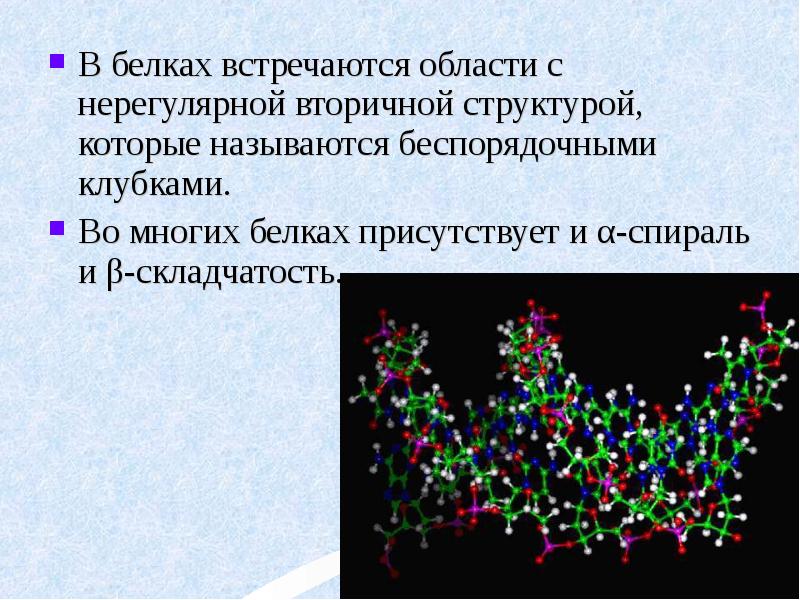
- 34. В белках встречаются области с нерегулярной вторичной структурой, которые называются беспорядочными
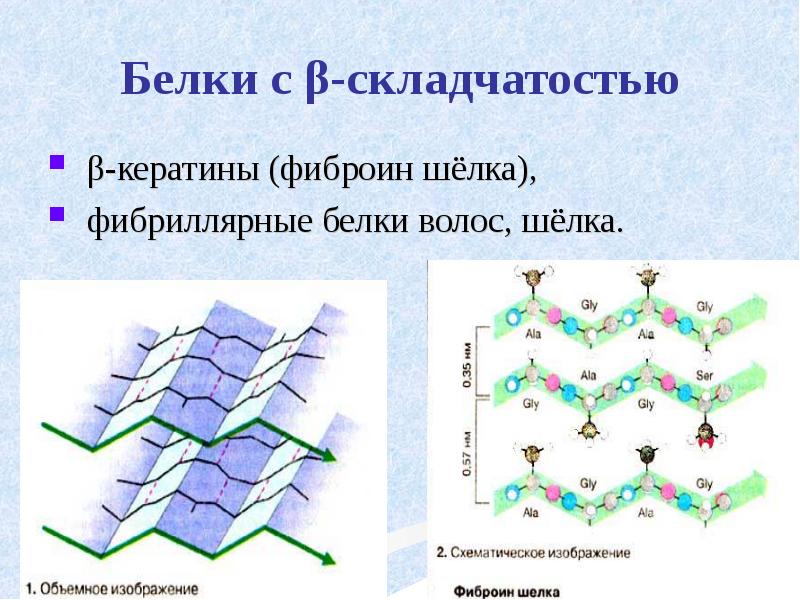
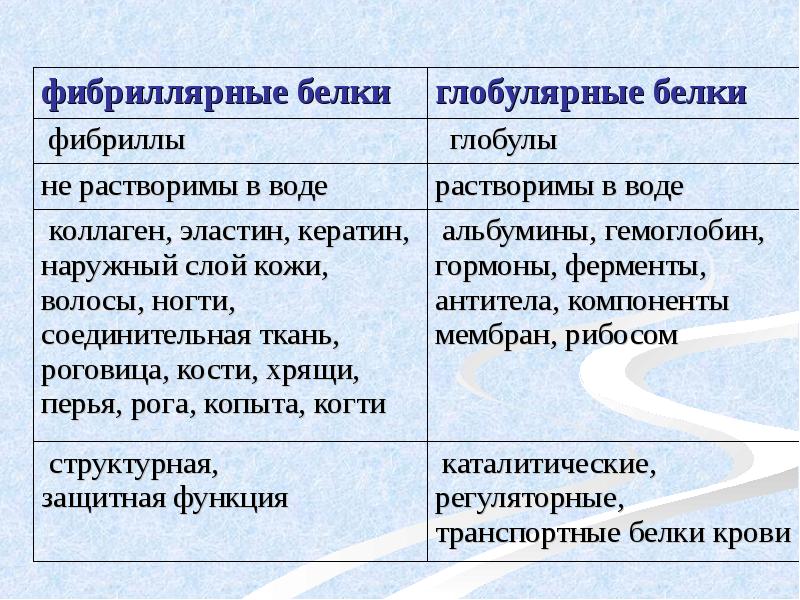
- 35. Белки с β-складчатостью β-кератины (фиброин шёлка), фибриллярные белки волос, шёлка.
- 36. Метод для расшифровки вторичной структуры рентгеноструктурный анализ. Этим методом доказано
- 37. Надвторичные структуры агрегаты полипептидных цепей, обладающих собственной вторичной структурой и образующихся
- 38. Домен компактная глобулярная
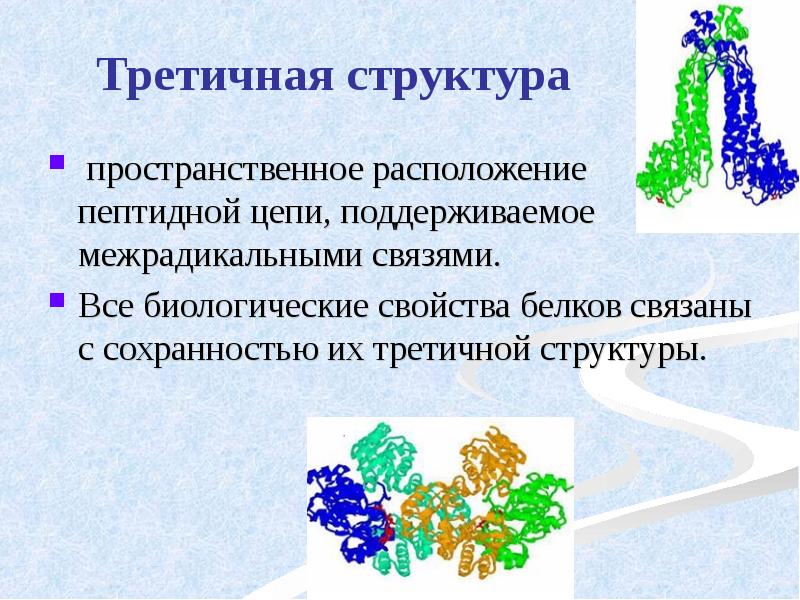
- 39. Третичная структура пространственное расположение пептидной цепи, поддерживаемое межрадикальными связями. Все биологические
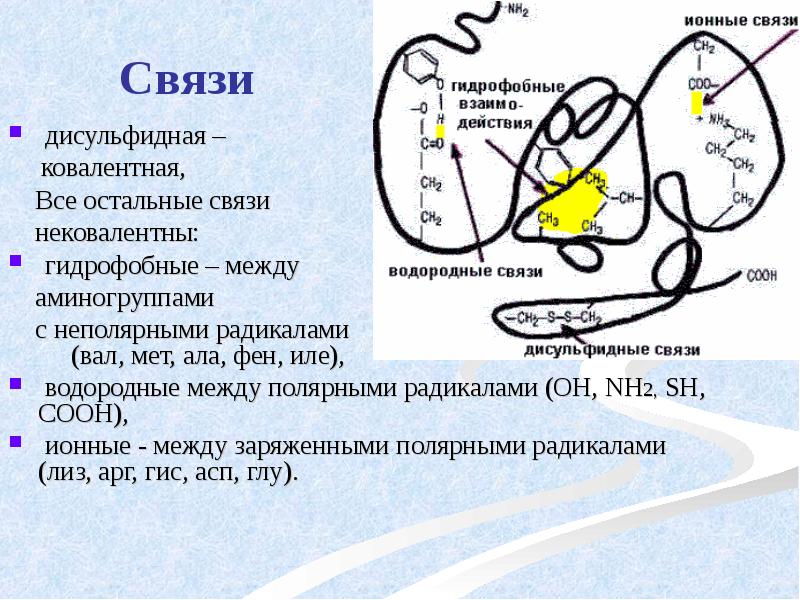
- 40. Связи дисульфидная – ковалентная, Все остальные связи
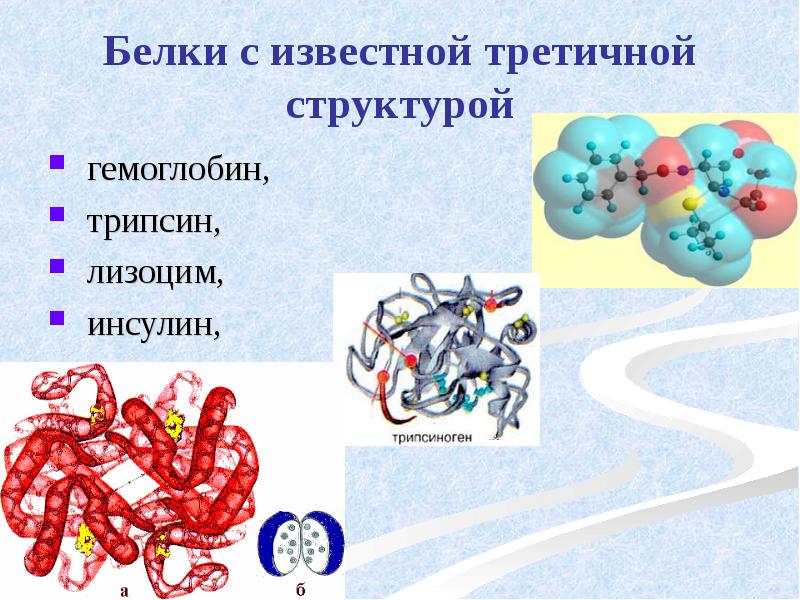
- 41. Белки с известной третичной структурой гемоглобин, трипсин, лизоцим, инсулин, цитохром.
- 42. Методы изучения третичной структуры рентгеноструктурный анализ, электронное микроскопирование.
- 44. Формы конформаций Т-форма, R-форма. Фолдинг – процесс укладки синтезированной полипептидной
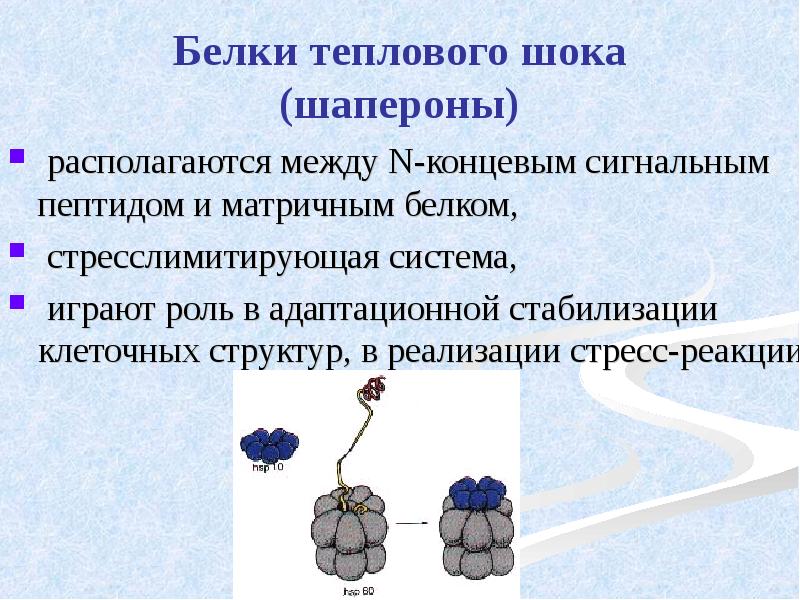
- 45. Белки теплового шока (шапероны) располагаются между N-концевым сигнальным пептидом и матричным
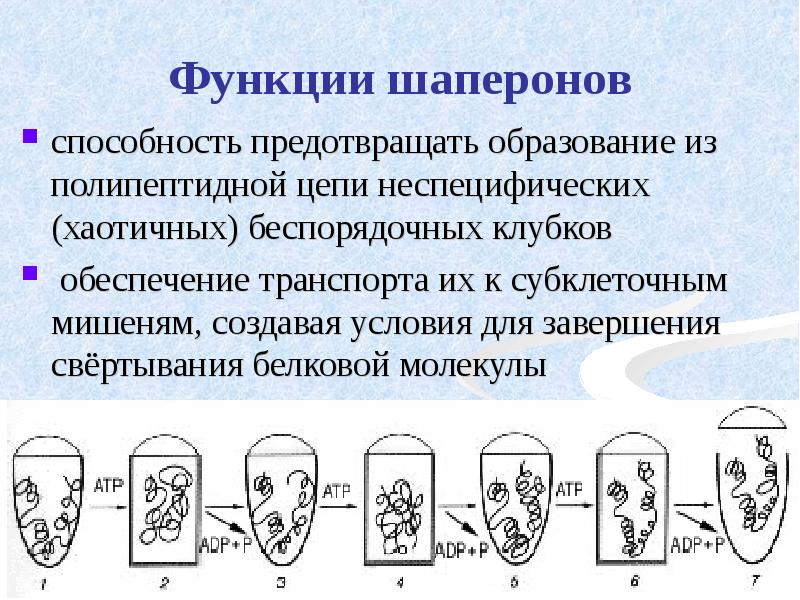
- 46. Функции шаперонов способность предотвращать образование из полипептидной цепи неспецифических (хаотичных) беспорядочных
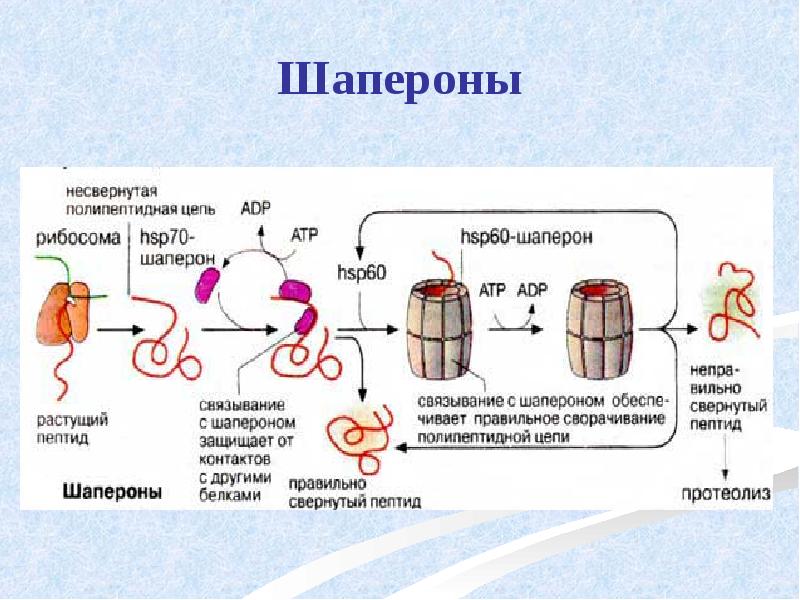
- 47. Шапероны
- 48. Белок Р53 проапоптозный фактор, страж генома.
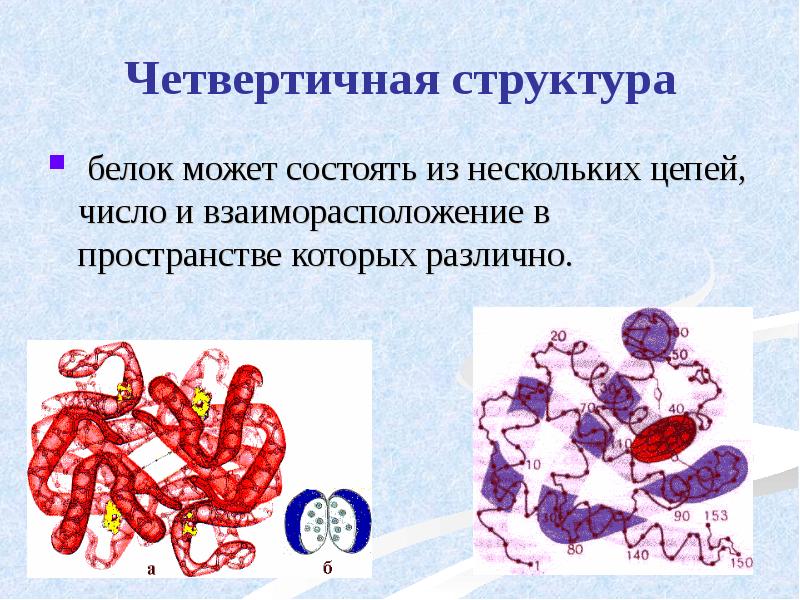
- 49. Четвертичная структура белок может состоять из нескольких цепей, число и взаиморасположение
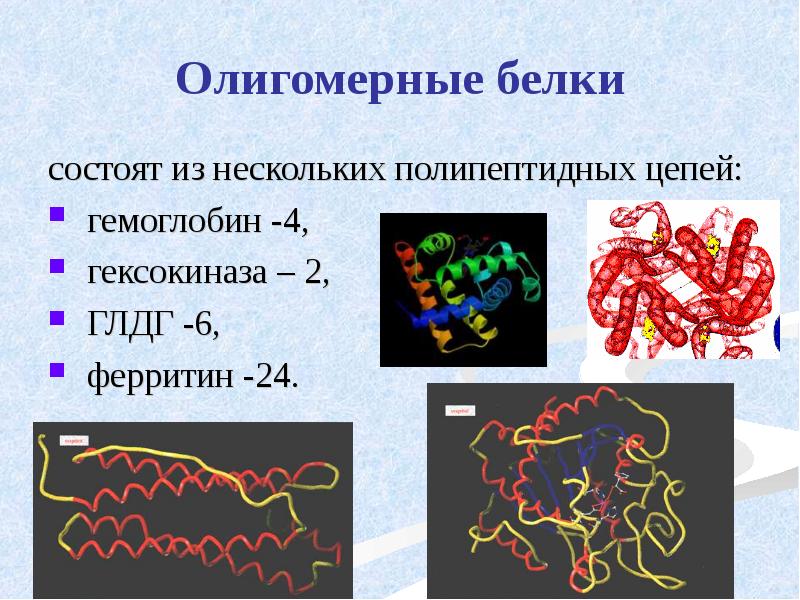
- 50. Олигомерные белки состоят из нескольких полипептидных цепей: гемоглобин -4, гексокиназа –
- 51. Связи, поддерживающие четвертичную структуру гидрофобные, ионные, водородные.
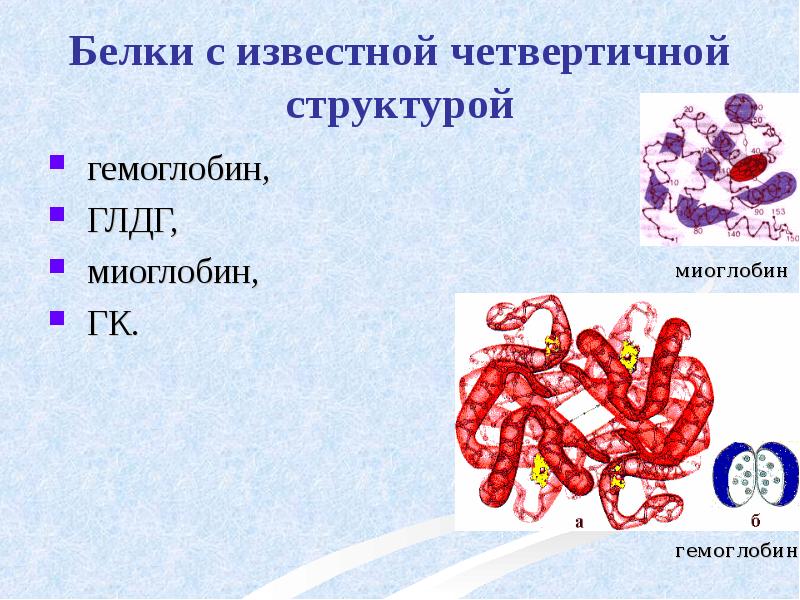
- 52. Белки с известной четвертичной структурой гемоглобин, ГЛДГ, миоглобин, ГК.
- 53. Каждый белок характеризуется уникальной структурой, обеспечивающей уникальность его функций.
- 54. Пептиды органические молекулы,
- 55. Различают пептиды – гормоны: вазопрессин, окситоцин, глюкагон, пептиды, участвующие в регуляции
- 56. Функции белков структурная, каталитическая, регуляторная, рецепторная, иммунологическая, защитная, транспортная, сократительная, опорная,
- 57. В соответствии с функциональным принципом различают 12 главных классов белков ферменты,
- 58. Скачать презентацию































Слайды и текст этой презентации
Скачать презентацию на тему Структурная организация белковой молекулы можно ниже:
Похожие презентации