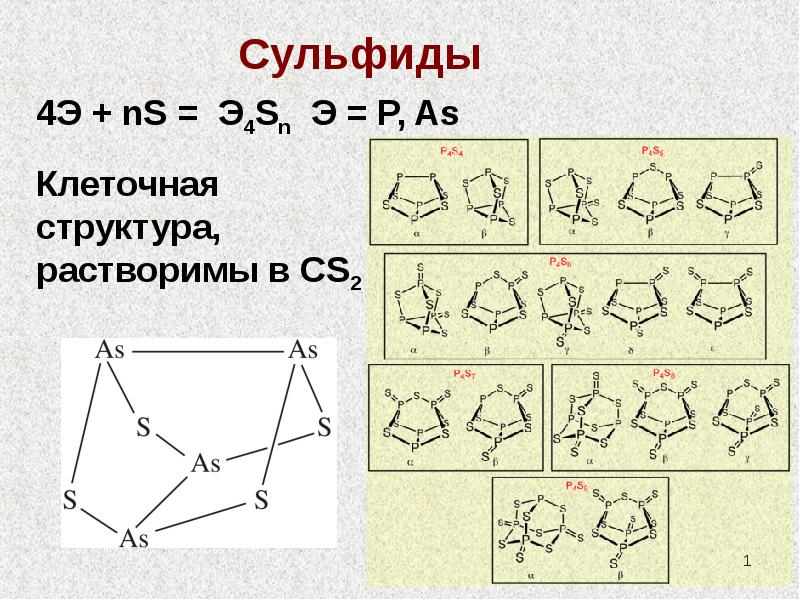
Сульфиды и оксиды презентация
Содержание
- 2. Сульфиды Э = As, Sb, Bi 2ЭCl3 + 3H2S =
- 3. Сульфиды vs. Оксиды
- 4. Тиосоли
- 5. Тиосоли Э3+ (Э = P, As, Sb): NaЭS2 и Na3ЭS3
- 6. Тиосоли Получение в растворе (Э = As, Sb): Э2S3↓+
- 7. Побочная подгруппа Побочная подгруппа V группы периодической системы
- 8. Содержание в земной коре и минералы V – 22 место, рассеян,
- 9. Открытие элементов V – 1801г. мексиканец Дель Рио, затем в 1830
- 10. Простые вещества
- 12. Простые вещества Химически инертные 2V + 12HF = 2H[VF6] + 5H2
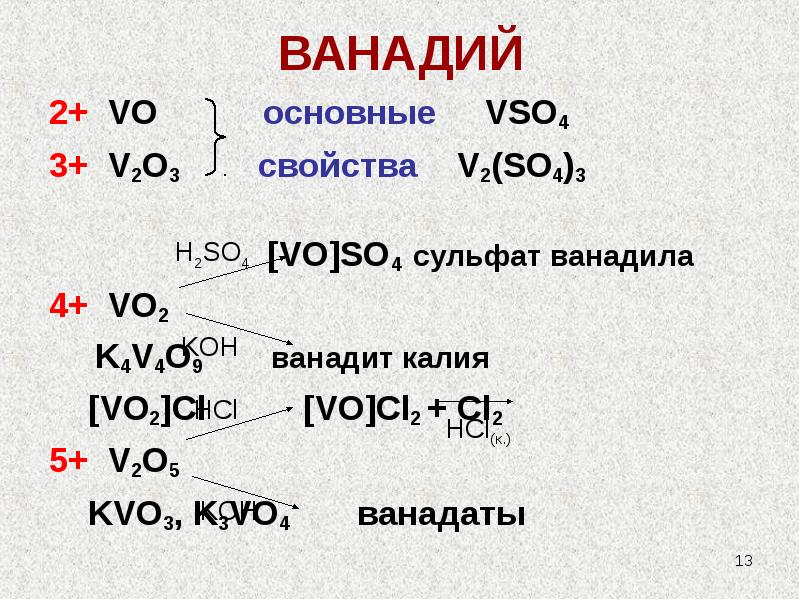
- 13. ВАНАДИЙ 2+ VO основные VSO4 3+ V2O3
- 14. Кислородные соединения V5+ V2O5 + H2O = 2HVO3 (V2O5*xH2O↓) (равновесие влево)
- 15. IV группа периодической системы IV группа периодической системы
- 16. C, Si, Ge, Sn, Pb
- 17. Распространенность и минералы C – 11 место, CO2, CaCO3 (известняк, кальцит,
- 18. Открытие элементов C –известен с древнейших времен; лат. «карбон» - уголь
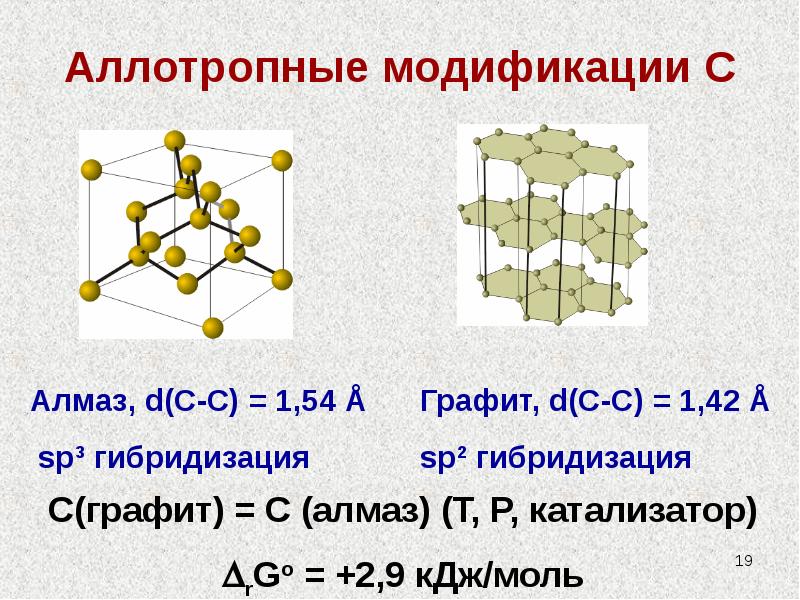
- 19. Аллотропные модификации С
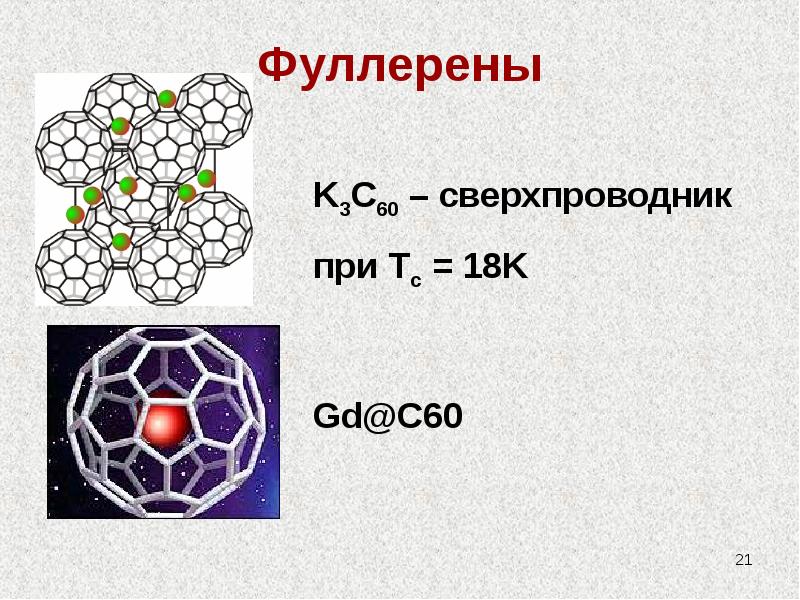
- 20. Фуллерены
- 21. Фуллерены
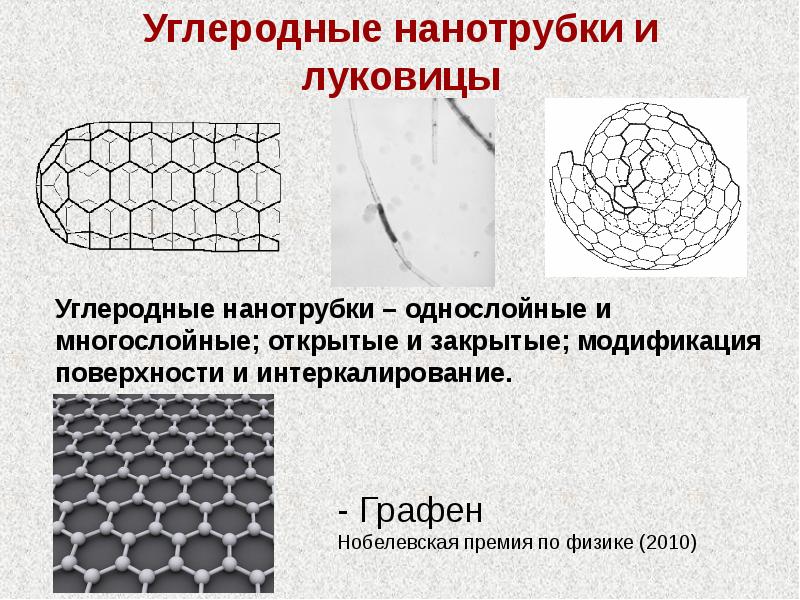
- 22. Углеродные нанотрубки и луковицы
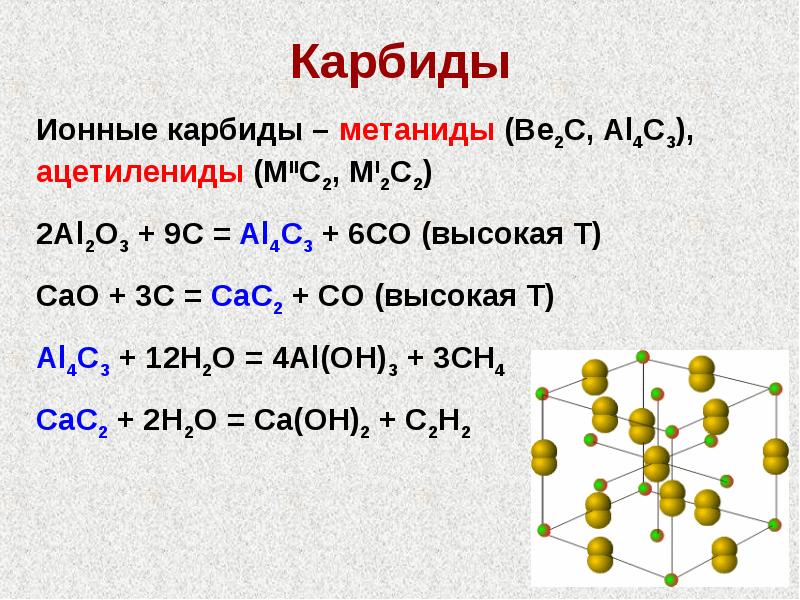
- 23. Карбиды
- 24. Карбиды
- 25. СО (угарный газ)
- 26. Cвойства СО
- 27. СO2
- 28. Карбонаты и гидрокарбонаты
- 29. Галогениды и оксогалогениды
- 30. Скачать презентацию










![Простые вещества
Химически инертные
2V + 12HF = 2H[VF6] + 5H2
Простые вещества
Химически инертные
2V + 12HF = 2H[VF6] + 5H2](/documents_3/fa5d4d99bf8fe9a22d291d4373bc4d7f/img11.jpg)












Слайды и текст этой презентации
Похожие презентации





























