Свойства радиоактивных элементов презентация
Содержание
- 3. Торий Торий (Th) радиоактивный химический элемент, открыт в 1828 году И.Я.
- 4. Торий По химическим свойствам он близок к РЗЭ, особенно к Се.
- 5. Торий В химии известны различные состояния окисления Th; наиболее устойчив Th4+:
- 6. Уран Открыт в 1789 году, но в чистом виде (металл серо-стального
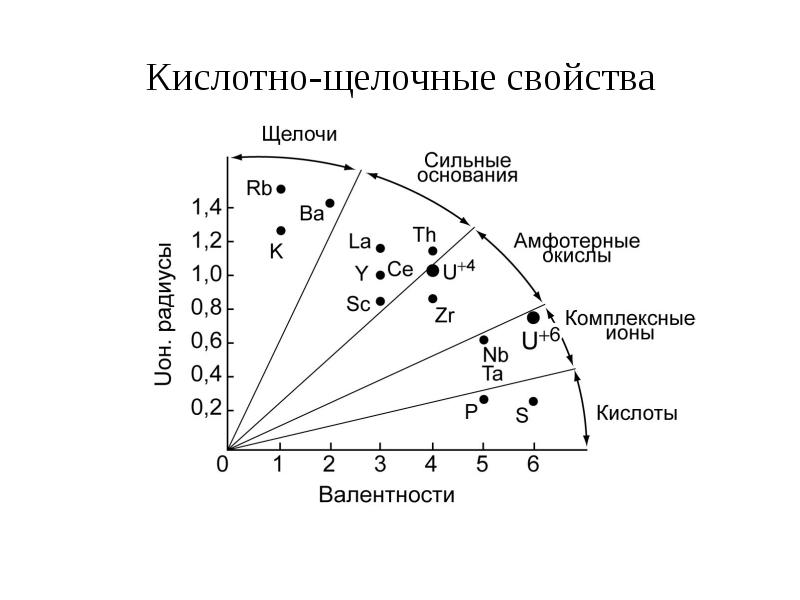
- 7. Кислотно-щелочные свойства
- 8. Уран Химически U весьма активен, имеет переменную валентность - 3+, 4+,
- 9. Потенциал восстановления
- 10. Уран (IV) в своих соединениях присутствует в форме иона U4+. По
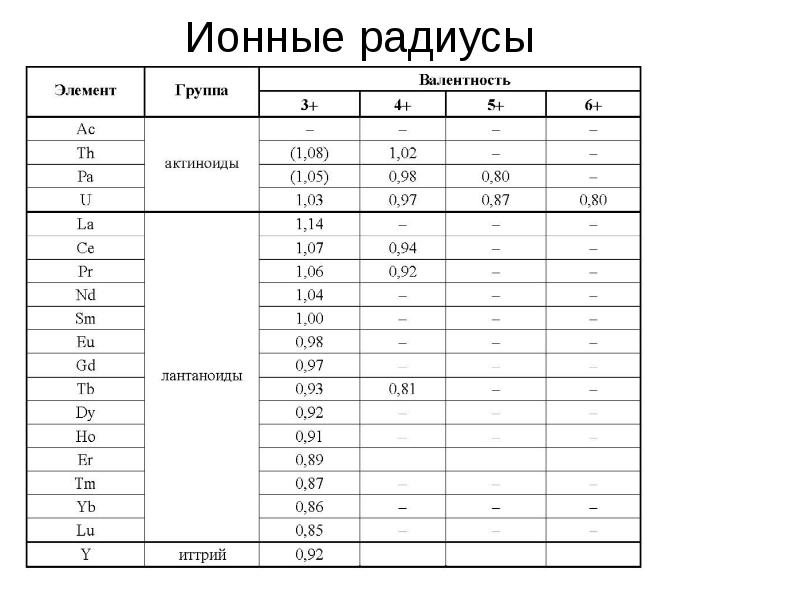
- 11. Ионные радиусы
- 12. Уран (VI) — наиболее устойчивая степень окисления урана при свободном доступе
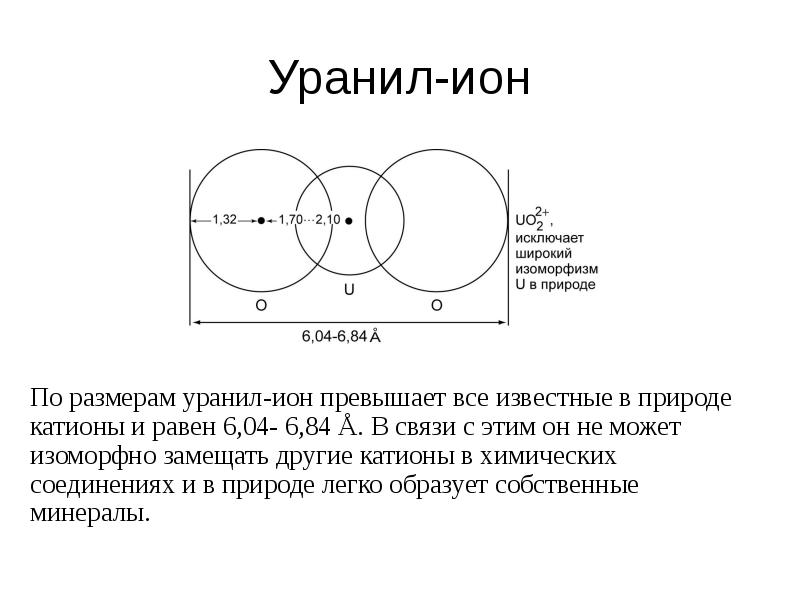
- 13. Уранил-ион
- 14. Соединения U(VI) сравнительно хорошо растворимы и устойчивы в водных растворах. Наиболее
- 15. Наиболее важное значение в природных условиях имеют карбонатные, сульфатные, фторидные, фосфатные
- 16. Ионы U6+ наиболее устойчивы в условиях окислительной обстановки и отличаются от
- 17. Характерна тенденция U6+ к образованию комплексов с карбонатными, сульфатными, фторидными, фосфатными
- 18. Радий (Ra) Известны 4 природных изотопа радия: 223Ra (T1/2=11,2 дня), 224Ra
- 19. Радон (Rn) В природе известно 3 изотопа радона: 222Rn (радон, T1/2=3,8
- 20. Изотопы радона растворимы в воде и других жидкостях. Коэффициент растворимости в
- 21. Полоний (Po) В природе известен ряд изотопов полония: 210Po (T1/2=138 дней),
- 22. В природные растворы Ро поступает в ультрамикроконцентрациях. Он склонен к образованию
- 23. Протактиний (Pa) Атом Pa (5f56d17s2) состоит только из радиоактивных изотопов. В
- 24. Протактиний (Pa) Катионы протактиния легко образуют комплексные соединения, однако большинство из
- 25. Гелий (He) Гелий – нерадиоактивный элемент. После водорода гелий – самый
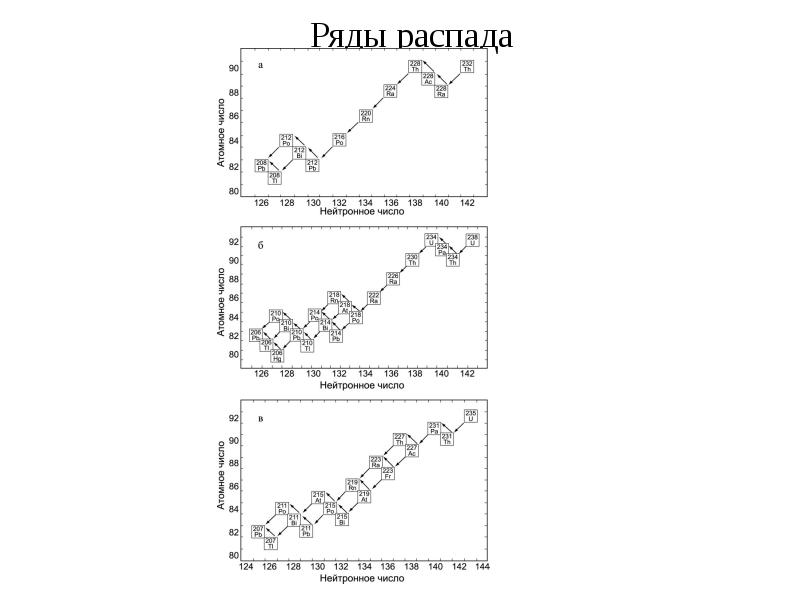
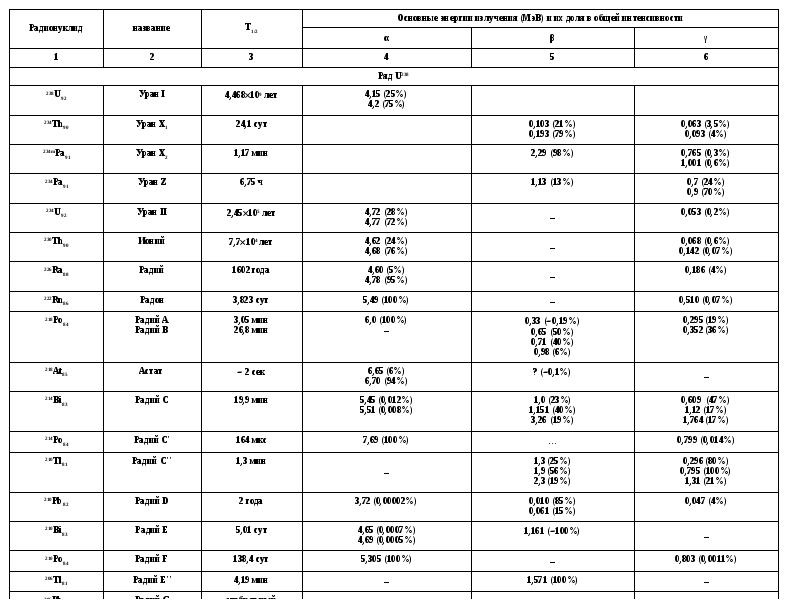
- 26. Ряды распада В отличие от долгоживущих природных радионуклидов 238U, 235U и
- 27. Ряды распада
- 28. Ряды распада
- 29. Альфа-распад заключается в способности ядер превращаться в другие более легкие ядра
- 31. В каждом из природных рядов встречается определенная последовательность превращений, когда за
- 32. Радиоактивное равновесие в рядах распада Члены каждого ряда связаны друг с
- 33. Это соотношение определяет так называемое «вековое» равновесие (Баранов, 1956). Скорость установления
- 34. В зависимости от соотношения периодов полураспада материнского ТМ и дочернего TД
- 35. Радиоактивное равновесие в данном ряду распада считается нарушенным, если соотношение между
- 36. Существуют три основные группы факторов, приводящие к нарушению радиоактивного равновесия в
- 37. Рассмотрим некоторые примеры (Титаева, 2000). Рассмотрим некоторые примеры (Титаева, 2000). 1) При
- 38. В практике геологоразведочных работ особое значение имеет радиоактивное равновесие между ураном
- 39. Скачать презентацию
































Слайды и текст этой презентации
Похожие презентации





























