Теоретические основы теплотехники презентация
Содержание
- 2. Что такое термодинамика Термодинамика это наука, изучающая физические свойства макроскопических систем
- 3. Виды термодинамики В инженерной практике различают: общую или физическую термодинамику;
- 4. Термодинамическая система Термодинамическая система это совокупность тел (субстанций), могущих обмениваться между
- 5. Термодинамические процессы Термодинамический процесс это всякое изменение, происходящее в термодинамической системе
- 6. Термодинамическое равновесие Термодинамическое равновесие это состояние, в которое, в конце концов,
- 8. Термодинамические параметры
- 9. Термодинамические параметры (продолжение) Температура - интенсивность теплового движения атомов, молекул и
- 10. Термодинамические параметры (продолжение) Плотность , кг/м3, - отношение массы к объему;
- 12. Состояние веществ Любое вещество может находиться в газообразном, жидком и твердом
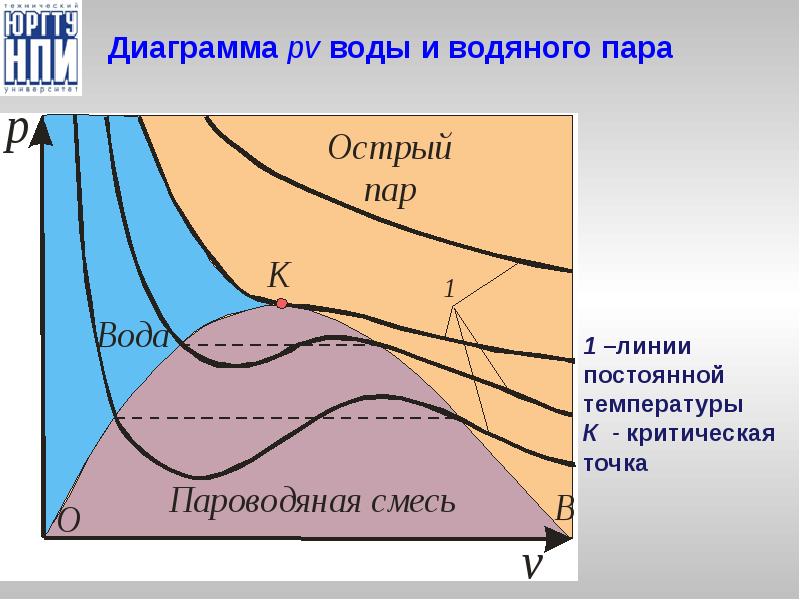
- 13. Диаграмма pv воды и водяного пара
- 14. Основные законы идеальных газов Закон Бойля-Мариота (открыт в 1662-1676 г.):
- 15. Основные законы идеальных газов (продолжение)
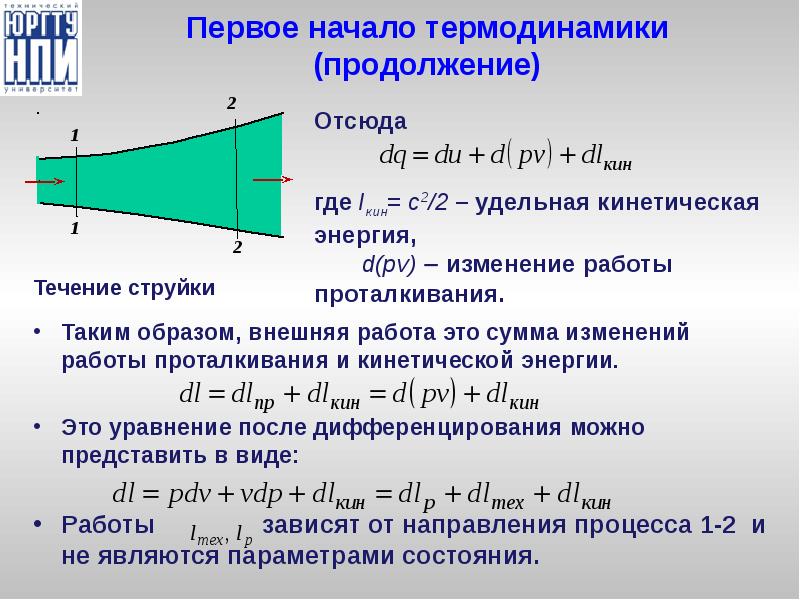
- 16. Первое начало термодинамики 1-е опредление. Энергия не исчезает и не
- 17. Первое начало термодинамики (продолжение) Таким образом, внешняя работа это сумма изменений
- 18. Свойства термодинамических процессов Равновесные и неравновесные процессы. Процесс, при котором изменение
- 19. Свойства термодинамических процессов (продолжение) Термодинамические процессы могут быть стационарными и нестационарными.
- 20. Термодинамические процессы идеальных газов
- 21. Термодинамические процессы идеальных газов (продолжение) Закономерности изменения параметров могут быть описаны
- 22. Изохорный и изобарный процессы 1. Изохорный процесс: v = const.
- 23. Изотермический и адиабатический процессы 3. Изотермический процесс: Т = const.
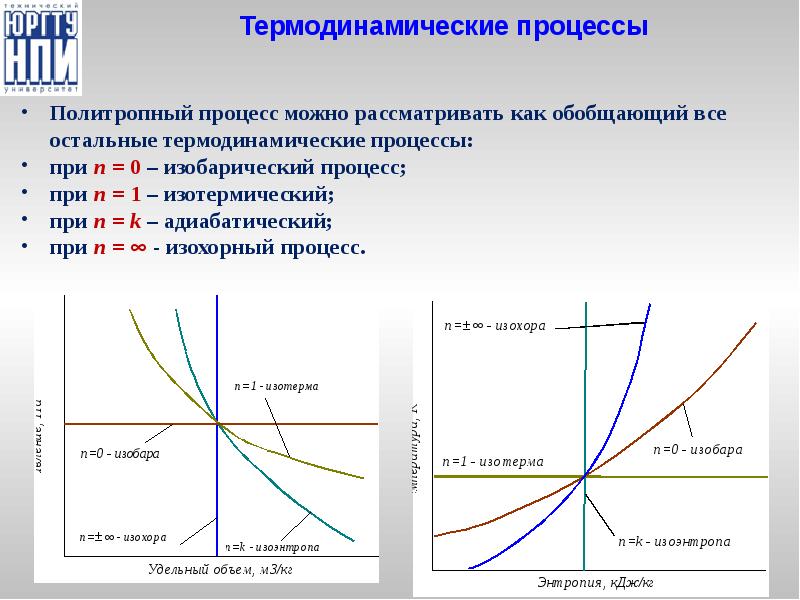
- 24. Политропный процесс 5. Политропный процесс – общий процесс, объединяющий все вышеперечисленные.
- 25. Термодинамические процессы Политропный процесс можно рассматривать как обобщающий все остальные
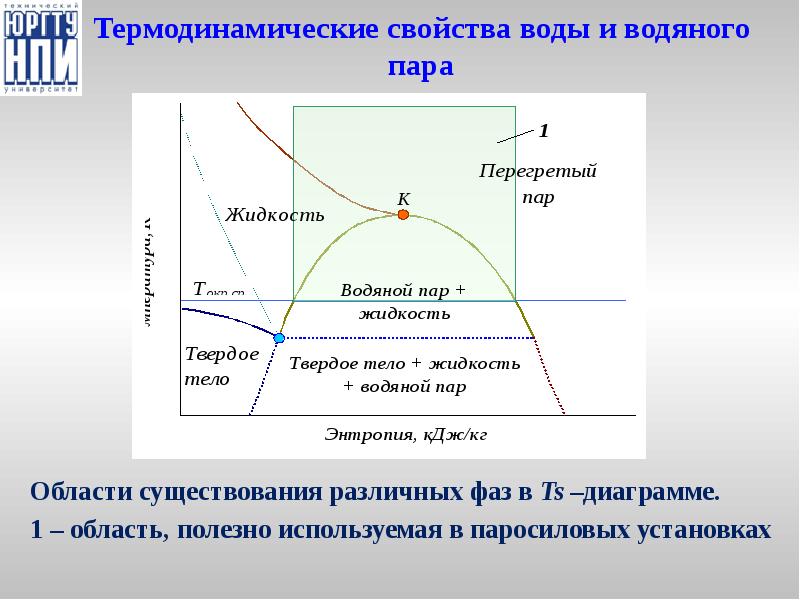
- 26. Термодинамические свойства воды и водяного пара
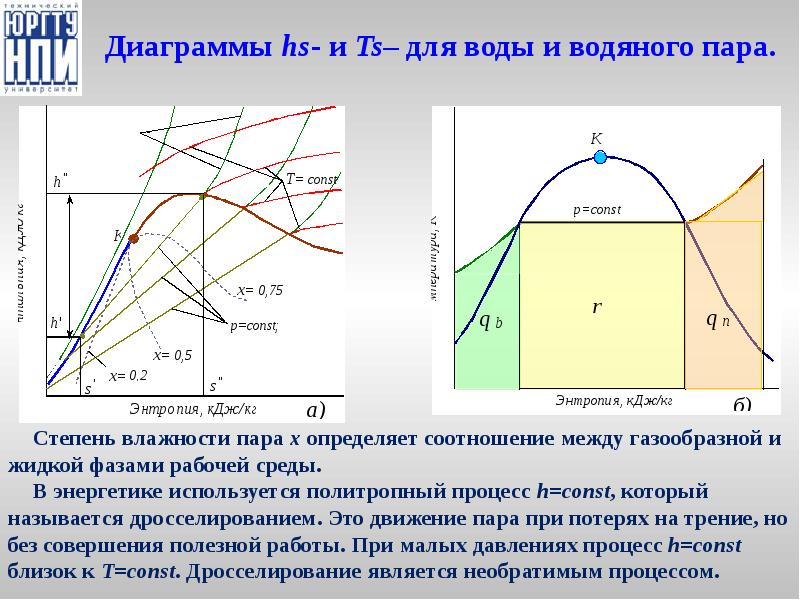
- 27. Диаграммы hs- и Ts– для воды и водяного пара.
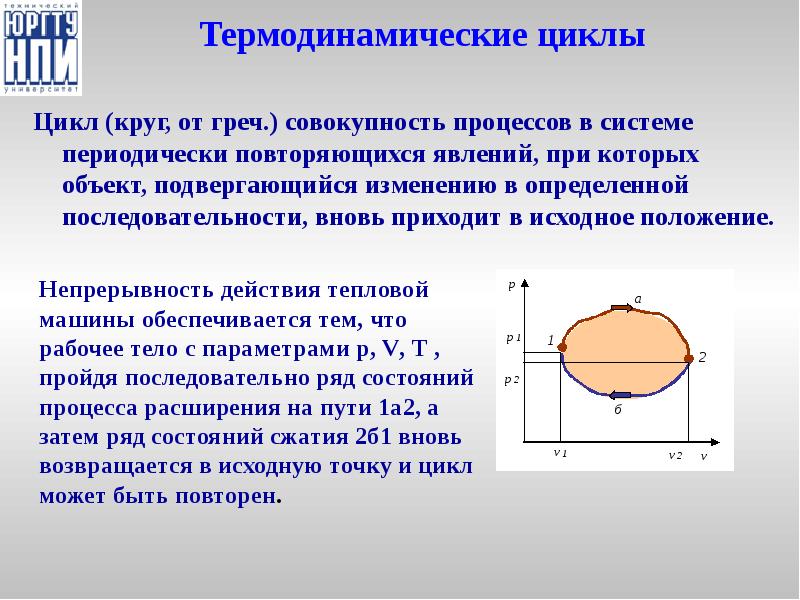
- 28. Термодинамические циклы Цикл (круг, от греч.) совокупность процессов в системе
- 29. Работа цикла При процессе расширения работа (тепло) подводится к рабочему телу
- 30. Второй закон термодинамики Для осуществления термодинамического цикла необходимо иметь не только
- 31. Термодинамические циклы Если процессы расширения располагаются выше процессов сжатия (
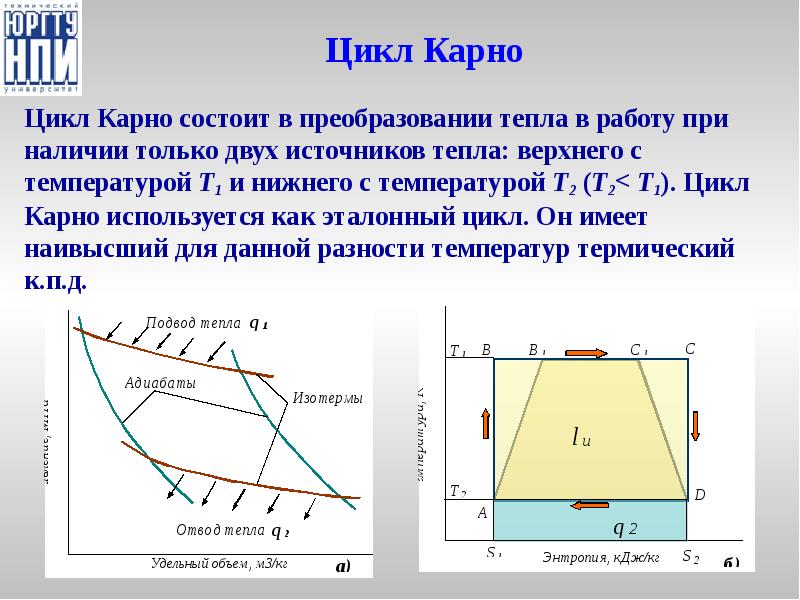
- 32. Цикл Карно Цикл Карно состоит в преобразовании тепла в работу при
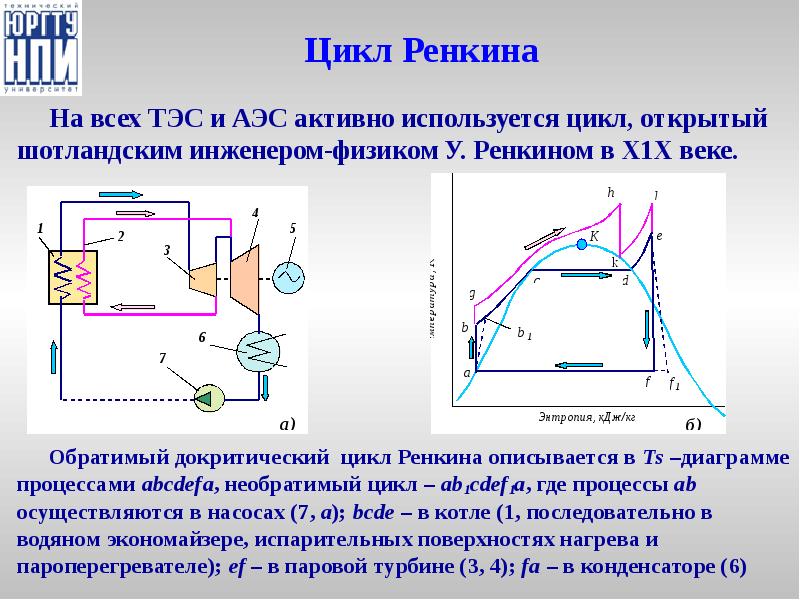
- 33. Цикл Ренкина На всех ТЭС и АЭС активно используется цикл, открытый
- 34. Общие понятия о процессе теплообмена Теплообменом называется необратимый самопроизвольный процесс переноса
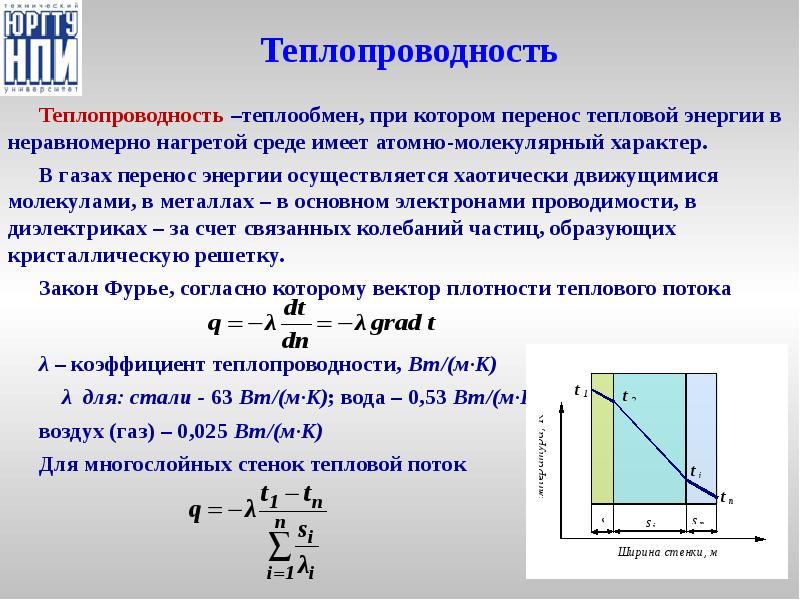
- 35. Теплопроводность Теплопроводность –теплообмен, при котором перенос тепловой энергии в неравномерно нагретой
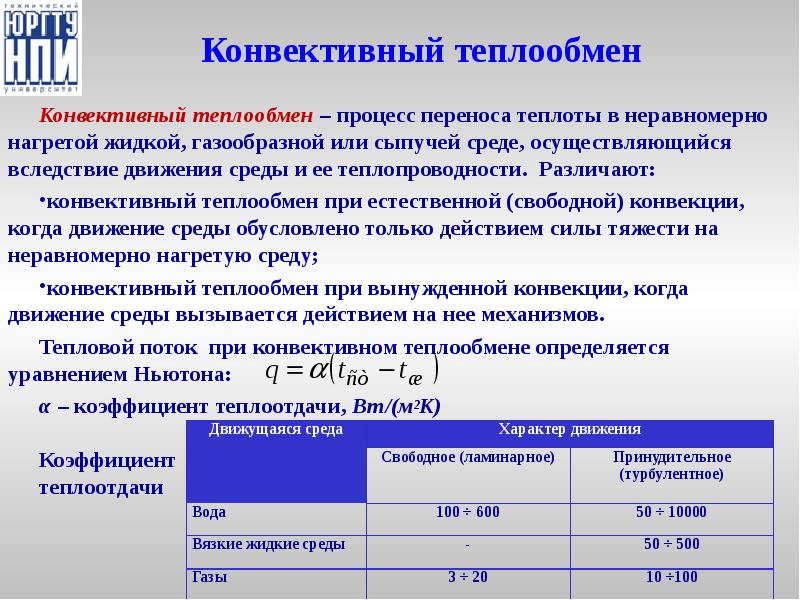
- 36. Конвективный теплообмен Конвективный теплообмен – процесс переноса теплоты в неравномерно нагретой
- 37. Теплопередача через стенку Этапы теплопередачи через стенку 1. Теплопередача от более
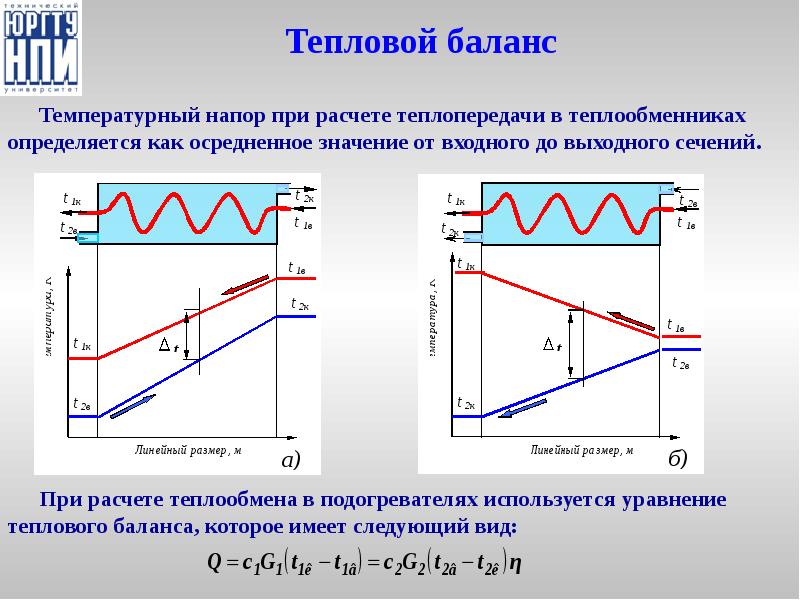
- 38. Тепловой баланс Температурный напор при расчете теплопередачи в теплообменниках определяется как
- 39. Теплообмен излучением Электромагнитное излучение с длиной волны от 8·10-10 до 8·10-4
- 40. Южно-Российский государственный технический университет (Новочеркасский политехнический институт) Благодарю за внимание
- 41. Скачать презентацию





























Слайды и текст этой презентации
Скачать презентацию на тему Теоретические основы теплотехники можно ниже:
Похожие презентации





























