Теория растворов. Диффузия в растворах. Коллигативные свойства растворов презентация
Содержание
- 2. План лекции Общие понятия Свойства разбавленных растворов неэлектролитов Закон Вант-Гоффа для
- 3. Реальный раствор Идеальный раствор Раствор, в котором нет химического взаимодействия между
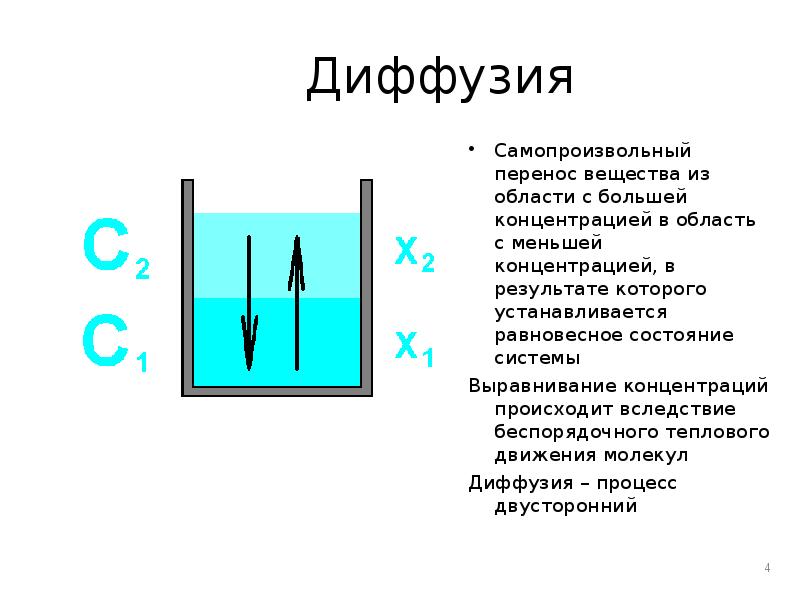
- 4. Диффузия Самопроизвольный перенос вещества из области с большей концентрацией в область
- 5. Скорость диффузии Измеряется количеством вещества, перенесенного в единицу времени через единицу
- 6. Коэффициент диффузии (Д) Определяет собой количество вещества, продиффундировавшего через единицу поверхности
- 7. Анализ уравнения Величина диффузии зависит: От площади переноса От градиента концентрации
- 8. Значение диффузии для биологических процессов Всасывание питательных веществ из просвета кишечника
- 9. Диффузия в живых организмах регулируется функциональным состоянием тканей и зависит от
- 10. Виды диффузии в организме Диффузия через клеточную мембрану: Пассивная – ей
- 11. Коллигативные свойства разбавленных растворов неэлектролитов Осмотическое давление Понижение давления насыщенного пара
- 12. Полупроницаемая мембрана Способна пропускать в большей степени молекулы растворителя, чем молекулы
- 13. Осмос Односторонняя самопроизвольная диффузия молекул растворителя через полупроницаемую мембрану из раствора
- 14. Осмометр и осмотическое давление Осмотическое давление – гидростатическое давление, которое надо
- 15. Закон Вант-Гоффа для осмотического давления Осмотическое давление разбавленных растворов неэлектролитов равно
- 16. Осмотическое давление 1 М раствора при 0°С должно быть равно 22,4
- 17. Значение осмоса для биологических систем Тургор – упругое состояние клеток, обусловленное
- 18. Изотонические растворы Растворы, обладающие при одинаковых условиях одинаковым осмотическим давлением Изотоническими
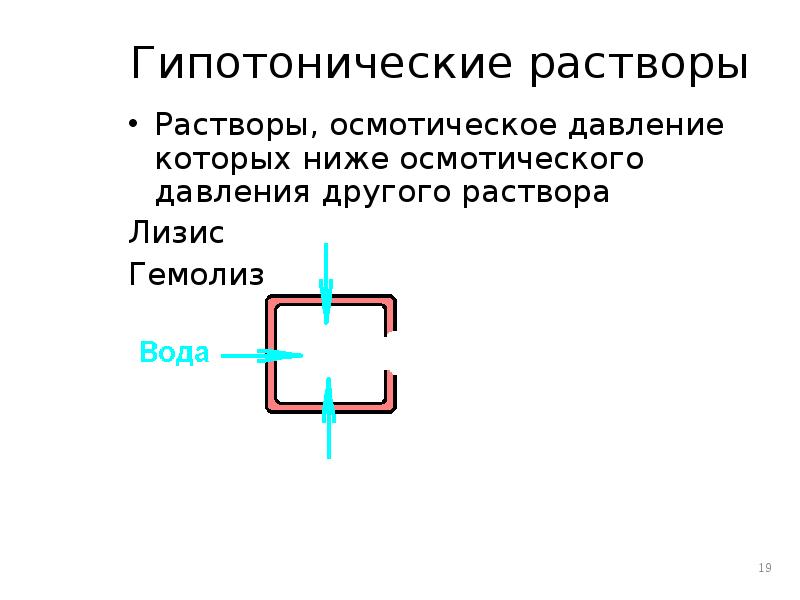
- 19. Гипотонические растворы Растворы, осмотическое давление которых ниже осмотического давления другого раствора
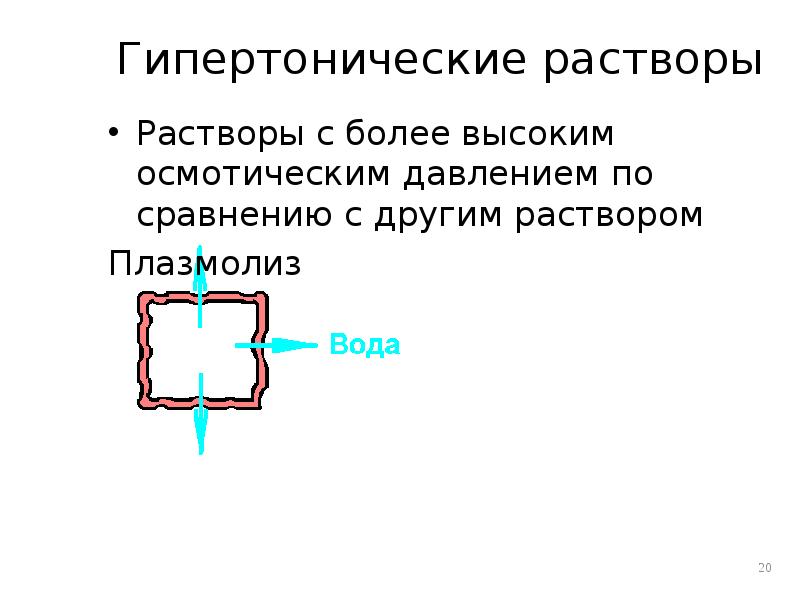
- 20. Гипертонические растворы Растворы с более высоким осмотическим давлением по сравнению с
- 21. Применение гипертонических растворов Наружно: гипертонические повязки (10 – 20% раствор NaCl)
- 22. Онкотическое давление крови Белки плазмы крови не проходят через клеточную мембрану,
- 23. Давление насыщенного пара Давление пара, находящегося в равновесии с жидкостью При
- 24. Давление насыщенного пара над раствором Испарение жидкости Конденсация паров на поверхности
- 25. Закон Рауля Относительное понижение давления насыщенного пара растворителя над раствором равно
- 26. N = ----------
- 27. Следствия из закона Рауля Растворы кипят при более высокой температуре, чем
- 28. Замерзание и кипение растворов «Морозы соленого рассолу не могут в лед
- 29. Физический смысл Е и К Е – повышение температуры кипения раствора,
- 30. Методы определения молекулярных масс Эбулиометрия – применяют в случае недостаточно растворимых
- 31. Закон Нернста – Шилова Вещество, способное растворяться в двух несмешивающихся жидкостях,
- 32. Экстракция Метод извлечения одного из компонентов раствора с помощью растворителя, не
- 33. Скачать презентацию





























Слайды и текст этой презентации
Скачать презентацию на тему Теория растворов. Диффузия в растворах. Коллигативные свойства растворов можно ниже:
Похожие презентации





























