Теория растворов. Растворы электролитов презентация
Содержание
- 2. План лекции Свойства растворов электролитов Закон разбавления Оствальда Теория сильных электролитов
- 3. Растворы электролитов Имеют более высокое, чем по закону Вант-Гоффа, осмотическое давление
- 4. Изотонический коэффициент i = СRT = iСRT Показывает, во
- 5. Степень диссоциации Кол-во продиссоциированных молекул = -----------------------------------------------------------
- 6. Степень диссоциации зависит: От температуры От концентрации раствора От природы растворенного
- 7. Константа диссоциации Константа равновесия, отвечающая диссоциации слабого электролита CH3COOH H+
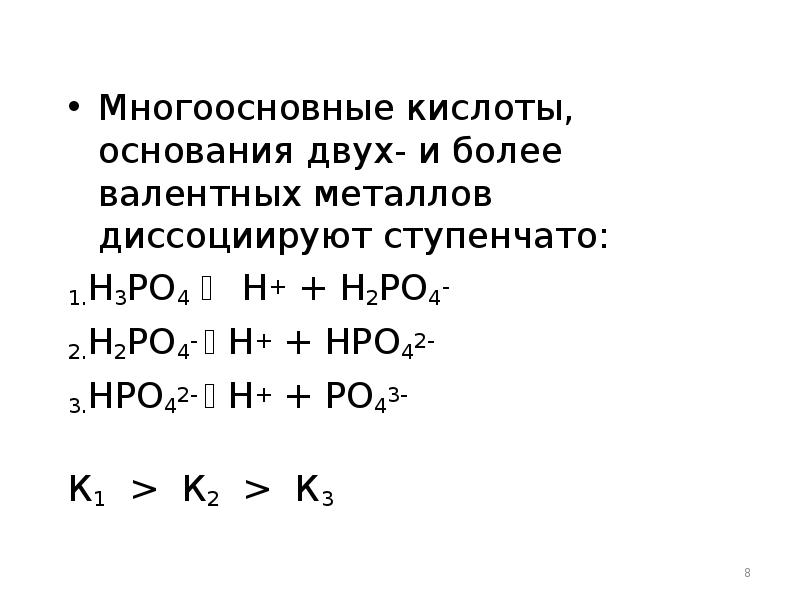
- 8. Многоосновные кислоты, основания двух- и более валентных металлов диссоциируют ступенчато: Многоосновные
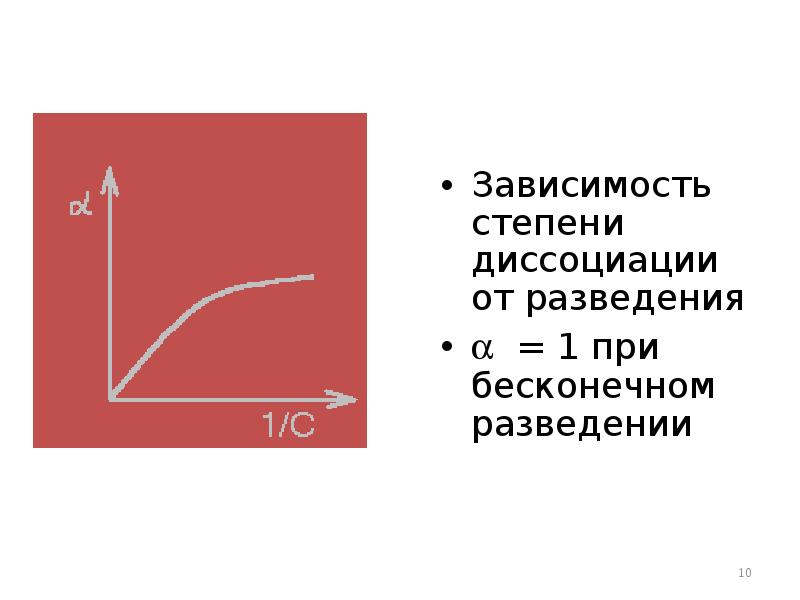
- 9. Закон разбавления Оствальда При разбавлении раствора слабого электролита степень диссоциации увеличивается
- 10. Зависимость степени диссоциации от разведения Зависимость степени диссоциации от разведения
- 11. Теория сильных электролитов В водных растворах электролитов концентрация ионов велика Расстояние
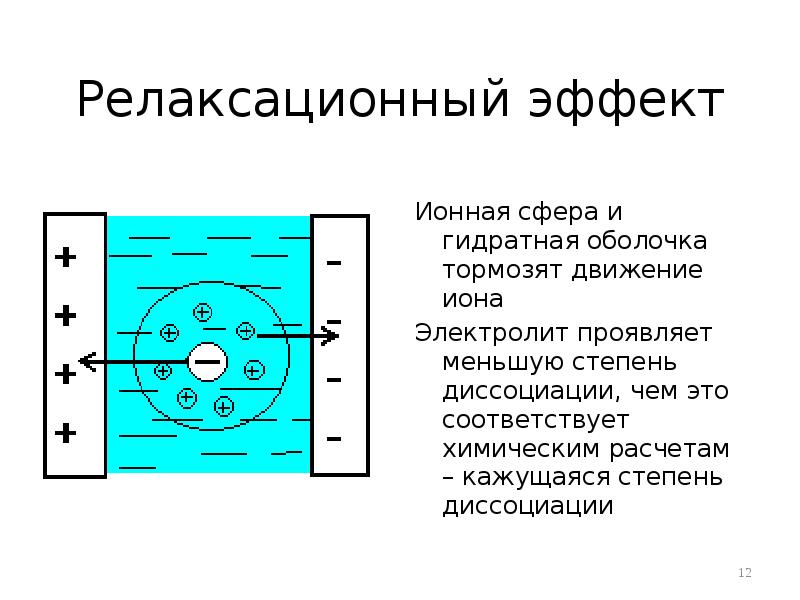
- 12. Релаксационный эффект Ионная сфера и гидратная оболочка тормозят движение иона Электролит
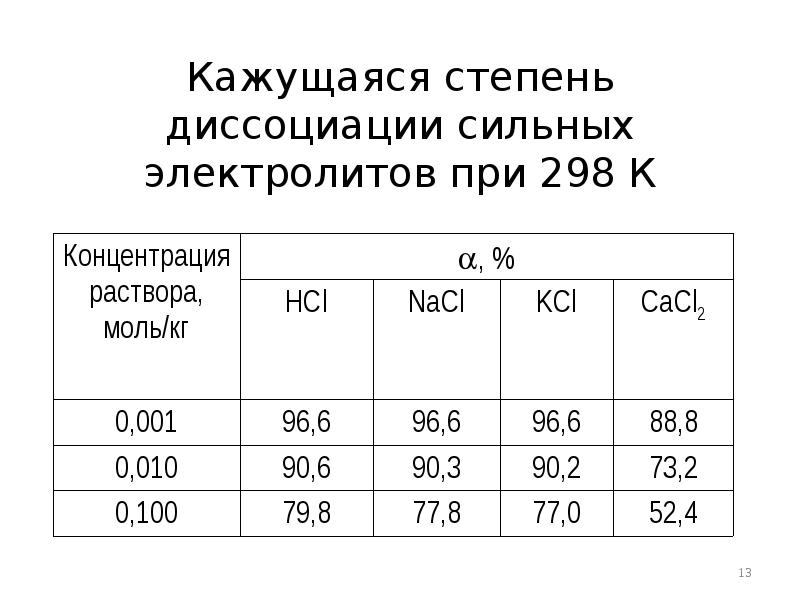
- 13. Кажущаяся степень диссоциации сильных электролитов при 298 К
- 14. Активность иона а Та эффективная условная концентрация иона, соответственно которой он
- 15. При очень больших концентрациях растворов некоторых электролитов f может быть больше
- 16. Ионная сила раствора I Величина, измеряемая полусуммой произведений концентраций каждого иона
- 17. Закон Дебая-Хюккеля В разбавленных растворах сильных электролитов с одинаковой ионной силой
- 18. Активность ионов является эффективной концентрацией, проявляющей себя при химических реакциях Активность
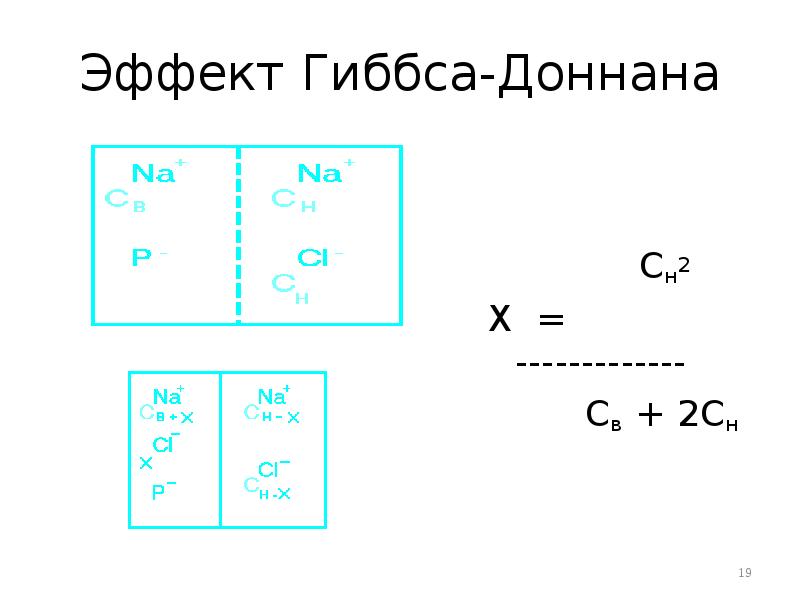
- 19. Эффект Гиббса-Доннана Сн2 Х = -------------
- 20. Если до начала перераспределения концентрация Naн+ была значительно выше, чем внутри
- 21. При соприкосновении клетки с раствором электролита некоторое количество электролита перейдет в
- 22. Влияние электролитов на растворимость газов Закон Генри-Дальтона Количество газа, растворенного при
- 23. Закон Сеченова Растворимость газов в жидкостях в присутствии электролитов понижается; происходит
- 24. Физиологическое действие ионов Антагонизм Молибден и медь: увеличивая содержание Cu можно
- 25. Синергизм Медь и железо: при поступлении в организм Cu поглощается в
- 26. Скачать презентацию




















Слайды и текст этой презентации
Скачать презентацию на тему Теория растворов. Растворы электролитов можно ниже:
Похожие презентации





























