Теория сильных электролитов. Закон действующих масс и его применение к гетерогенным равновесиям презентация
Содержание
- 2. План 1. Теория сильных электролитов. 2. Закон действующих масс. Константа равновесия.
- 3. Теория сильных электролитов Дебая- Хюккеля
- 7. Для электролита Для электролита КnАm ↔ nКm+ + mАn-
- 8. Концентрационное произведение растворимости: Концентрационное произведение растворимости: ПРс = [Кm +]n ∙
- 15. Природа осадка: ПРPbSO4 = 1,6∙10-8 Природа осадка: ПРPbSO4 = 1,6∙10-8
- 18. Пример. Вычислите, во сколько раз растворимость сульфита кальция в чистой воде
- 19. ПР СaSO4(в воде) = 2,5· 10-5 ПР СaSO4(в воде) =
- 22. СaSO4↓ + Na2СО3 ↔ СaСО3↓ + Na2SO4 СaSO4↓ + Na2СО3 ↔
- 24. Скачать презентацию







![Концентрационное произведение растворимости:
Концентрационное произведение растворимости:
ПРс = [Кm +]n ∙ Концентрационное произведение растворимости:
Концентрационное произведение растворимости:
ПРс = [Кm +]n ∙](/documents_3/9017e1f8e4776c490e0d71f4d92a96d5/img7.jpg)





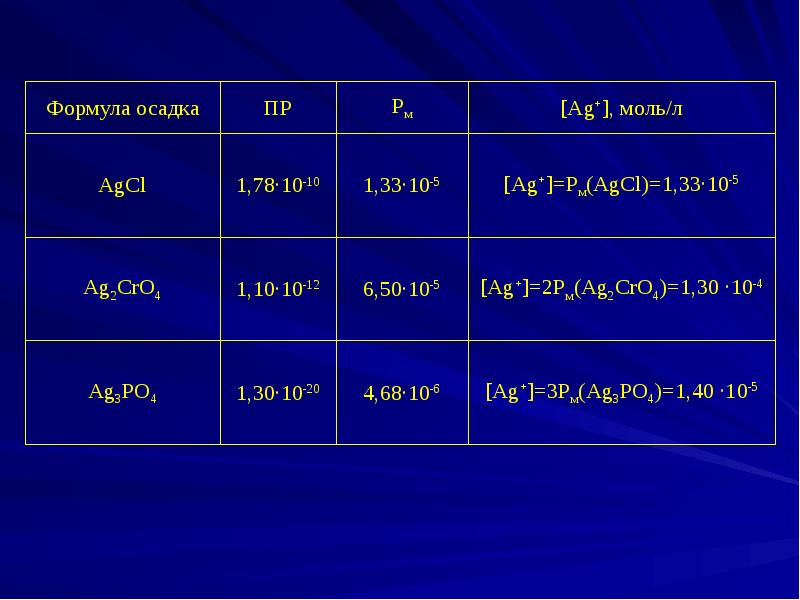









Слайды и текст этой презентации
Скачать презентацию на тему Теория сильных электролитов. Закон действующих масс и его применение к гетерогенным равновесиям можно ниже:
Похожие презентации





























