Термохимия. Закон Гесса и его следствия презентация
Содержание
- 2. 1. Основные понятия термохимии Термохимия - раздел физической химии изучающий
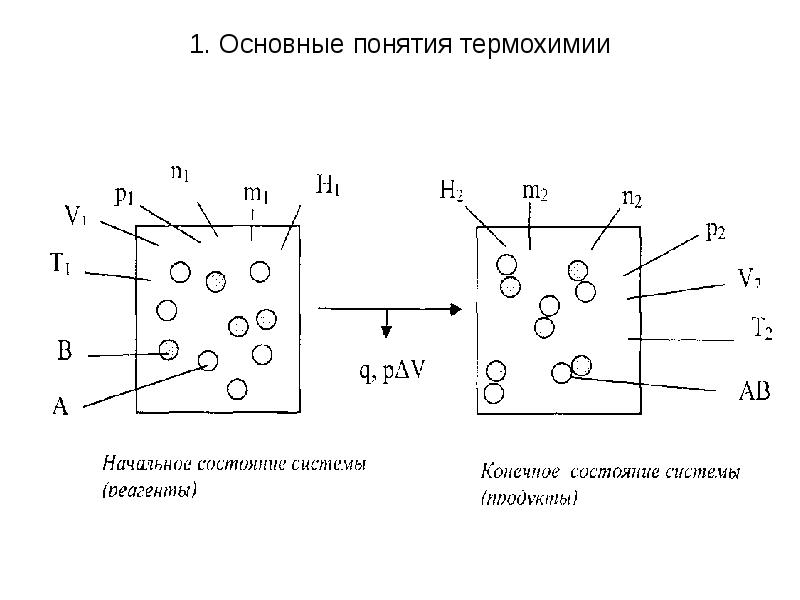
- 3. 1. Основные понятия термохимии Химическая реакция как термодинамический процесс, заключается
- 4. 1. Основные понятия термохимии
- 5. 1. Основные понятия термохимии Для физико-химических процессов действует закон сохранения
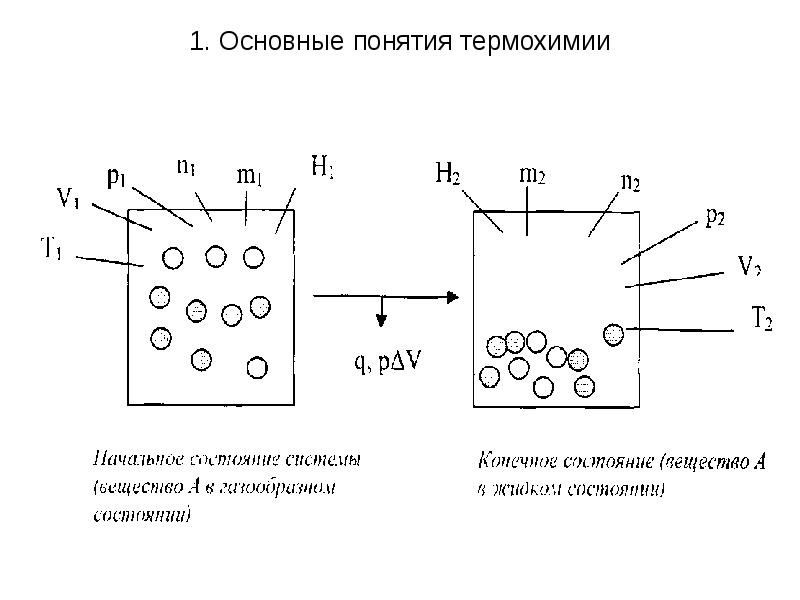
- 6. 1. Основные понятия термохимии Фазовый переход - переход вещества из
- 7. 1. Основные понятия термохимии
- 8. 1. Основные понятия термохимии Термохимия рассматривает процессы превращения частиц вещества:
- 9. 1. Основные понятия термохимии Тепловой эффект этих процессов позволяет определить
- 10. 1. Основные понятия термохимии Термохимическое уравнение - условное изображение физико-химического
- 11. 1. Основные понятия термохимии Тепловой эффект (Q, kДж/моль) - энергия,
- 12. 1. Основные понятия термохимии Стандартный тепловой эффект - теплота физико-химического
- 13. 1. Основные понятия термохимии К основным способам выражения тепловых эффектов физико-химических
- 14. 1. Основные понятия термохимии 2. Теплоту сгорания ΔНсгор - тепловой эффект
- 15. 1. Основные понятия термохимии 3. Теплоту нейтрализации ΔНнейт - тепловой эффект
- 16. 1. Основные понятия термохимии 4. Теплоту фазовых переходов ΔН°ф.п. - тепловой
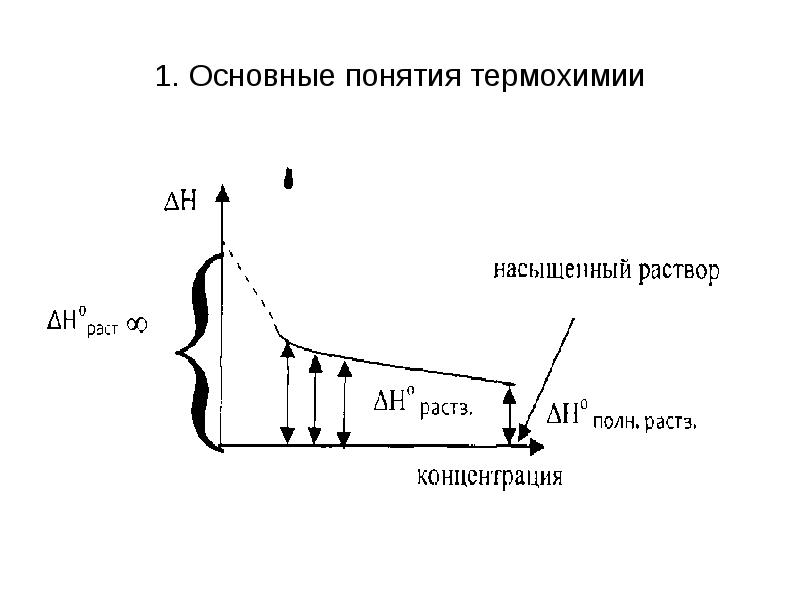
- 17. 1. Основные понятия термохимии 5. Теплоту растворения. Поскольку тепловой эффект при
- 18. 1. Основные понятия термохимии Предельная интегральная теплота растворения ΔН°раст ∞ -
- 19. 1. Основные понятия термохимии
- 20. 1. Основные понятия термохимии 6. Энергия связи - теплота, выделяющаяся в
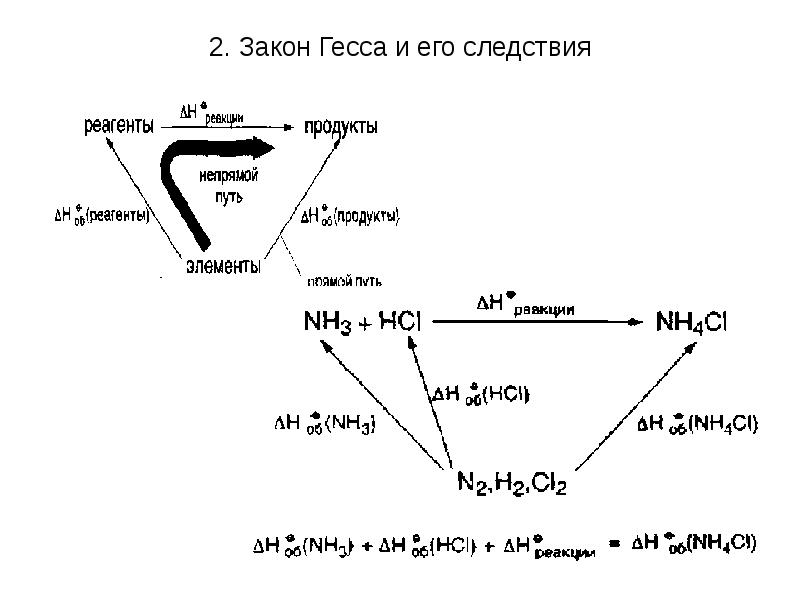
- 21. 2. Закон Гесса и его следствия В 1836 г. профессор Петербургского
- 22. 2. Закон Гесса и его следствия Закон Гесса позволяет обращаться с
- 23. 2. Закон Гесса и его следствия 1-е следствие закона Гесса: тепловой
- 24. 2. Закон Гесса и его следствия 2 -e следствие: тепловой эффект
- 25. 2. Закон Гесса и его следствия
- 26. 2. Закон Гесса и его следствия 3 - е следствие: тепловой
- 27. 2. Закон Гесса и его следствия 4 —е следствие: если совершаются
- 28. 2. Закон Гесса и его следствия 5 —е следствие: если совершаются
- 29. 3. Зависимость теплоты процесса от темп. З-н Кирхгоффа Все описанные выше
- 30. 3. Зависимость теплоты процесса от темп. З-н Кирхгоффа Тепловой эффект химической
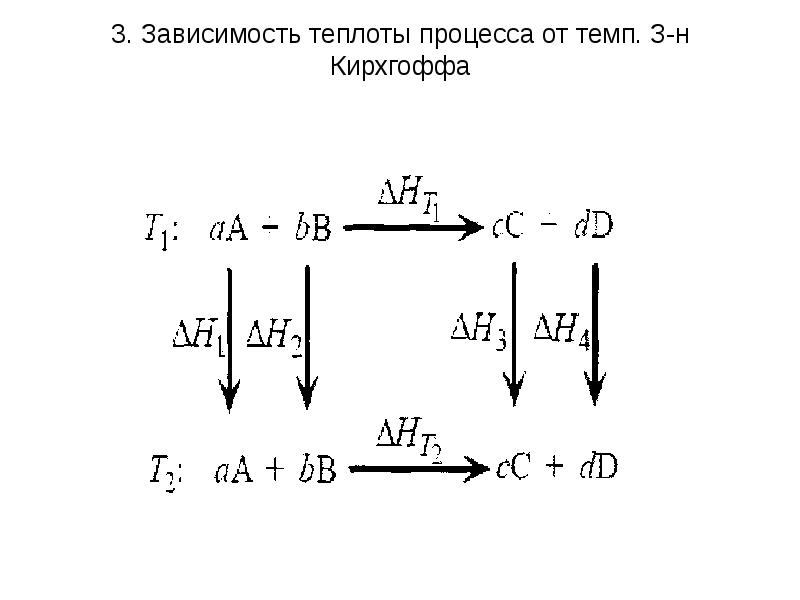
- 31. 3. Зависимость теплоты процесса от темп. З-н Кирхгоффа
- 32. 3. Зависимость теплоты процесса от темп. З-н Кирхгоффа Согласно этой схеме,
- 33. 3. Зависимость теплоты процесса от темп. З-н Кирхгоффа Согласно закону Гесса,
- 34. 3. Зависимость теплоты процесса от темп. З-н Кирхгоффа Полученное уравнение является
- 35. 3. Зависимость теплоты процесса от темп. З-н Кирхгоффа Интегральная форма уравнения
- 36. 3. Зависимость теплоты процесса от темп. З-н Кирхгоффа Аналогично, можно показать,
- 37. 3. Зависимость теплоты процесса от темп. З-н Кирхгоффа Уравнения Кирхгоффа в
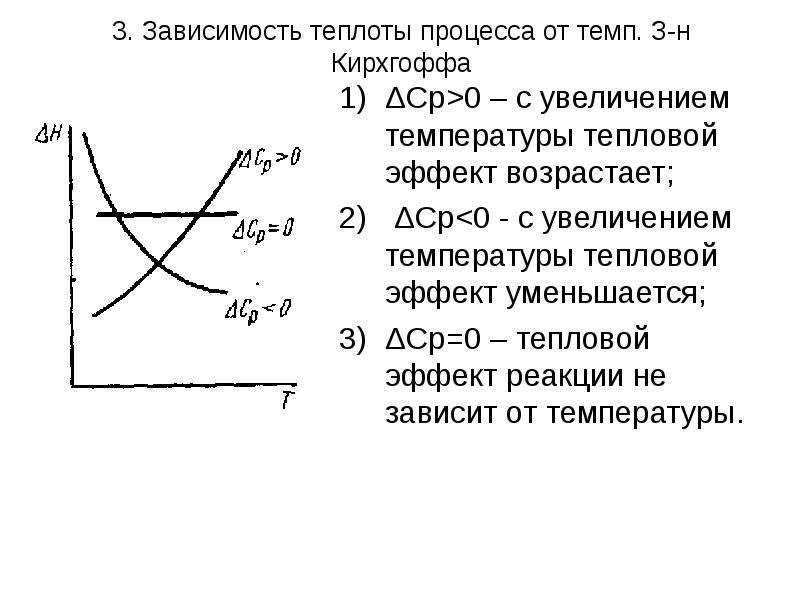
- 38. 3. Зависимость теплоты процесса от темп. З-н Кирхгоффа ΔСр>0 – с
- 39. Скачать презентацию
































Слайды и текст этой презентации
Скачать презентацию на тему Термохимия. Закон Гесса и его следствия можно ниже:
Похожие презентации





























