Титрування. Хімічний посуд в титриметричному аналізі презентация
Содержание
- 2. Титриметричний метод аналізу: суть, основні поняття та класифікація.
- 10. Знаючи масу (m) розчиненої у воді хімічно чистої речовини і об’єм
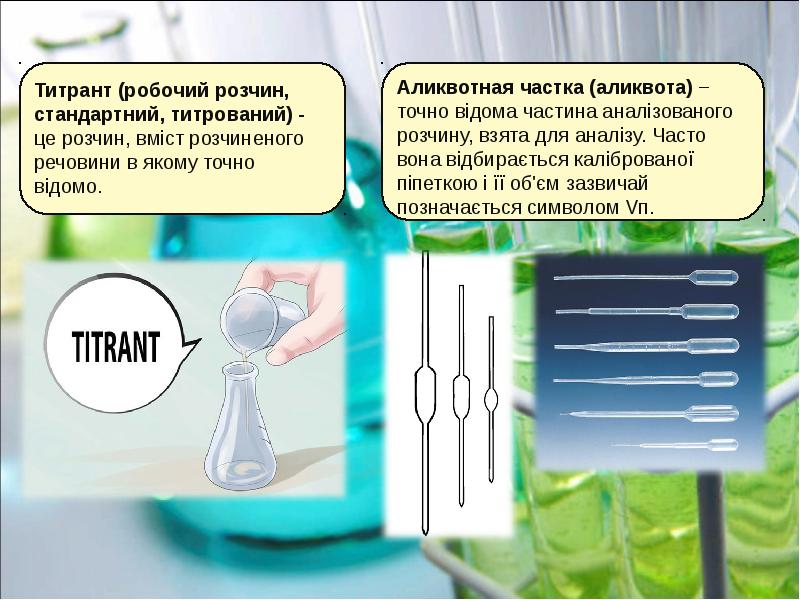
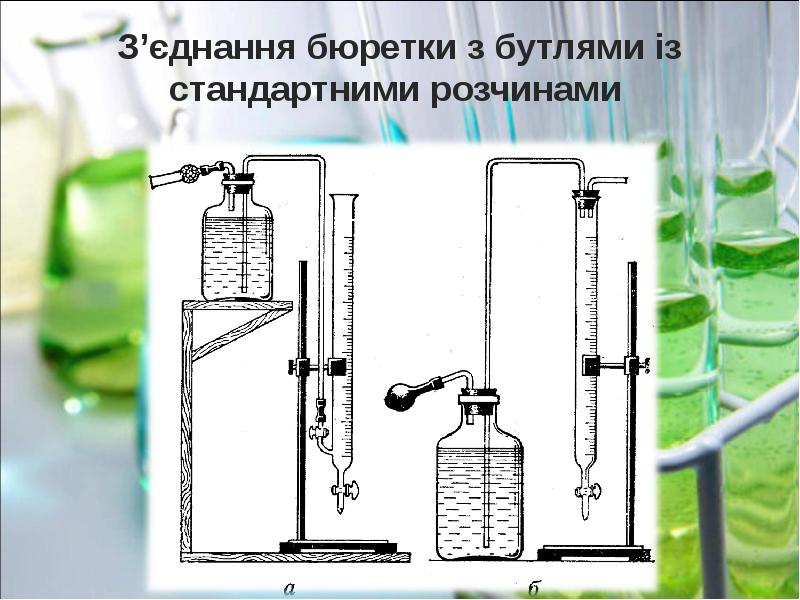
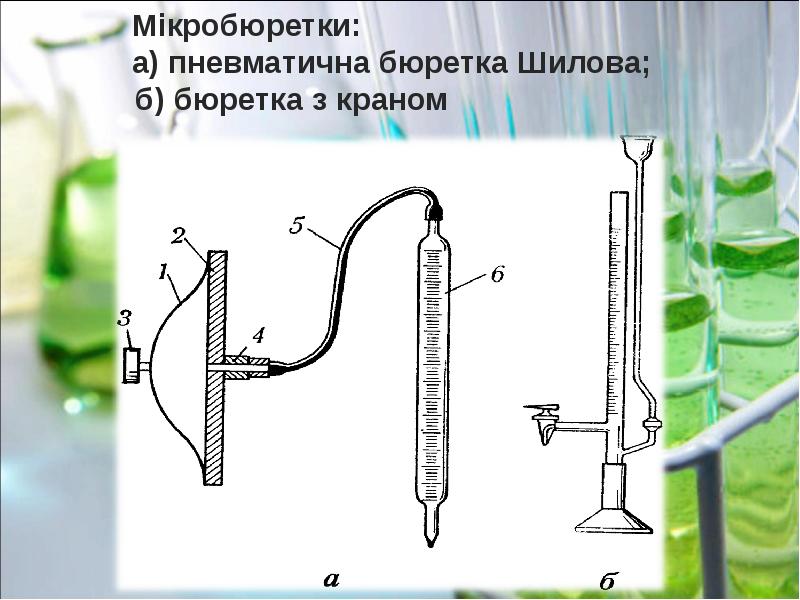
- 11. Готується розчин приблизно необхідної концентрації, точна його концентрація встановлюється. Готується
- 12. Залежно від типу реакції між титрантом і визначаємою речовиною методи титриметричного аналізу поділяють на: Залежно від
- 13. Вихідна речовина, яка застосовується для виготовлення стандартного розчину повинна бути хімічно
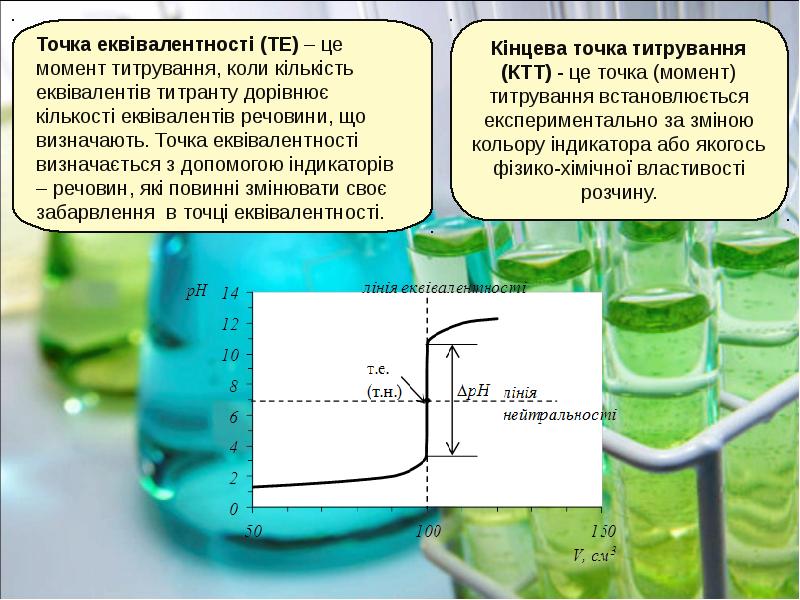
- 14. В основі усіх розрахунків у титриметричному аналізі лежить закон еквівалентів. В основі усіх
- 15. Еквівалент елемента простої чи складної речовини – це така його кількість, яка
- 18. Скачать презентацию













Слайды и текст этой презентации
Скачать презентацию на тему Титрування. Хімічний посуд в титриметричному аналізі можно ниже:
Похожие презентации





























