Важнейшие минералы презентация
Содержание
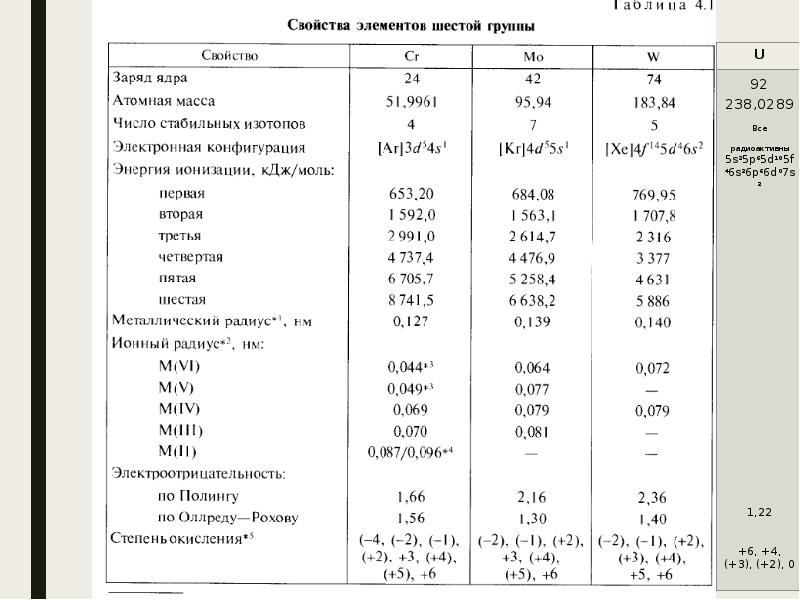
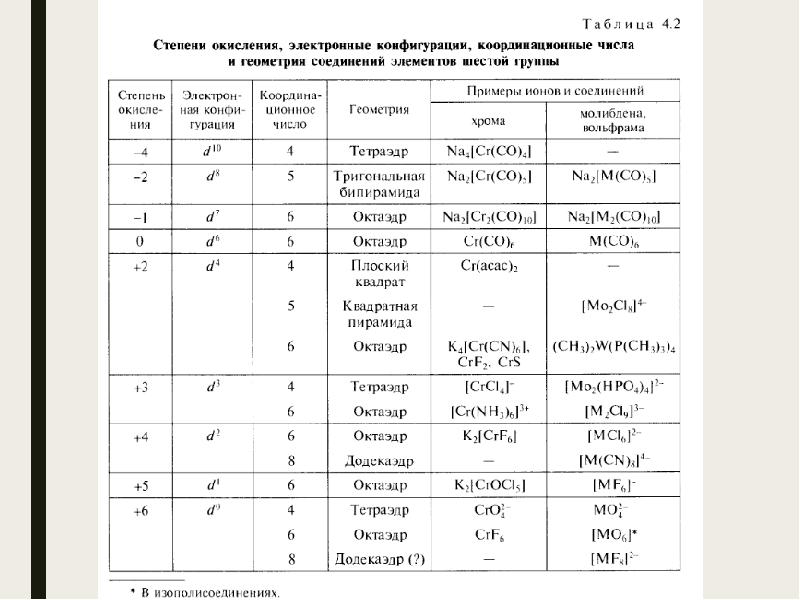
- 4. Важнейшие минералы Cr – хромистый железняк(FeCr2O4), крокоит(PbCrO4), хромовая охра(Cr2O3). Mo –
- 5. Получение Хром встречается в природе в основном в виде хромистого железняка
- 6. Затем образовавшийся Na2CrO4 обрабатывают серной кислотой или проводят реакцию в автоклавах
- 7. Получение вольфрама: Получение вольфрама:
- 8. Химические свойства Cr На воздухе пассивируется(!антикоррозийные свойства), не реагирует с амиаком,
- 9. Химические свойства W и Mo W и Mo химически очень инертны.
- 10. Химические свойства CrO3(хромовый ангидрид) Разлагается при 450оС Синтез : K2Cr2O7 +
- 11. Равновесие
- 12. Окислительная способность Сr6+ CrO3 поджигает спирт. Смесь 2 объемов K2Cr2O7(нас.) и
- 13. Cr2O3 !Наиболее устойчивая степень окисления. Амфотерный оксид. Может быть переведён окислителями
- 15. Cr(OH)3 Получение – действие на соли растворы солей Cr3+ раствором аммиака
- 17. Сложно получить индивидуально – 2Сr + O2 = 2CrO (в Hg)
- 18. Cr(OH)2 Желтый, сильный восстановитель в щелочной среде. Очень сложно получить чистым
- 19. Применение Хром — важный компонент во многих легированных сталях (в частности, нержавеющих), а также
- 20. Спасибо за внимание \O|O/
- 21. Скачать презентацию


















Слайды и текст этой презентации
Похожие презентации





























