Водные растворы в условиях промышленного производства и их стандартизация презентация
Содержание
- 2. ПЛАН ЛЕКЦИИ ПЛАН ЛЕКЦИИ Растворы. Определение. Технологический процесс производства Стандартизация
- 3. Растворы - это жидкие гомогенные системы, состоящие из растворителя и одного
- 4. Классификация растворов в зависимости от растворителей (примеры)
- 5. Классификация растворов по составу: 1. Растворы химически индивидуальных веществ - простые:
- 6. Классификация растворов по способу получения: 1. Растворением твердых, жидких или
- 7. Преимущества медицинских растворов 1. Быстрее всасываются и оказывают резорбтивное действие по
- 8. Недостатки медицинских растворов 1. Номенклатура ограничена, включает препараты массового производства.
- 9. Технологический процесс производства растворов состоит из следующих стадий: Технологический процесс
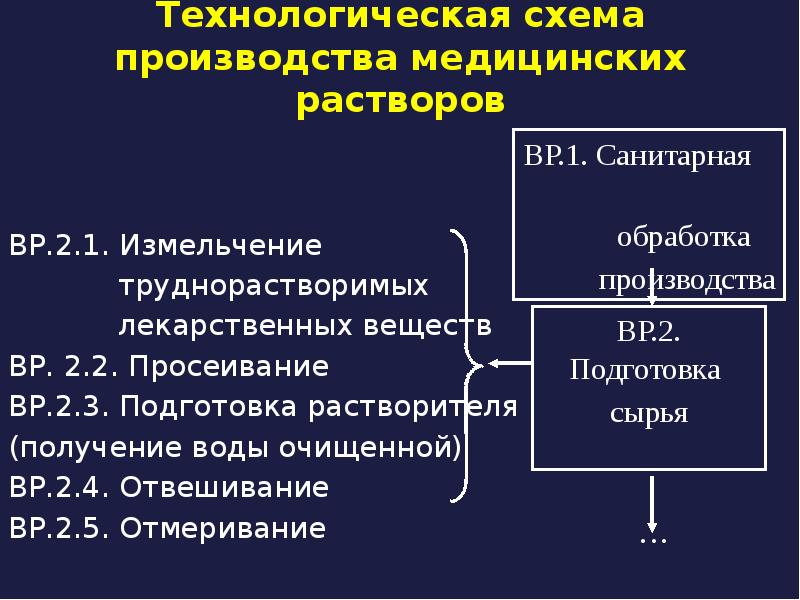
- 10. Технологическая схема производства медицинских растворов ВР.2.1. Измельчение
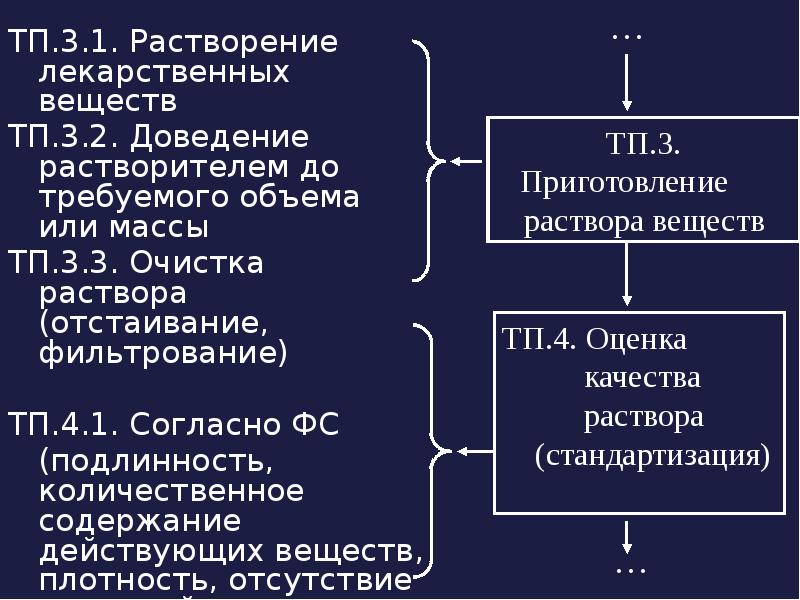
- 11. ТП.3.1. Растворение лекарственных веществ ТП.3.1. Растворение лекарственных веществ ТП.3.2. Доведение растворителем
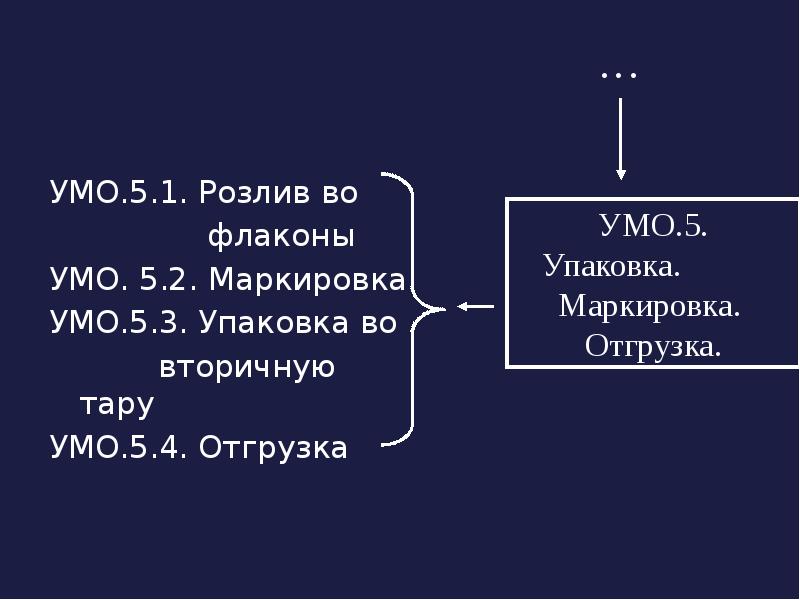
- 12. УМО.5.1. Розлив во УМО.5.1. Розлив во
- 13. 1. Подготовительная стадия Проводят расчеты в соответствии с НД. Подготавливают
- 14. 2. Растворение Растворение - это диффузионно-кинетический процесс, протекающий при соприкосновении растворяемого
- 15. Контактирование поверхности твердого тела с растворителем, сопровождающееся смачиванием, адсорбцией и проникновением
- 17. В крышке реактора имеется смотровое окно, люк для загрузки исходных веществ,
- 18. 3. Очистка растворов. 3. Очистка растворов. Разделение жидких гетерогенных
- 19. Отстаивание жидких гетерогенных систем - это разделение под действием сил тяжести.
- 20. Фильтрование - это процесс разделения неоднородных систем (взвесей) с помощью пористых
- 21. Виды фильтров: Виды фильтров: фильтры, работающие под давлением
- 22. Центрифугирование - это разделение гетерогенных систем под действием сил центробежного поля.
- 23. Стандартизацию медицинских растворов, т.е. количественное определение и доведение содержания действующих веществ
- 24. Стандартизация Определяют: органолептические показатели (цвет, характерный запах) прозрачность; подлинность; количественное
- 25. ОСТ 91500.05.001-00 Стандарты качества ЛС Растворы для внутреннего и наружного применения
- 26. 9. Посторонние примеси (родственные соединения) 9. Посторонние примеси (родственные соединения) 10.
- 27. 5. Фасовка и упаковка, хранение. 5. Фасовка и упаковка, хранение.
- 28. Водные фармацевтические растворы Примеры
- 29. Путем механического перемешивания получают водные растворы перекиси водорода, пергидроля, кальция хлорида,
- 30. Жидкость Бурова представляет собой раствор моноосновной уксусно-алюминиевой соли с плотностью 1,044-1,048.
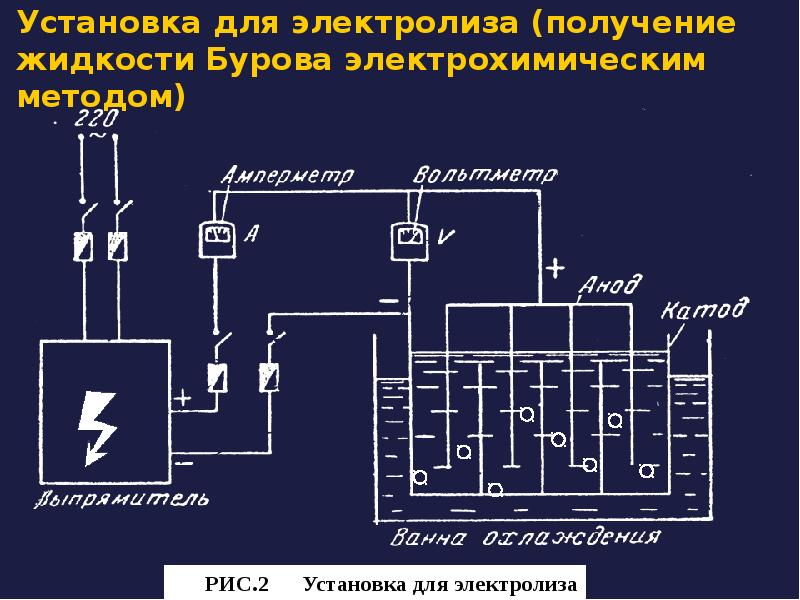
- 31. Сущность электрохимического способа получения жидкости Бурова заключается в анодном растворении алюминия
- 32. В околоанодном пространстве происходит образование гидрата окиси алюминия и взаимодействие его
- 33. Установка для электролиза (получение жидкости Бурова электрохимическим методом)
- 34. Технологический процесс состоит из 3 стадий Технологический процесс состоит из 3
- 35. Химический способ получения жидкости Бурова Квасцов алюмокалиевых……………………..46,5 г Кальция карбоната……………………………..14,5
- 36. Химический способ получения раствора основного ацетата алюминия Химический способ получения раствора
- 37. Схема получения жидкости Бурова
- 38. Технологический процесс приготовления раствора состоит из четырех стадий: Технологический процесс
- 39. К охлажденному прозрачному раствору квасцов при перемешивании прибавляют суспензию кальция карбоната.
- 40. Растворение осадка в кислоте уксусной Растворение осадка в кислоте уксусной
- 41. Раствор основного ацетата свинца (Solutio Plutnbi subacetatis) Раствор основного ацетата свинца
- 42. Химический способ получения свинцового уксуса (раствора свинца ацетата основного) ФС
- 43. Технологический процесс состоит из четырех стадий Технологический процесс состоит из четырех
- 44. Фильтрование. Фильтрование. Жидкость фильтруют сквозь складчатый фильтр в
- 45. Химический способ получения раствора свинца ацетата основного №2 Способ 2. Взаимодействие
- 46. В колбу с обратным холодильником помещают 10 г 80% кислоты уксусной,
- 48. В массо-объемной концентрации изготавливают: В массо-объемной концентрации изготавливают: Водные
- 49. В концентрации по массе изготавливают: В концентрации по массе изготавливают: Растворы
- 50. Стандартные растворы и их разбавление Стандартные фармакопейные растворы –
- 51. В массо-объемной концентрации изготавливают: В массо-объемной концентрации изготавливают: Разведения
- 52. Кислота хлористоводородная Кислота хлористоводородная концентрированная Acidum hydrochloricum
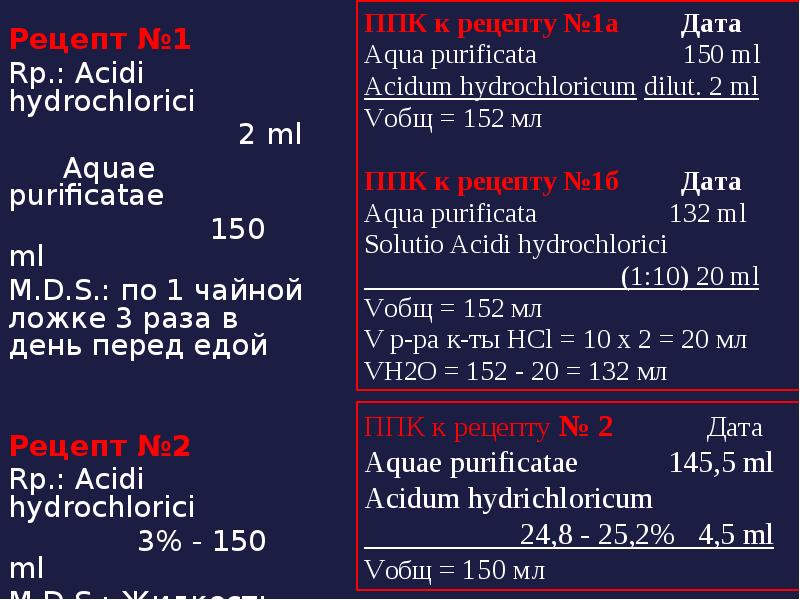
- 53. Рецепт №1 Рецепт №1 Rp.: Acidi hydrochlorici
- 54. Проверка доз рец. №1 Vобщ (общий объем микстуры) = сумме объемов
- 55. Растворы аммиака и к-ты уксусной Раствор аммиака Solutio Ammonii
- 56. Рецепт №3 Рецепт №3 Rp.: Solutionis Ammonii caustici 1%-200ml
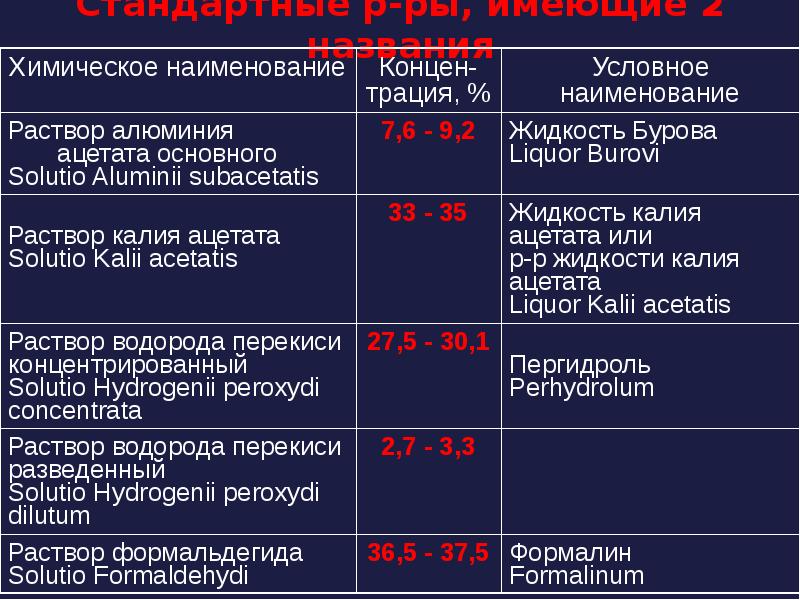
- 57. Стандартные р-ры, имеющие 2 названия
- 58. Основные правила Если растворы ЛВ выписаны под химическим названием (см. табл.),
- 59. РАСТВОРЫ ПЕРЕКИСИ ВОДОРОДА (дозируют по массе, всегда m-V концентрация) Под химическим
- 60. Под условным названием Концентрация не указана: 6. Rр.: Sol.
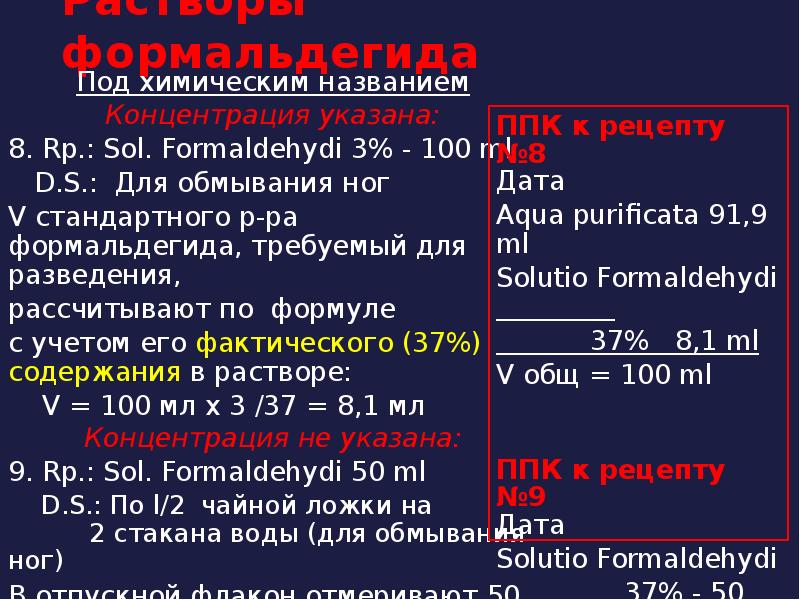
- 61. Растворы формальдегида Под химическим названием Концентрация указана: 8. Rp.: Sol. Formaldehydi
- 62. Растворы формальдегида Под условным названием 10. Rp.: Sol. Formalini 3%
- 63. Благодарю за внимание!
- 64. Скачать презентацию
























































Слайды и текст этой презентации
Скачать презентацию на тему Водные растворы в условиях промышленного производства и их стандартизация можно ниже:
Похожие презентации