Второй закон термодинамики. Энтропия. (Лекция 3) презентация
Содержание
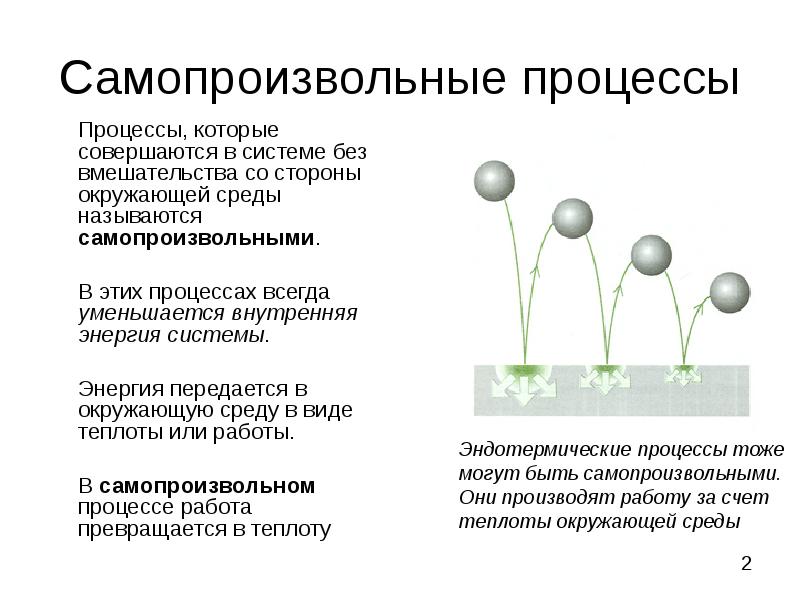
- 2. Самопроизвольные процессы Процессы, которые совершаются в системе без вмешательства со стороны
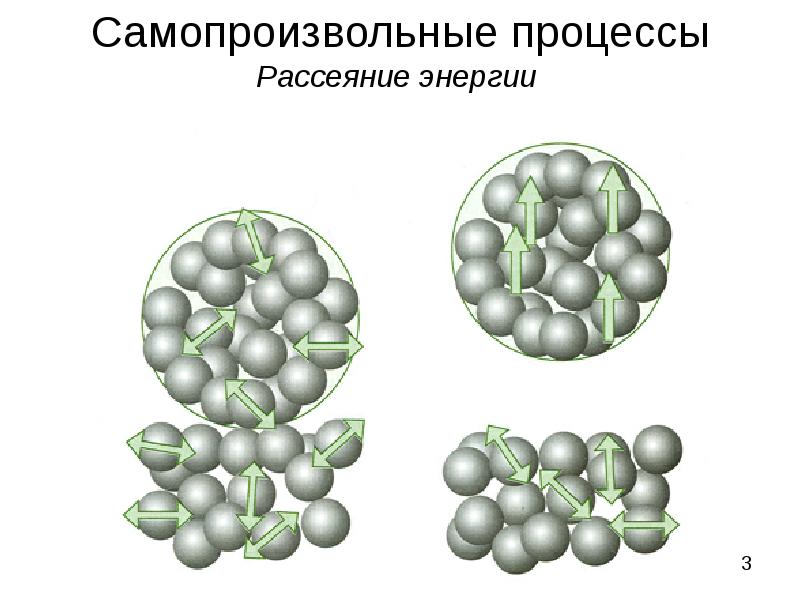
- 3. Самопроизвольные процессы Рассеяние энергии
- 4. Второй закон термодинамики
- 5. Несамопроизвольные процессы Процессы, которые не могут совершаться в системе без вмешательства
- 6. Обратимые процессы Если после протекания процесса систему и окружающую среду можно
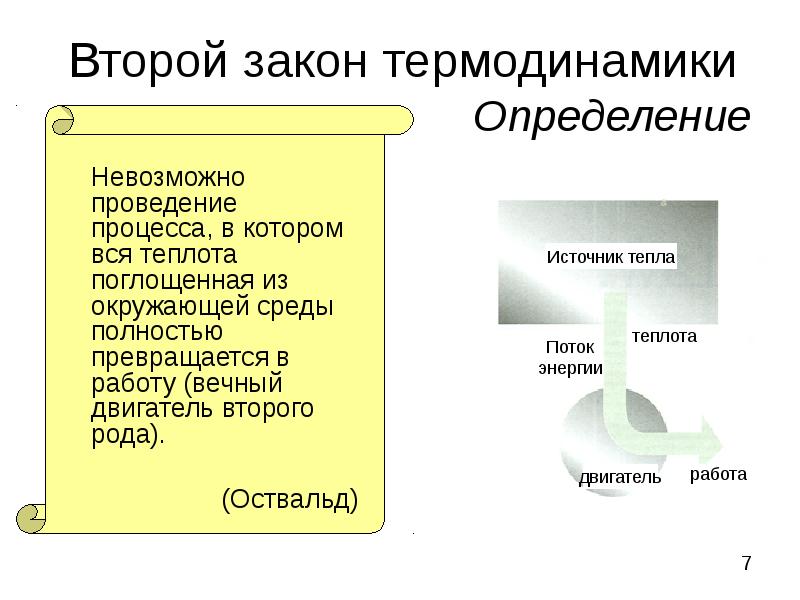
- 7. Второй закон термодинамики Определение Невозможно проведение процесса, в котором вся теплота
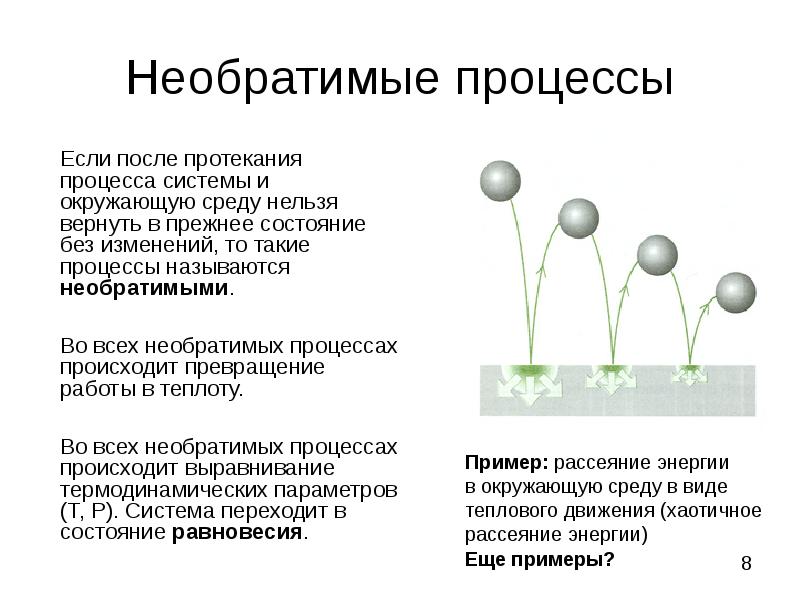
- 8. Необратимые процессы Если после протекания процесса системы и окружающую среду нельзя
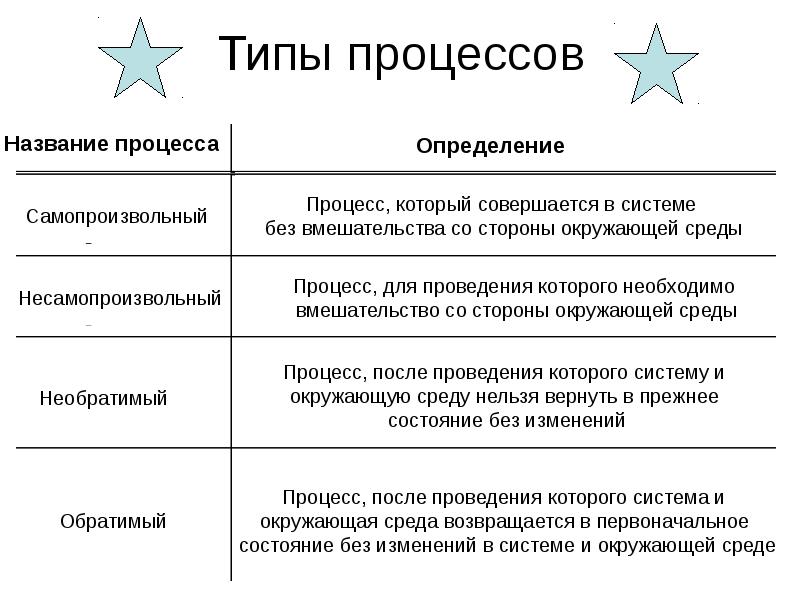
- 9. Типы процессов
- 10. Принцип Каратеодори Для прямого процесса: Q=U + W1 Для обратного процесса:
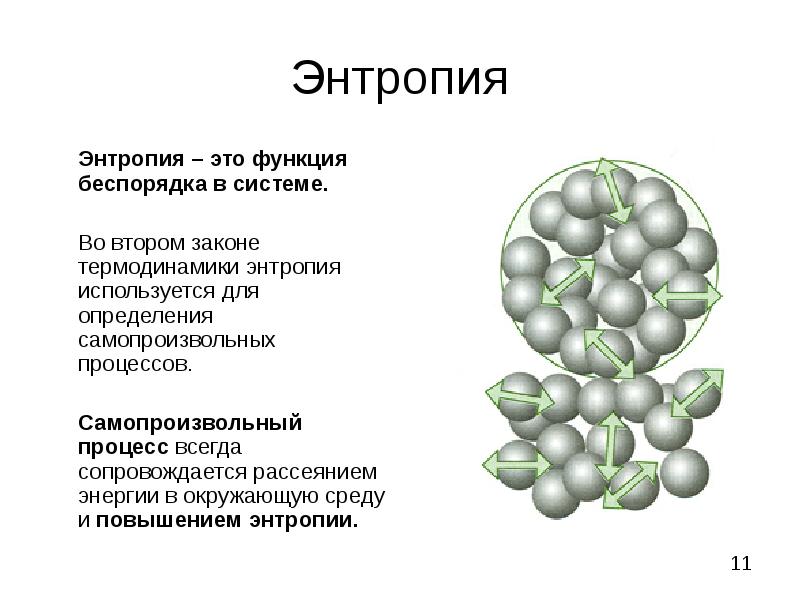
- 11. Энтропия Энтропия – это функция беспорядка в системе. Во втором
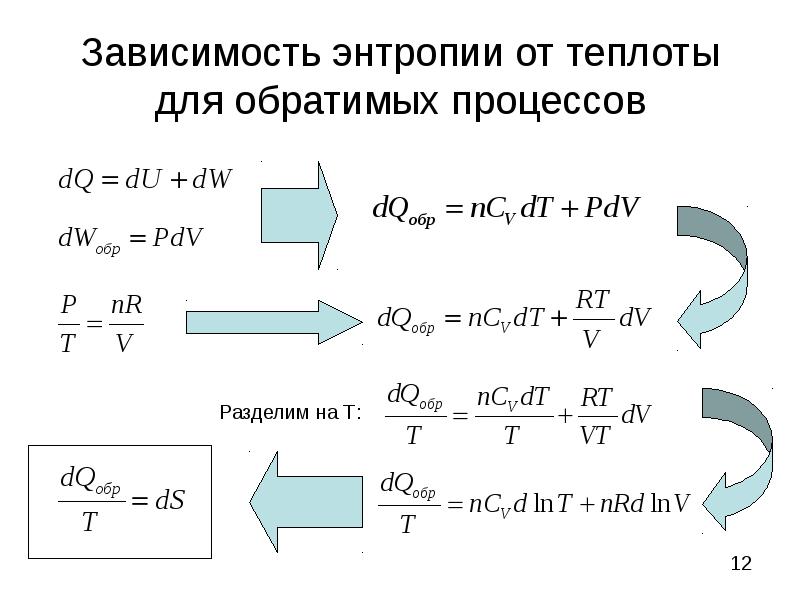
- 12. Зависимость энтропии от теплоты для обратимых процессов
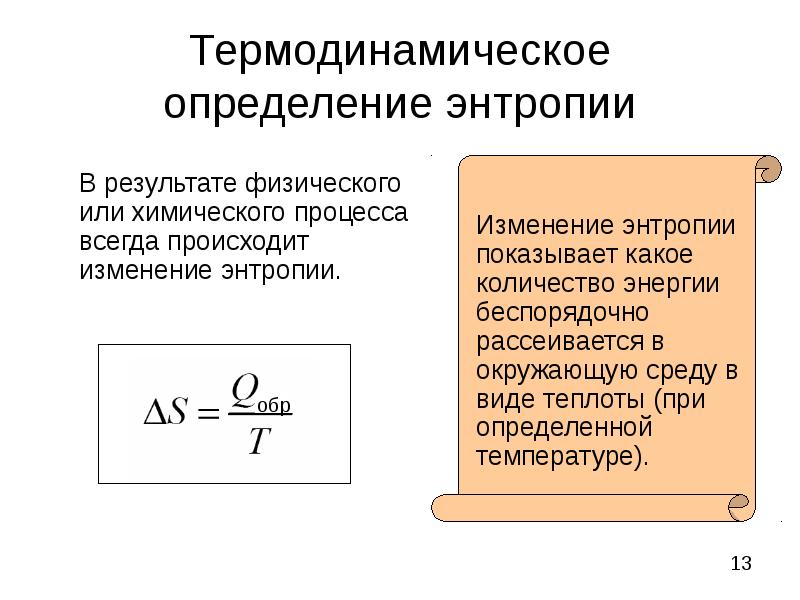
- 13. Термодинамическое определение энтропии В результате физического или химического процесса всегда происходит
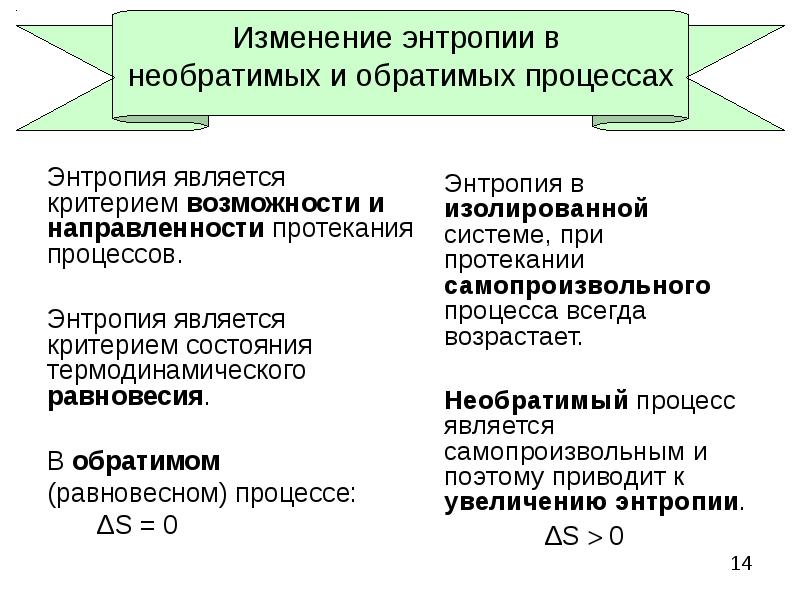
- 14. Изменение энтропии в необратимых и обратимых процессах Энтропия является критерием возможности
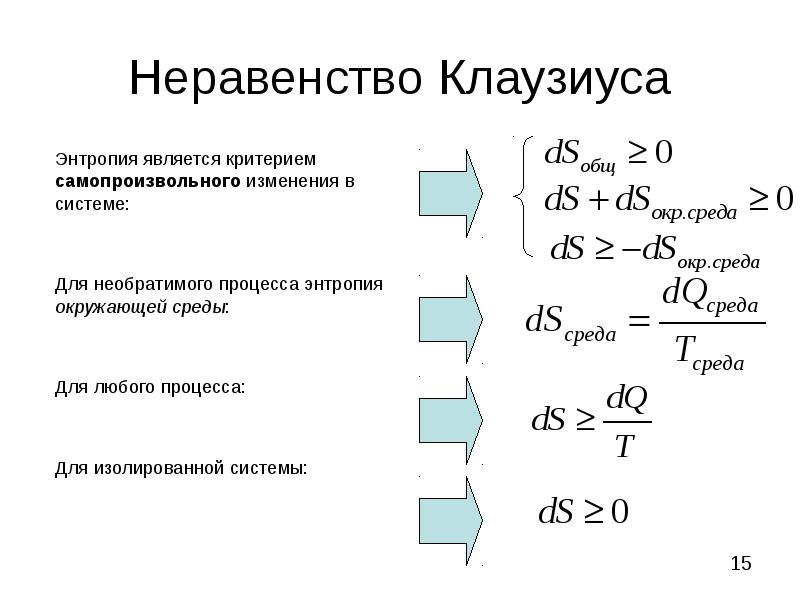
- 15. Неравенство Клаузиуса Энтропия является критерием самопроизвольного изменения в системе:
- 16. Применение неравенства Клаузиуса Пример 1. Неравновесный адиабатический процесс Для любого типа
- 17. Применение неравенства Клаузиуса Пример 2. Необратимый изотермический процесс (Т = const)
- 18. Применение неравенства Клаузиуса Пример 3. Необратимое охлаждение источник энергии: холодильник:
- 19. Второй закон термодинамики Определение Невозможно проведение процесса, в котором теплота передается
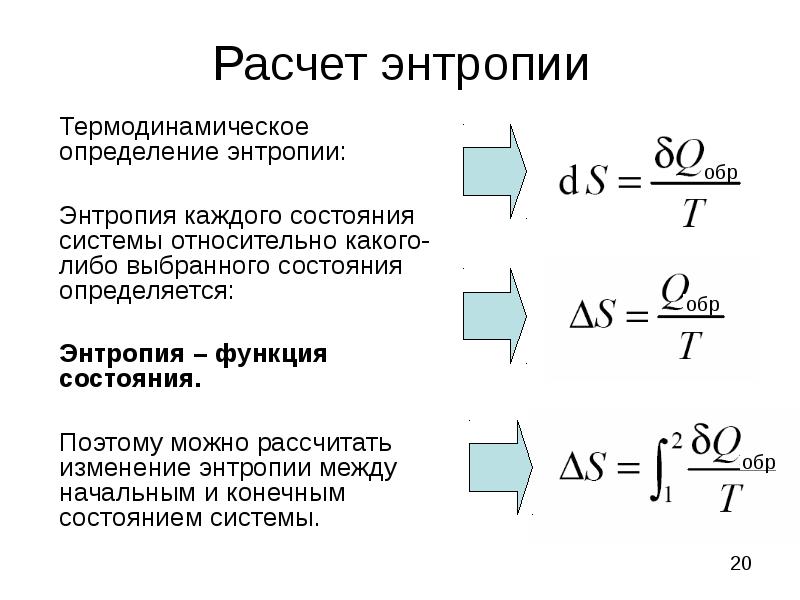
- 20. Расчет энтропии Термодинамическое определение энтропии: Энтропия каждого состояния системы относительно какого-либо
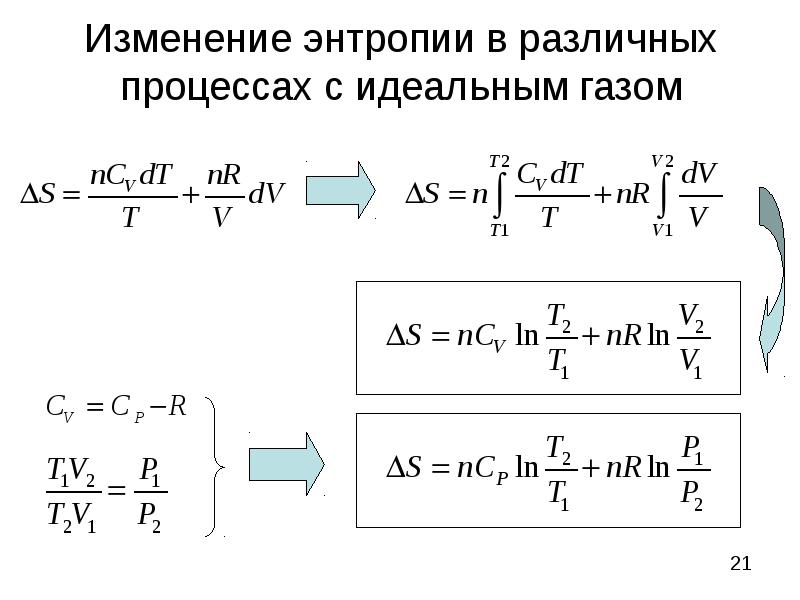
- 21. Изменение энтропии в различных процессах с идеальным газом
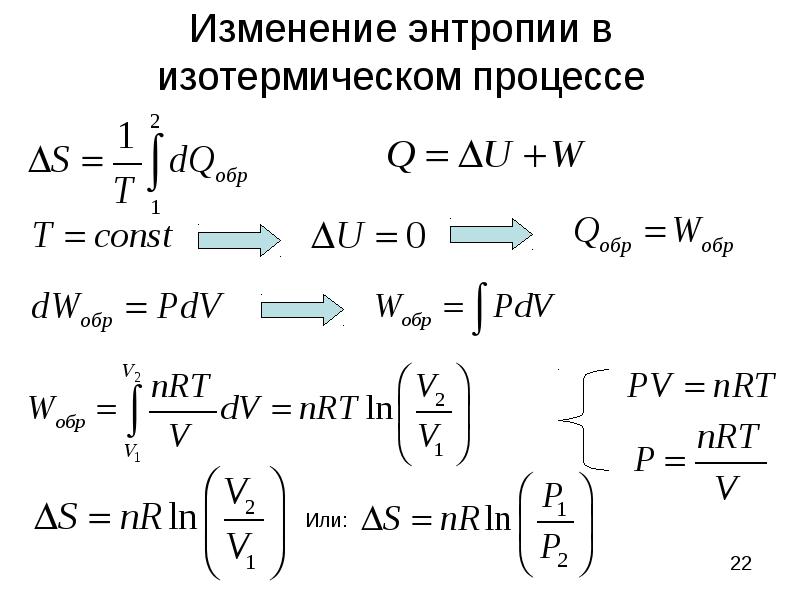
- 22. Изменение энтропии в изотермическом процессе
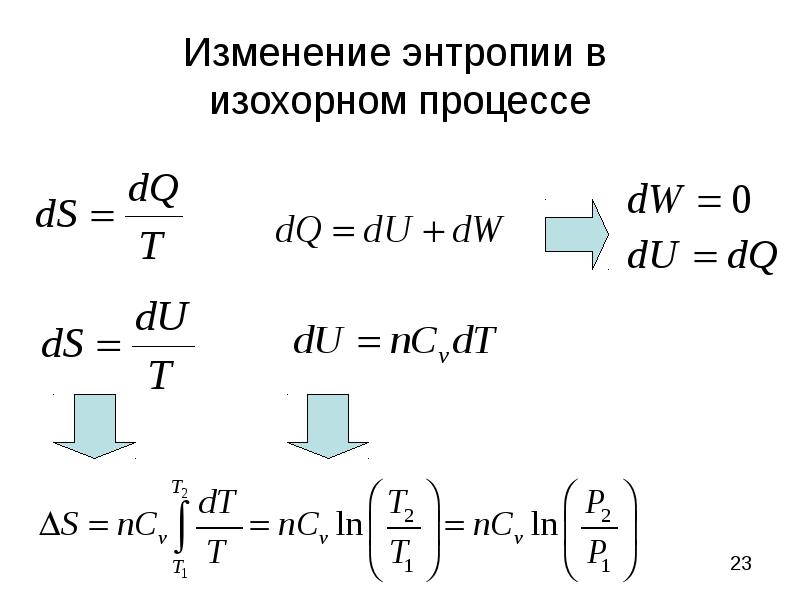
- 23. Изменение энтропии в изохорном процессе
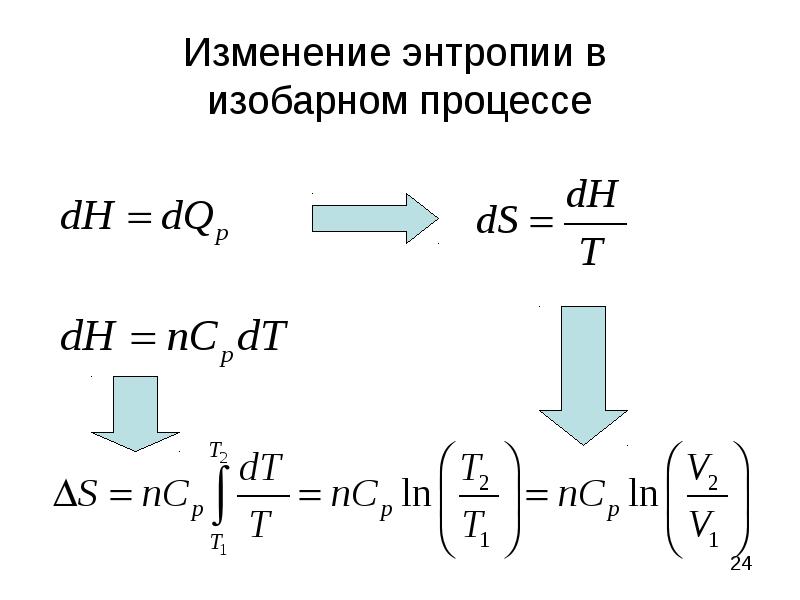
- 24. Изменение энтропии в изобарном процессе
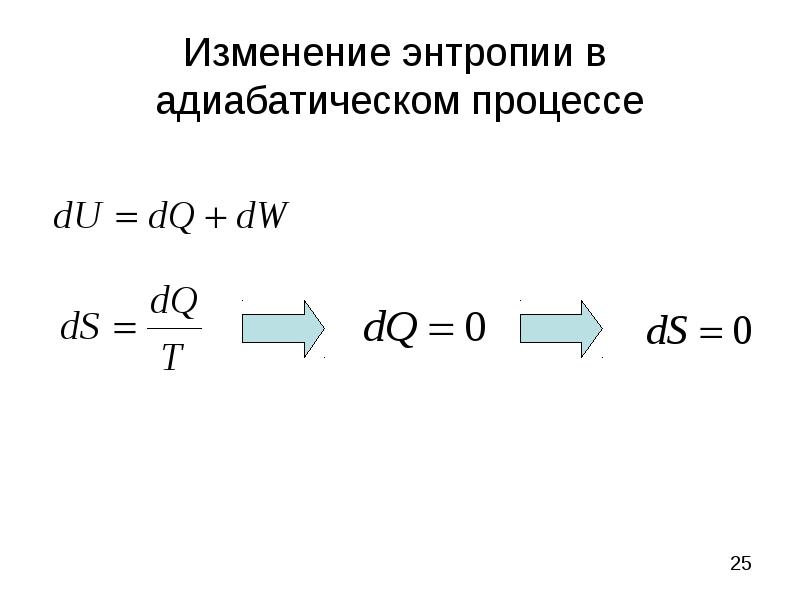
- 25. Изменение энтропии в адиабатическом процессе
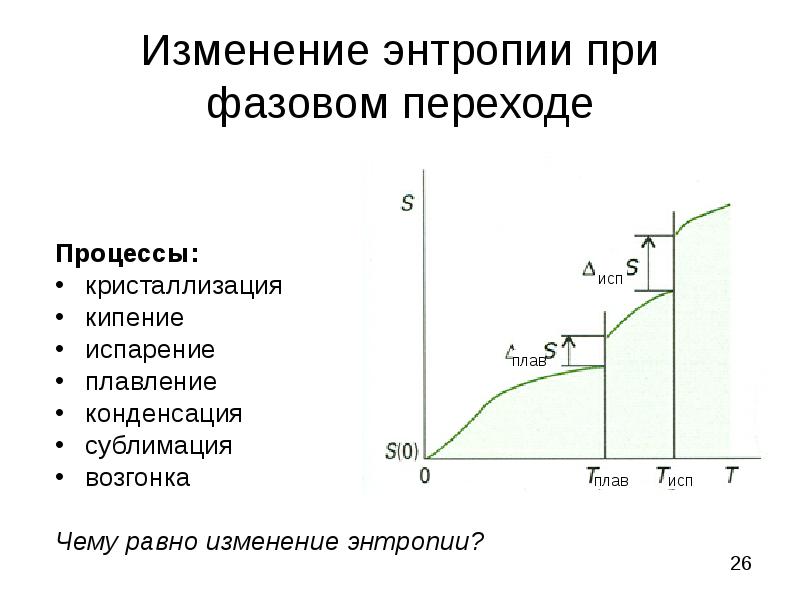
- 26. Изменение энтропии при фазовом переходе Процессы: кристаллизация кипение испарение плавление
- 27. Правило Трутона При постоянном давлении: Изменение молярной энтропии:
- 28. Второй закон термодинамики Зависимость энтропии от температуры Изменение энтропии
- 29. Зависимость энтропии от температуры
- 30. Зависимость энтропии от температуры
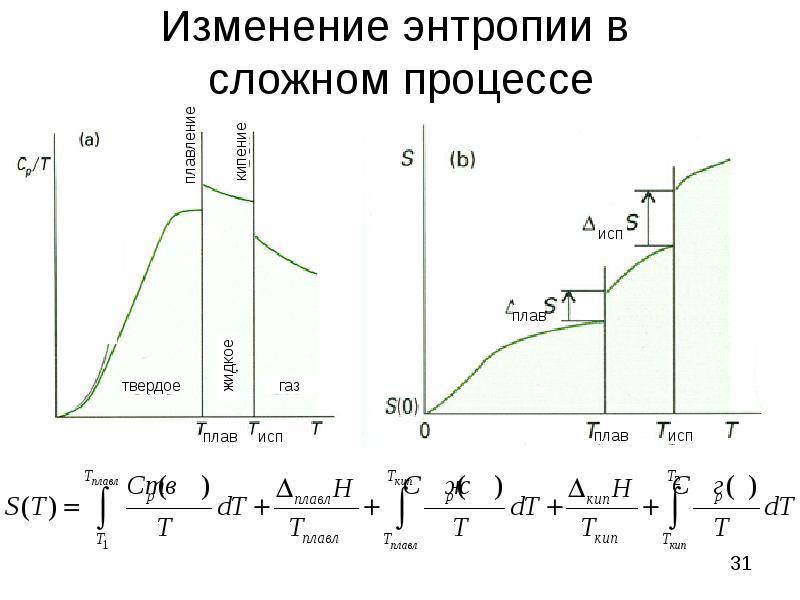
- 31. Изменение энтропии в сложном процессе
- 32. Изменение энтропии при диффузии газов
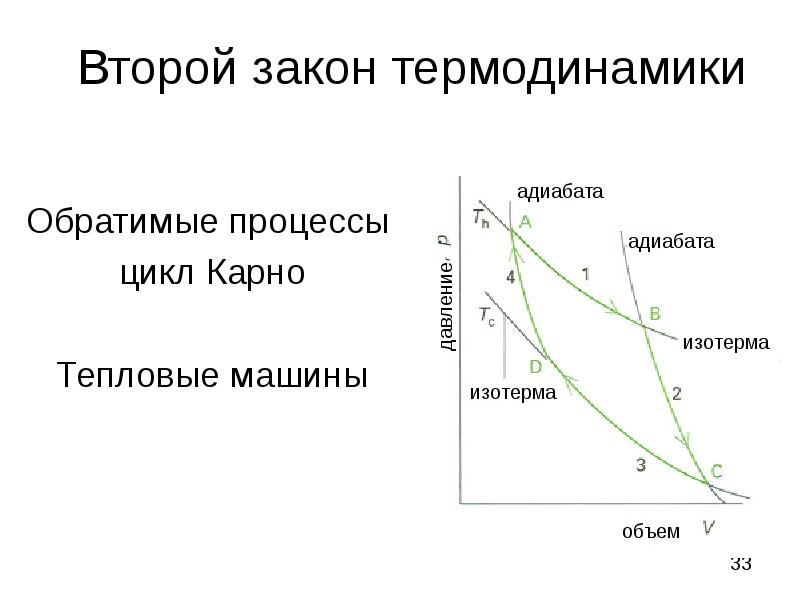
- 33. Второй закон термодинамики Обратимые процессы: цикл Карно Тепловые машины
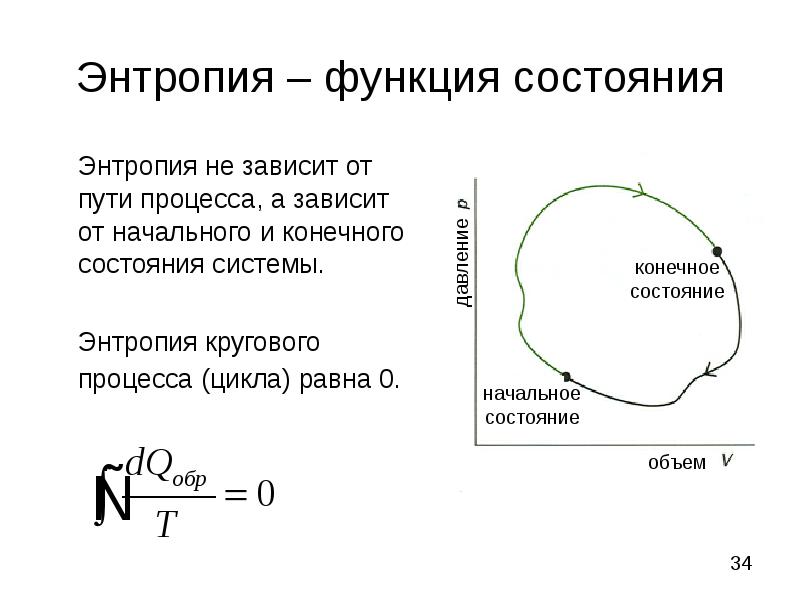
- 34. Энтропия – функция состояния Энтропия не зависит от пути процесса, а
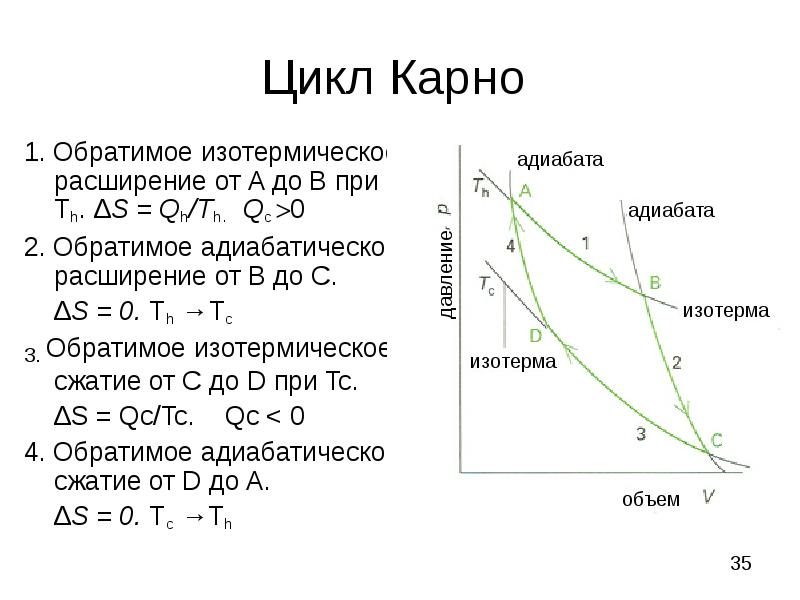
- 35. Цикл Карно 1. Обратимое изотермическое расширение от A до B
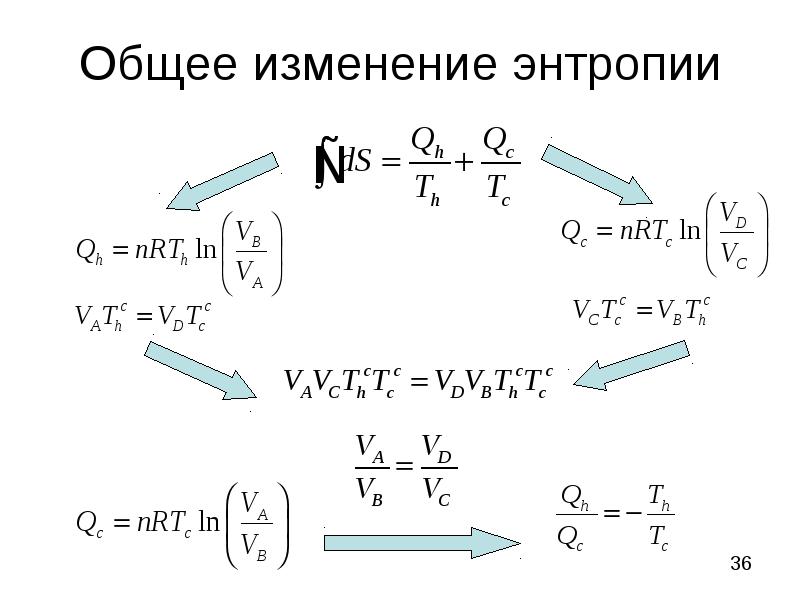
- 36. Общее изменение энтропии
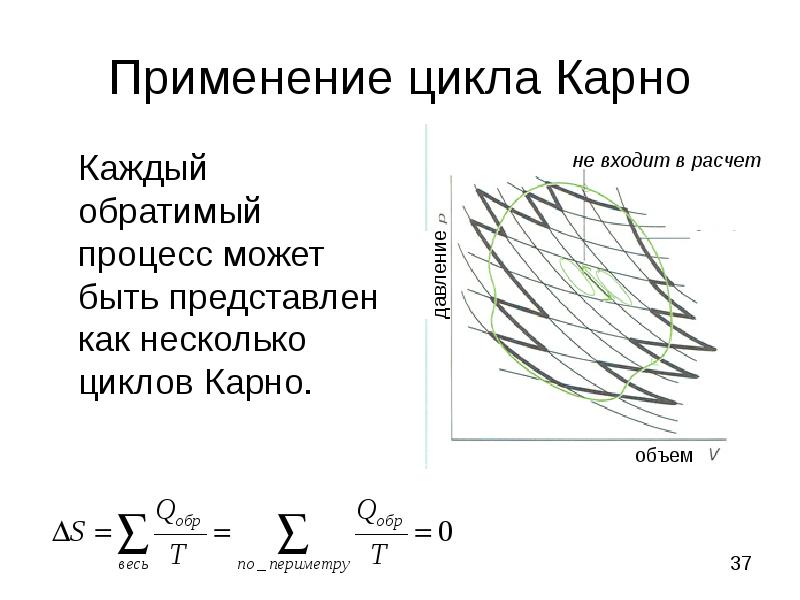
- 37. Применение цикла Карно Каждый обратимый процесс может быть представлен как несколько
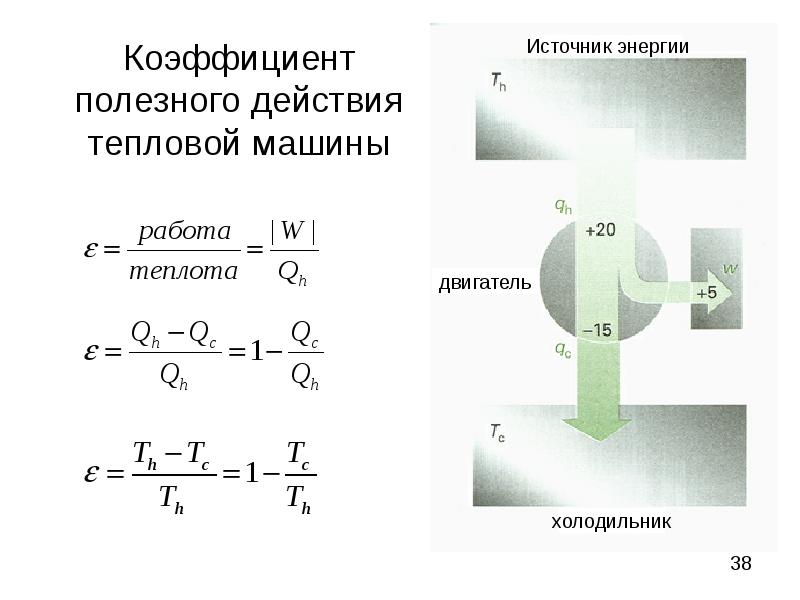
- 38. Коэффициент полезного действия тепловой машины
- 39. Теорема Нернста Изменение энтропии при любом физическом или химическом процессе стремится
- 40. Третий закон термодинамики Если энтропию каждого элемента в его наиболее
- 41. Энтропия химической реакции Стандартная энтропия химической реакции ΔS° - это
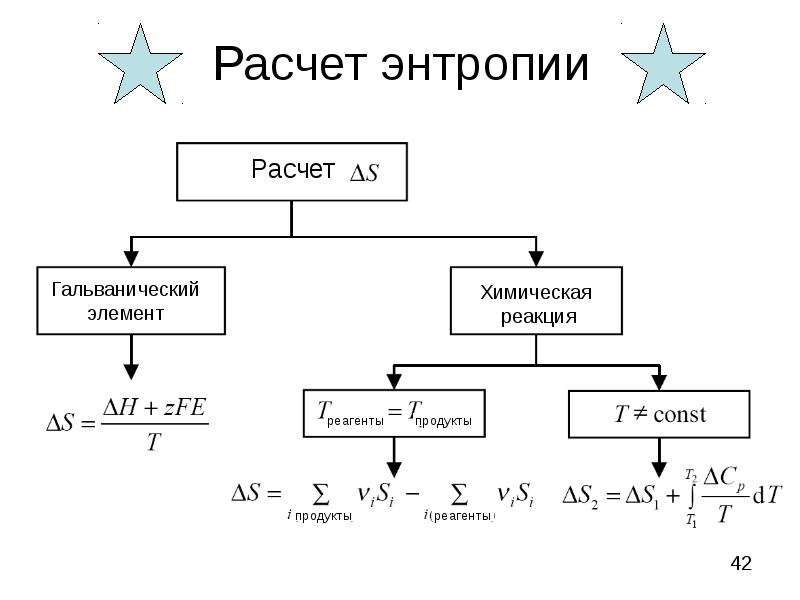
- 42. Расчет энтропии
- 43. Критерий самопроизвольного процесса В изолированной системе при постоянном объеме и постоянной
- 44. Критерий самопроизвольного процесса Энтропия системы при постоянном давлении и при постоянной
- 45. Скачать презентацию















Слайды и текст этой презентации
Скачать презентацию на тему Второй закон термодинамики. Энтропия. (Лекция 3) можно ниже:
Похожие презентации





























