Введение в квантовую физику презентация
Содержание
- 2. Вопросы к зачету Основные этапы развития квантовой теории. Главные тенденции в
- 3. Учебно-методическое и информационное обеспечение дисциплины а) базовый учебник (выделить жирным
- 4. Раздел 1. Введение в квантовую химию Объект изучения и возможности
- 5. Одной из наиболее актуальных проблем раннего развития физики и химии было
- 6. Объяснение интерференции Юнгом – сфокусированный в диафрагме на две щели пучок
- 7. И концу 19 века корпускулярная теория была отметена и признана волновая
- 26. Рассчитанные кривые по формулам Вина и Рэлея – Джинса описывали лишь
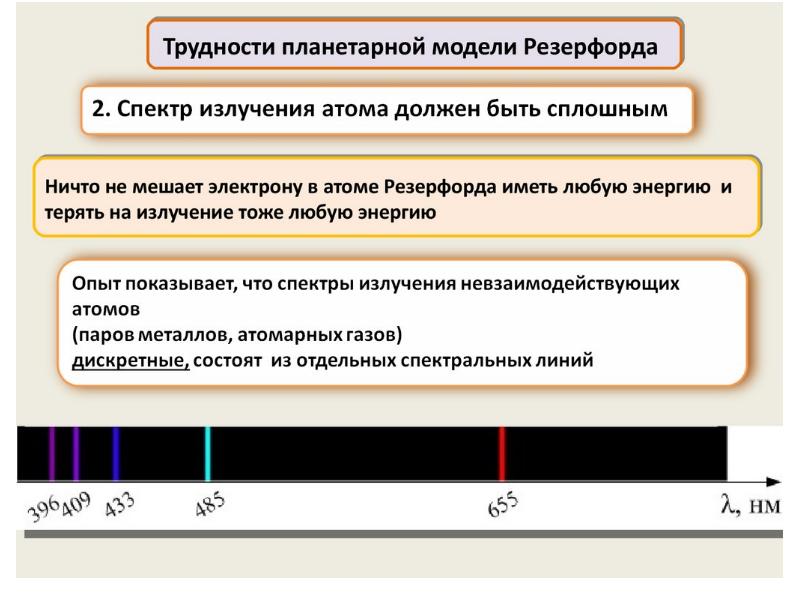
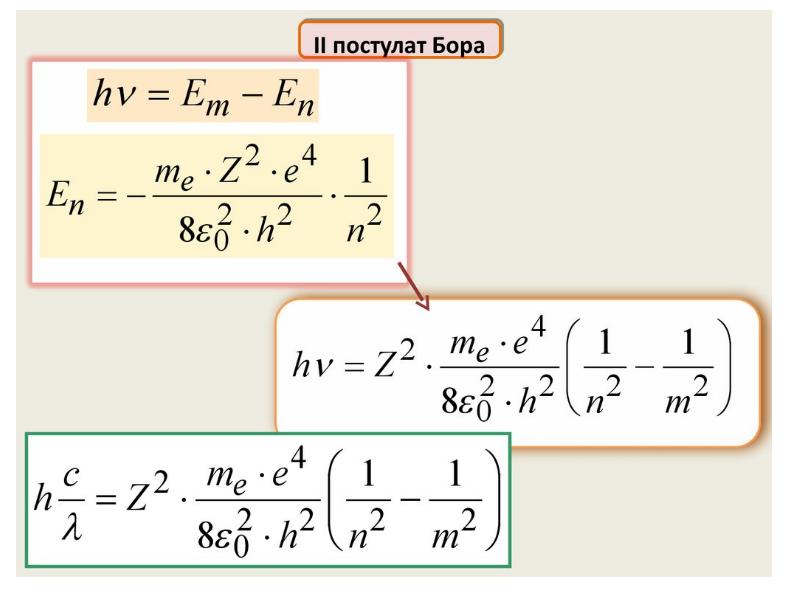
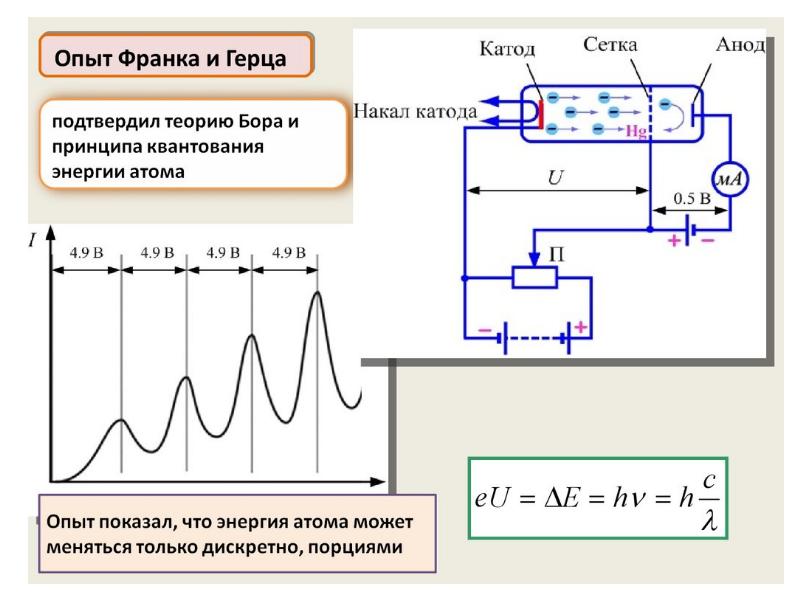
- 31. Излучение может происходить лишь тогда, когда система переходит из одного состояния
- 51. Длину волны такой частицы называют длиной волны де Бройля. Для любой
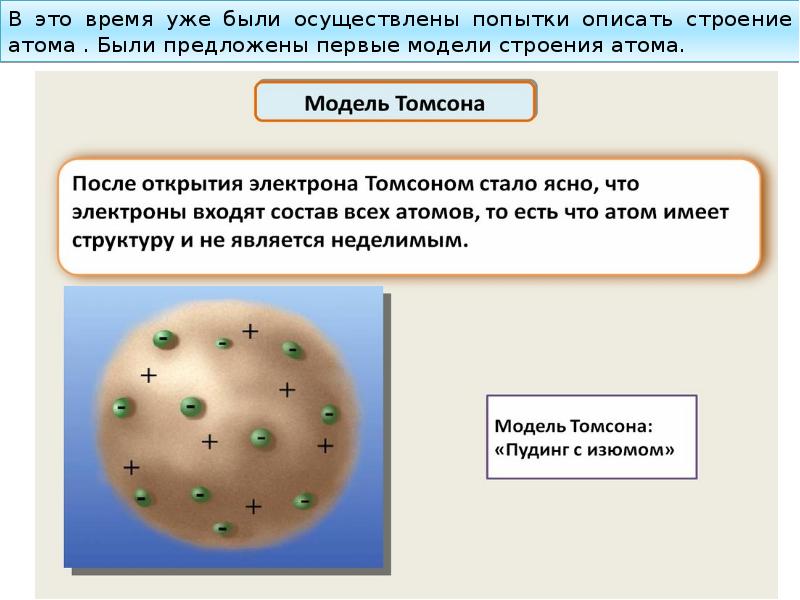
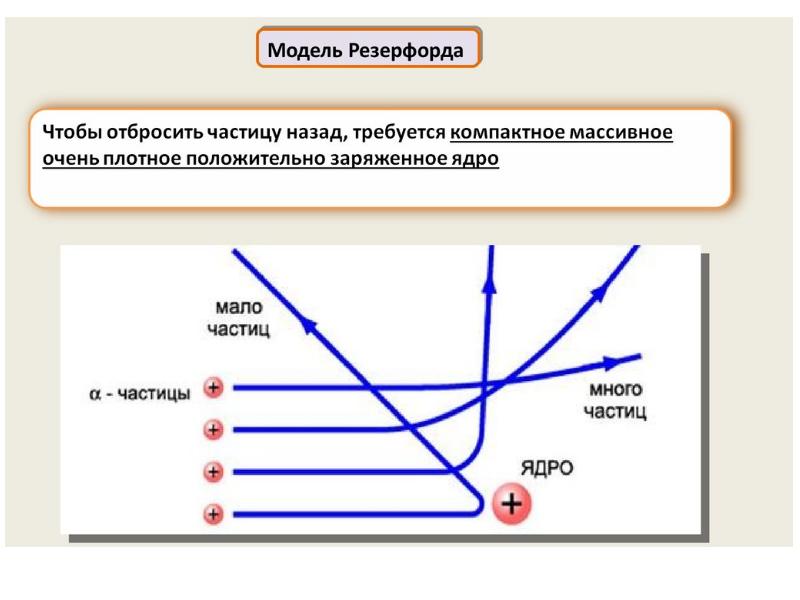
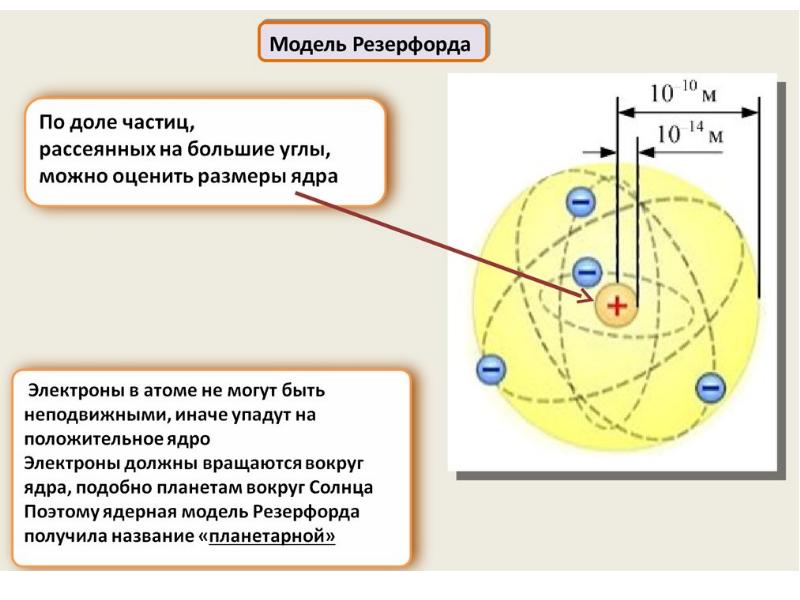
- 52. В это время уже были осуществлены попытки описать строение атома .
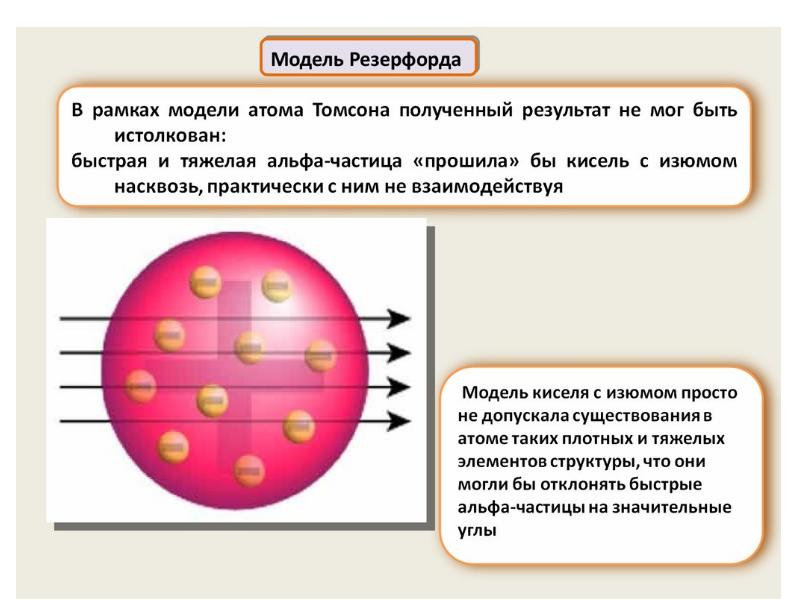
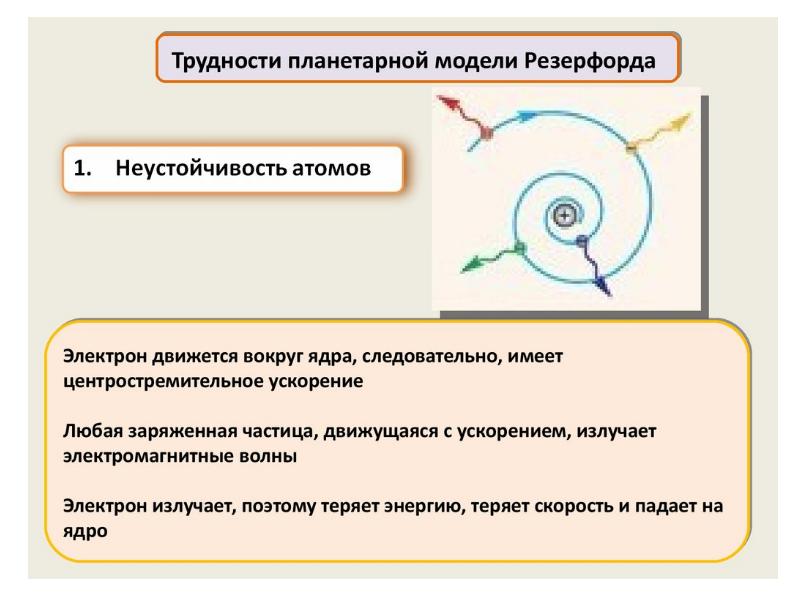
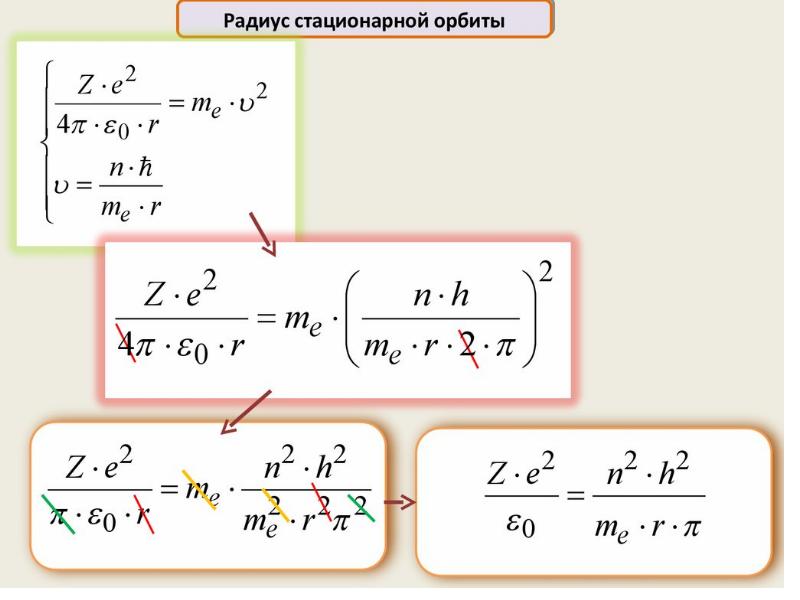
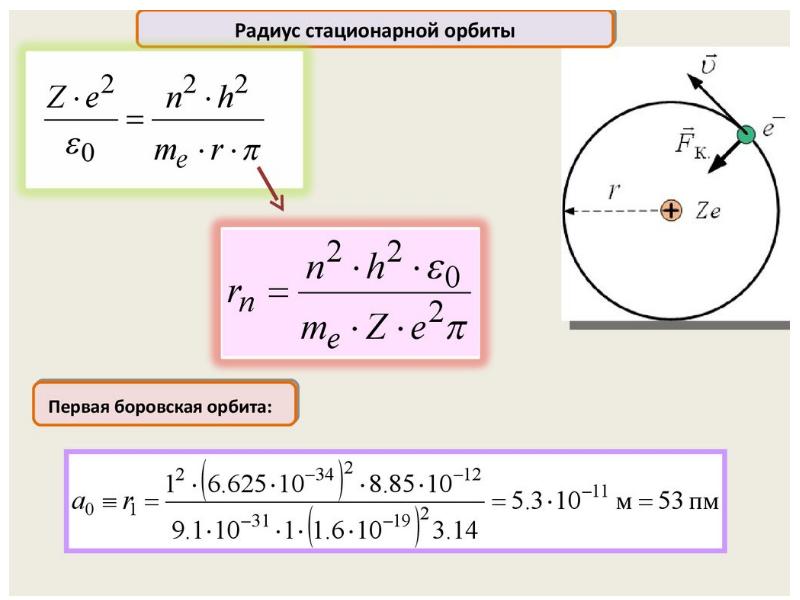
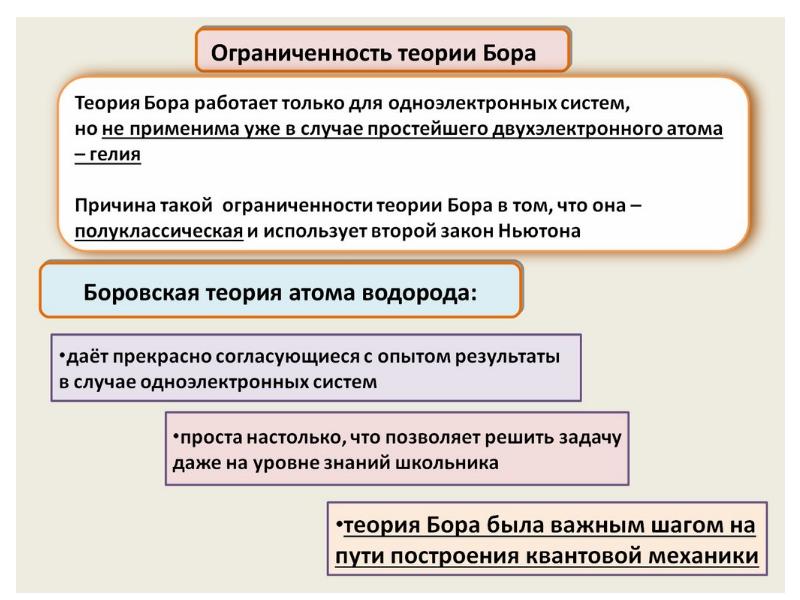
- 62. Нильс Бор ввел элементы квантовой теории в модель атома Резерфорда и
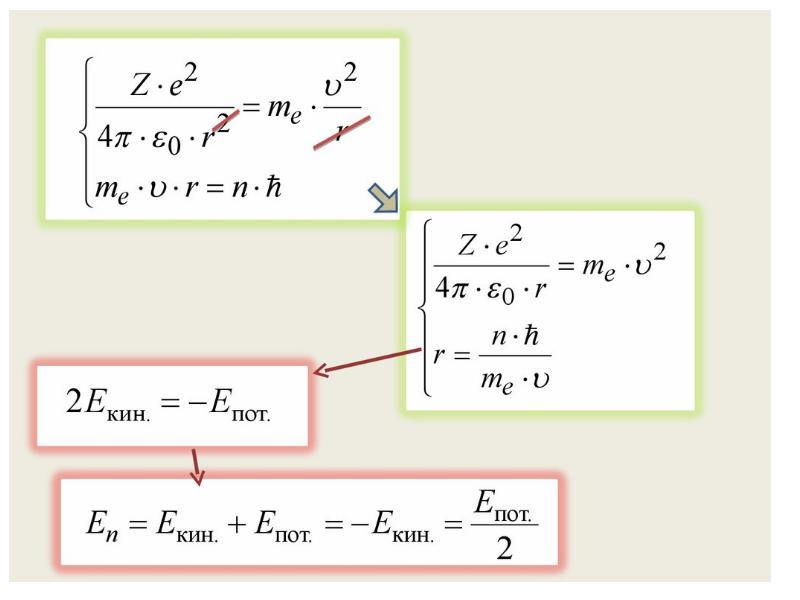
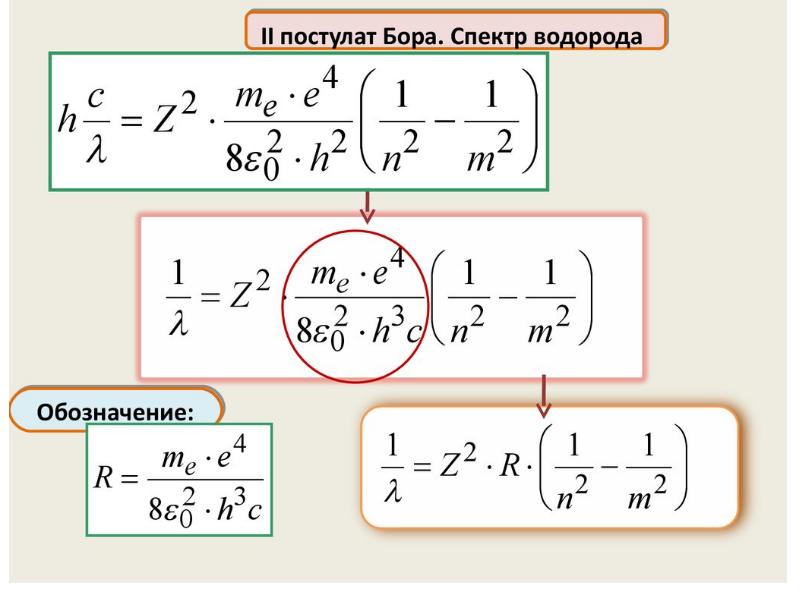
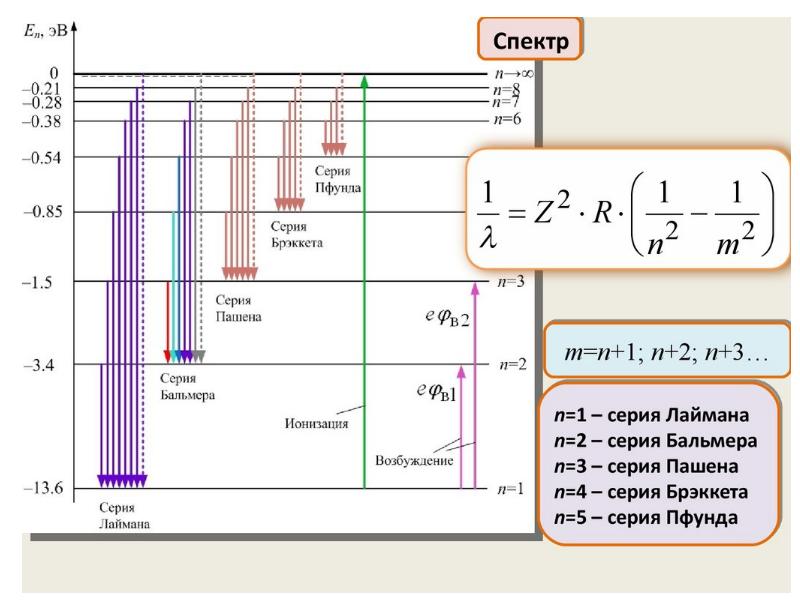
- 71. Энергия электрона на стационарной орбите
- 78. Скачать презентацию













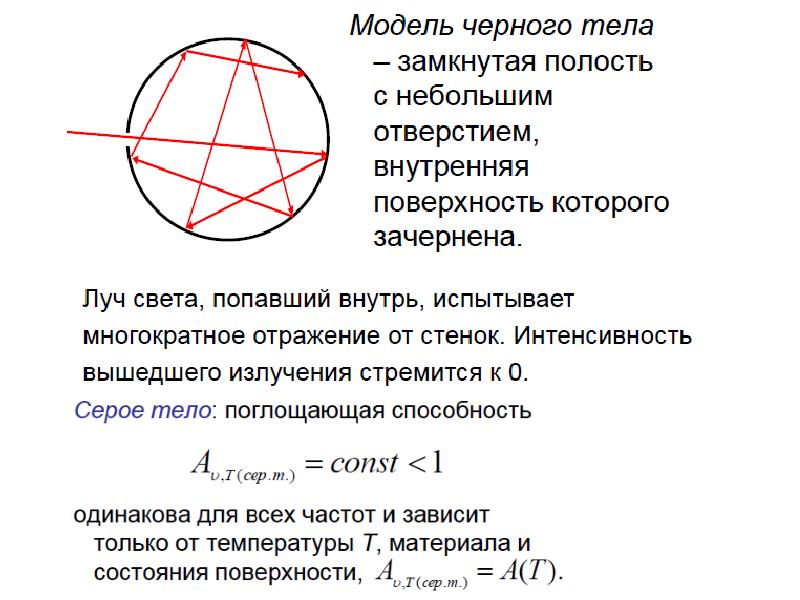






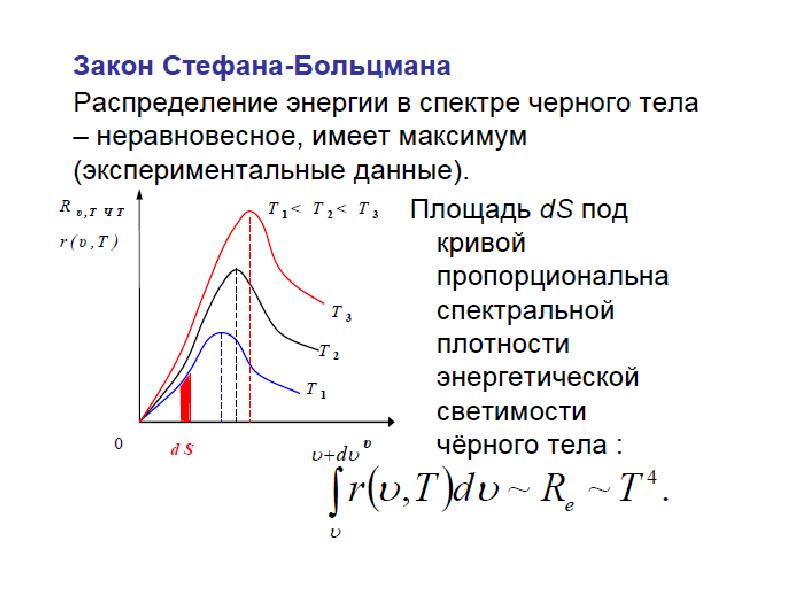
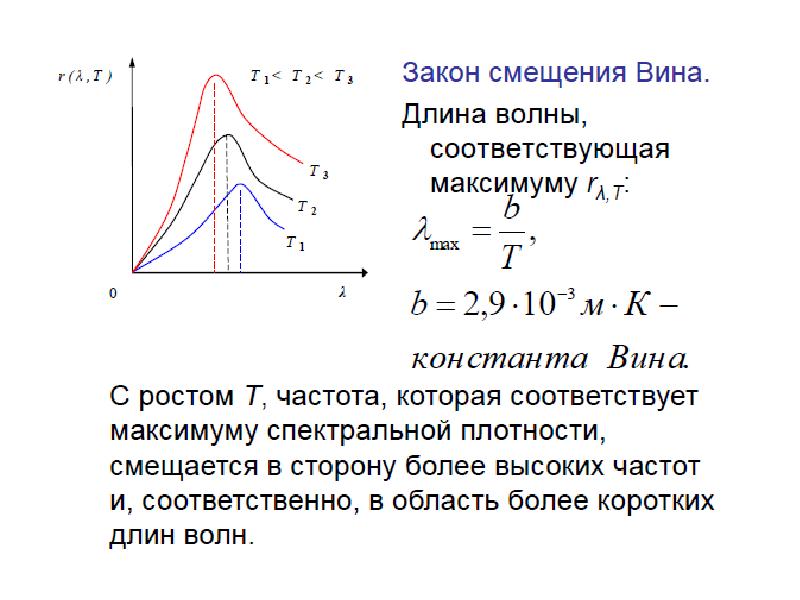


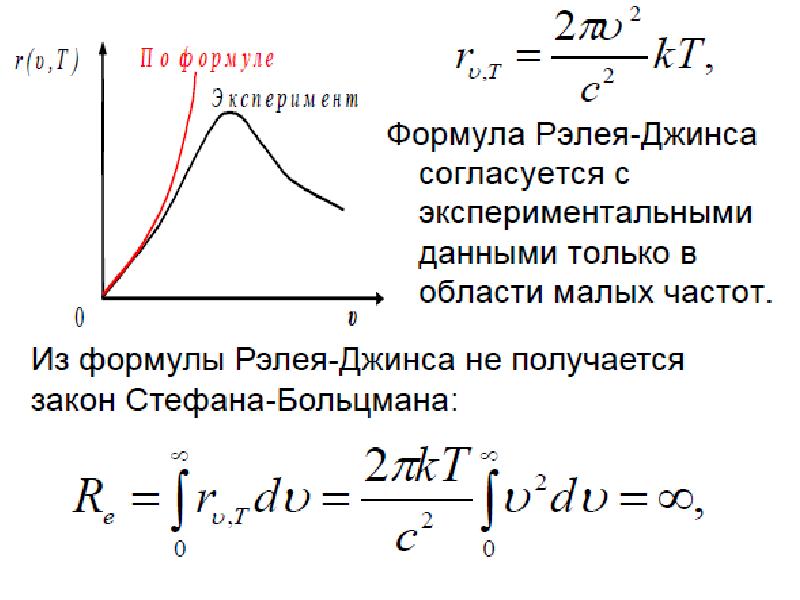










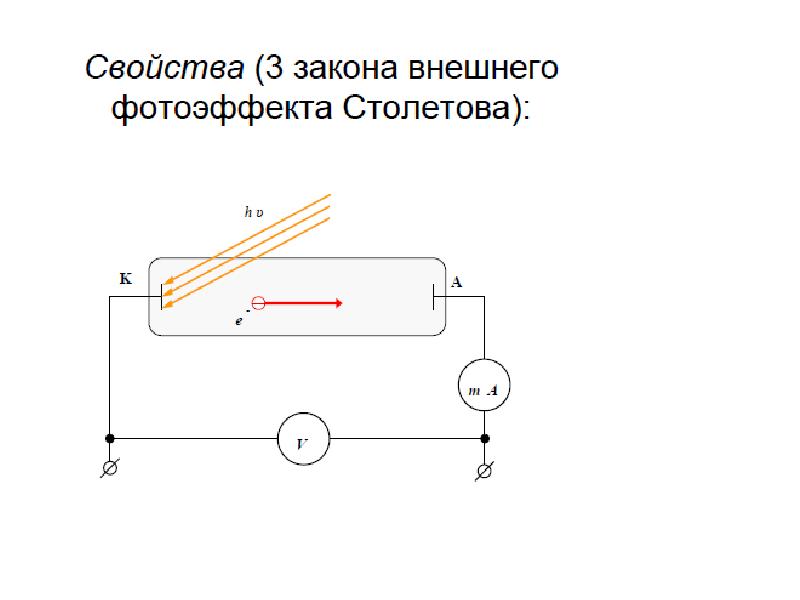
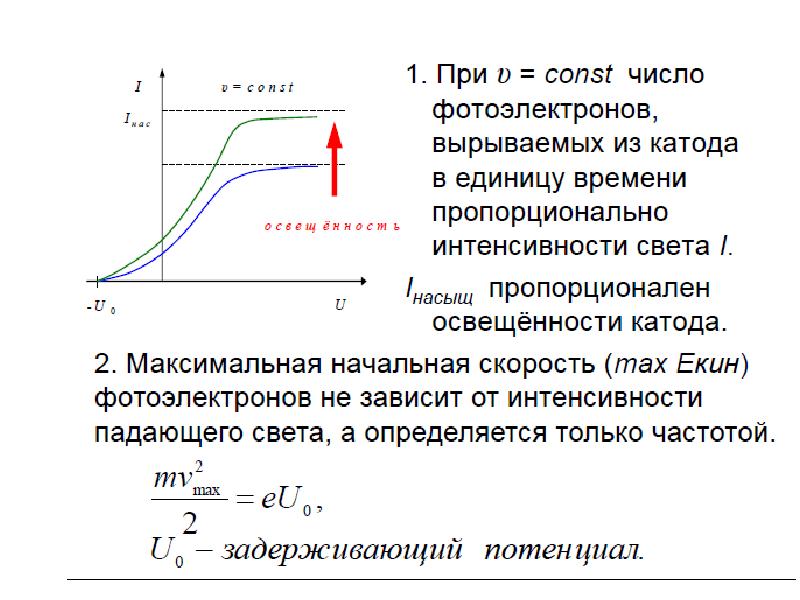
















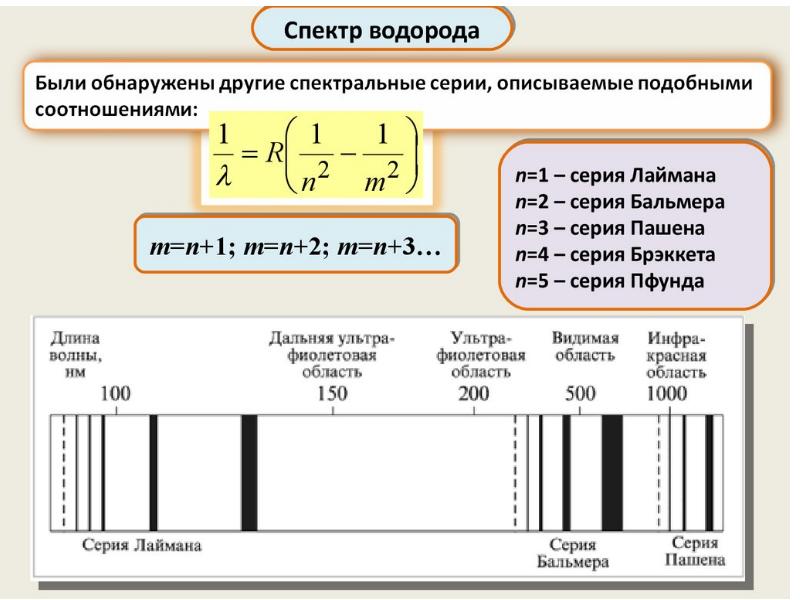
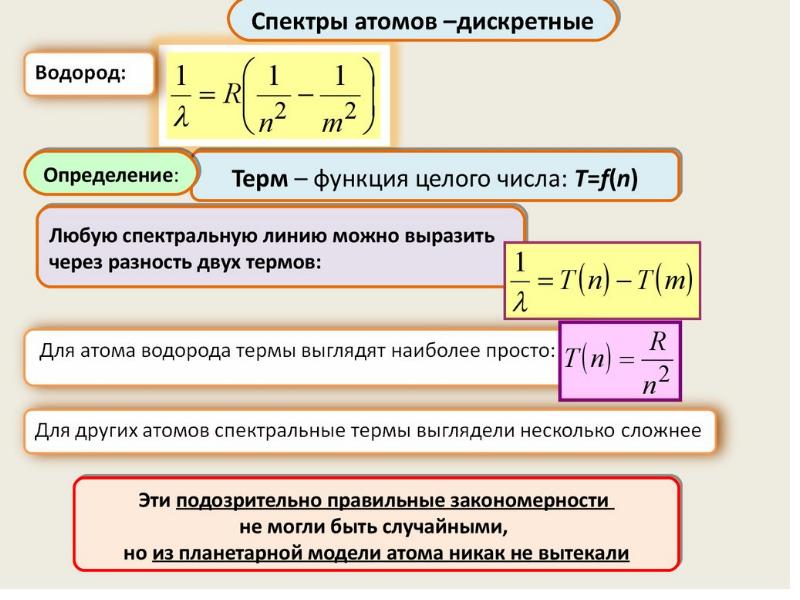



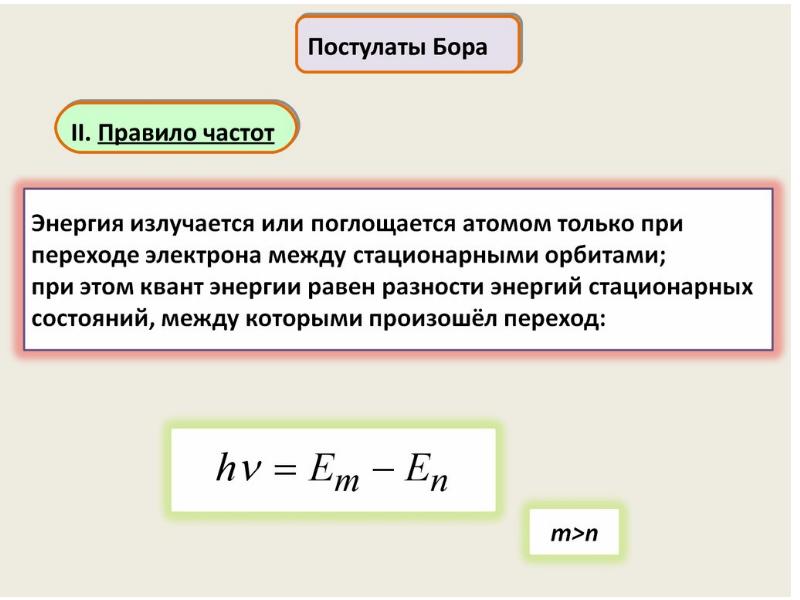
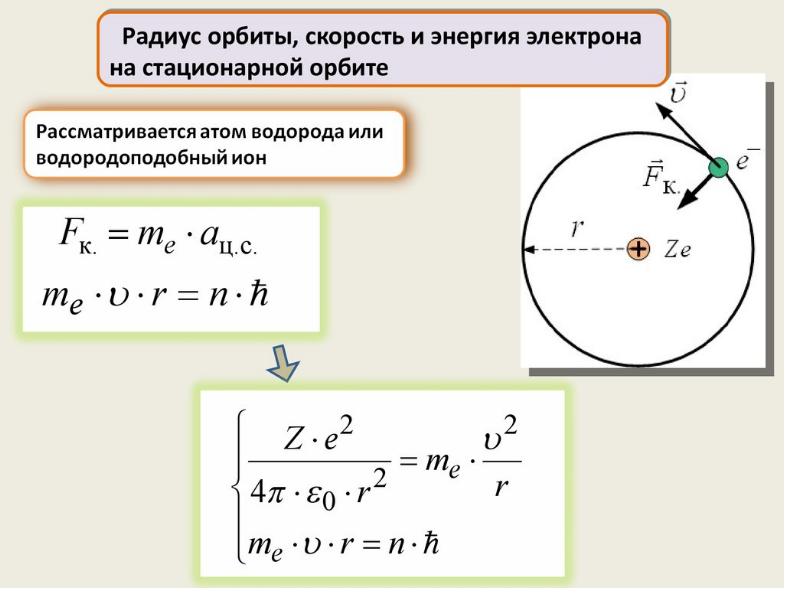



Слайды и текст этой презентации
Похожие презентации





























