Характеристика металу Ферум презентация
Содержание
- 2. 1.Знаходження в періодичній системі та основні характеристики. Ферум належить до VІІІ
- 3. Відкриття. Відкриття. Використання заліза почалося набагато раніше, ніж його виробництво. Перші
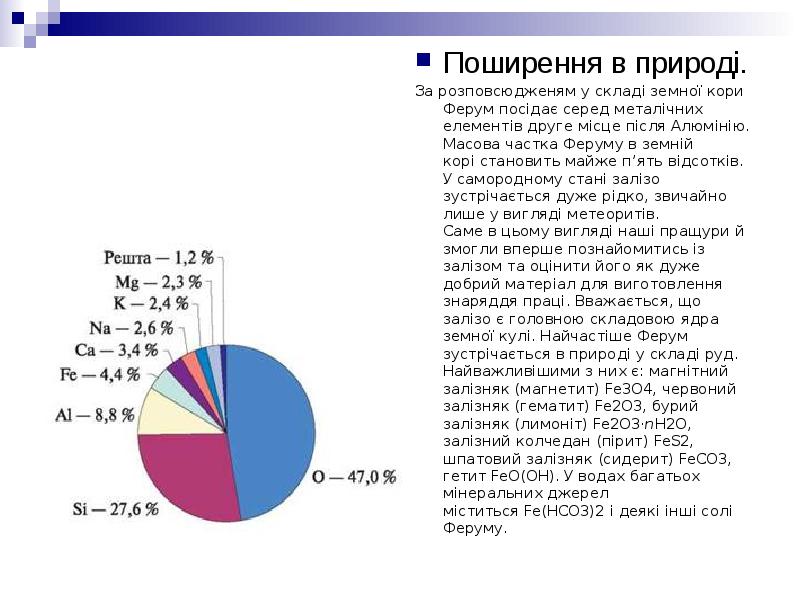
- 4. Поширення в природі. Поширення в природі. За розповсюдженям у складі земної
- 5. 2. Фізичні властивості. Залізо — блискучий сріблясто-білий важкий метал. Густина його 7,86
- 6. 3.Хімічні властивості. Залізо належить до металів середньої активності. Хімічно чисте залізо
- 7. 4.Добування. Залізо високої чистоти одержують прямим відновленням Fe2O3: Fe2O3 + 3H2 = Fe
- 8. 5.Застосування. Залізо — найважливіший метал сучасної техніки. У чистому вигляді залізо
- 9. 6. Найбільш поширені сполуки з Ферумом Ферум зустрічається виключно у сполуках,
- 11. Скачать презентацию









Слайды и текст этой презентации
Похожие презентации





























