Химическая кинетика презентация
Содержание
- 2. 1. Определение Химическая кинетика – раздел химии, изучающий скорость и механизмы
- 3. 1. Определение Различают среднюю и мгновенную скорость реакции. Средняя скорость реакции
- 4. 1. Определение Скорость всегда положительна. Знак «+» учитывает увеличение концентрации
- 5. 1. Определение Мгновенная (истинная) скорость определяется первой производной концентрации во времени:
- 6. 1. Определение Скорость реакции зависит от: Природы реагирующих веществ Концентрации
- 7. 2. Влияние концентрации реагирующих веществ на скорость хим. реакций Влияние концентрации
- 8. 2. Влияние концентрации реагирующих веществ на скорость хим. реакций Эта зависимость
- 9. 2. Влияние концентрации реагирующих веществ на скорость хим. реакций Примерами кинетических
- 10. 3. Кинетическая классификация химических реакций Кинетическая классификация химических реакций Кинетические реакции
- 11. 3. Кинетическая классификация химических реакций По молекулярности различают реакции: мономолекулярные
- 12. 3. Кинетическая классификация химических реакций бимолекулярные Например, реакция взаимодействия водорода и
- 13. 3. Кинетическая классификация химических реакций Порядок реакции определяется кинетическим уравнением и
- 14. 3. Кинетическая классификация химических реакций а) Нулевой порядок наблюдается в гетерогенных
- 15. 3. Кинетическая классификация химических реакций б) Для реакций первого порядка скорость
- 16. Кинетическая классификация химических реакций. Молекулярность. Порядок реакции. в) К реакциям второго
- 17. 3. Кинетическая классификация химических реакций.
- 18. 3. Кинетическая классификация химических реакций Для сложных многостадийных реакций
- 19. г) дробный порядок наблюдается в случаях, если: химическая реакция протекает в
- 20. 3. Кинетическая классификация химических реакций. Рассмотрим реакцию хлорирования тетрахлороэтилена с
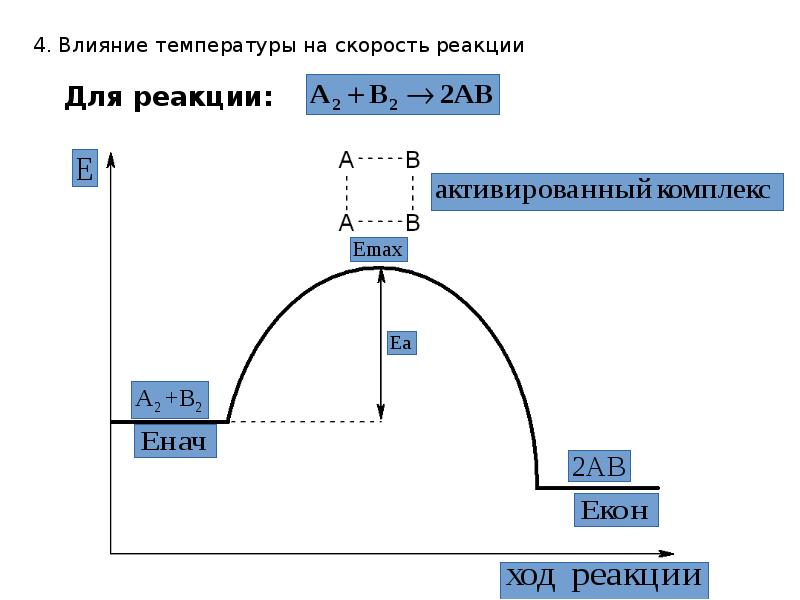
- 21. 4. Влияние температуры на скорость реакции Влияние температуры на скорость реакции.
- 22. 4. Влияние температуры на скорость реакции Активированный комплекс существует очень короткое
- 23. 4. Влияние температуры на скорость реакции Для реакции:
- 24. 4. Влияние температуры на скорость реакции Преодолеть энергетический барьер способны лишь
- 25. 4. Влияние температуры на скорость реакции С точки зрения теории
- 26. 4. Влияние температуры на скорость реакции Зависимость скорости реакции от температуры
- 27. 4. Влияние температуры на скорость реакции Если Еа = 84 –
- 28. 4. Влияние температуры на скорость реакции t1 –
- 29. 4. Влияние температуры на скорость реакции Для большинства биохимических реакций
- 30. 5. Катализ Катализ Катализом называется селективное изменение скорости химической реакции веществом,
- 31. 5. Катализ Действие катализатора основано на образовании между ним и компонентами
- 32. 5. Катализ По механизму действия различают: 1. гомогенный катализ
- 33. 5. Катализ 3. Катализаторы не влияют на величину констант равновесия. 4.Катализаторы
- 34. 5. Катализ Ферментативный катализ Ферменты (энзимы) – биологические катализаторы, вещества белковой
- 35. 5. Катализ Ферменты отличаются рядом свойств от неорганических катализаторов: 1. Высокая
- 36. 5. Катализ 2. Высокая скорость ( в 106 – 1012 раз
- 37. 5. Катализ Кинетика ферментативных процессов изучалась Михаэлисом и Ментен (1913 г.)
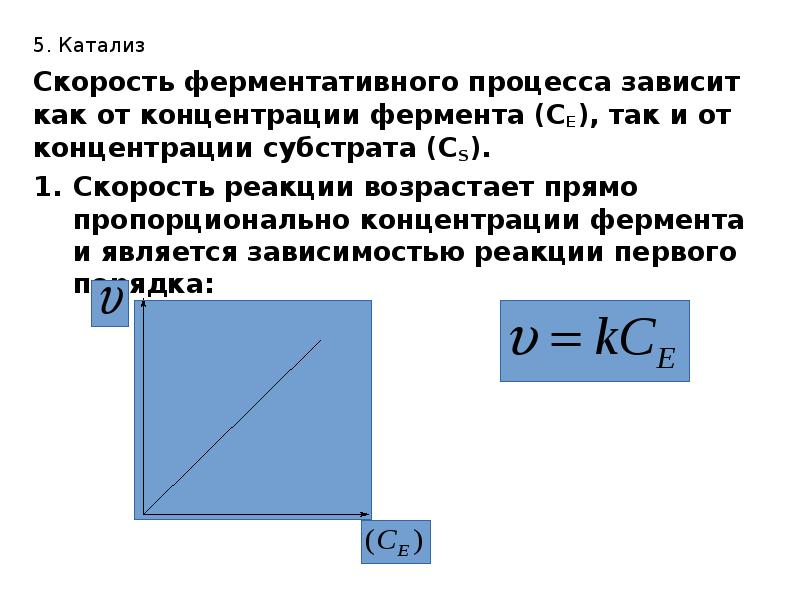
- 38. 5. Катализ Скорость ферментативного процесса зависит как от концентрации фермента (СЕ),
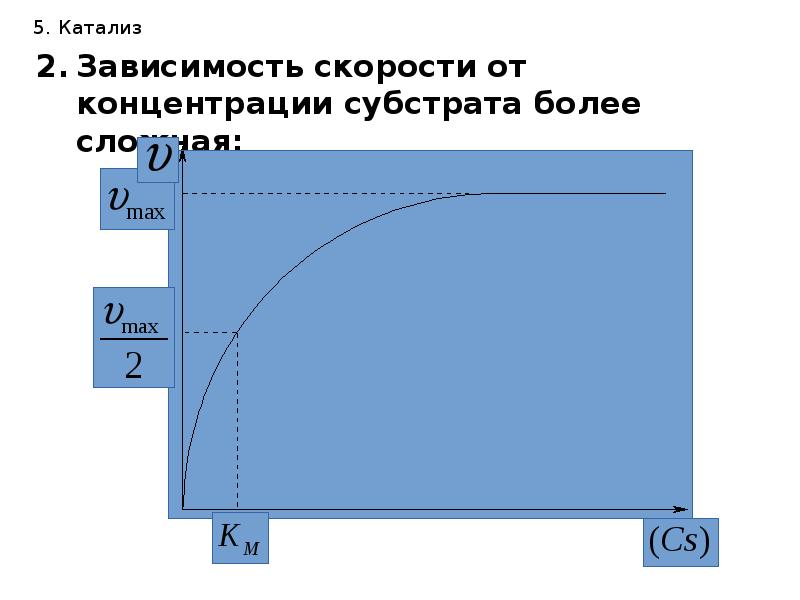
- 39. 5. Катализ Зависимость скорости от концентрации субстрата более сложная:
- 40. 5. Катализ При небольших концентрациях субстрата зависимость соответствует первому порядку реакции:
- 41. 5. Катализ При дальнейшем увеличении концентрации субстрата наступает момент насыщения активных
- 42. 5. Катализ Математически зависимость скорости от концентрации субстрата выражается кинетическим уравнением
- 43. 5. Катализ КМ – константа диссоциации фермент-субстратного комплекса или константа
- 44. 5. Катализ В настоящее время известно свыше 2000 ферментов, учение о
- 45. 6. Действие ингибиторов 1. Защитное действие ингибиторов коррозии определяется их способностью
- 46. 6. Действие ингибиторов 2. Антиоксиданты. Ингибиторы окисления пищевых продуктов —
- 47. 6. Действие ингибиторов Синтетические антиоксиданты (так называемые присадки) применяются для предохранения
- 48. 6. Действие ингибиторов 1. Ингибиторы, обрывающие цепи по реакции с пероксильными
- 49. 6. Действие ингибиторов 1. Ингибиторы, обрывающие цепи по реакции с пероксильными
- 50. 6. Действие ингибиторов 6. Ингибиторы комбинированного действия. Некоторые соединения тормозят окисление,
- 51. 6. Действие ингибиторов 3. Лекарственные вещества – ингибиторы (блокаторы). Механизм биологического
- 52. 6. Действие ингибиторов Верапамил и его производные являются блокаторами кальциевых каналов,
- 53. Скачать презентацию

















































Слайды и текст этой презентации
Похожие презентации





























