Химическая термодинамика презентация
Содержание
- 2. – область химии, изучающая энергетику химических процессов, возможности и условия самопроизвольного
- 3. Термодинамическая система (ТС) Объект изучения химической термодинамики термодинамическая система (ТС). ТС
- 4. ТС бывают: ТС бывают: 1. Изолированные – отсутствуют, какие-либо формы обмена
- 7. Также для описания состояния тс используют две функции процесса- это работа
- 8. Внутренняя Энергия
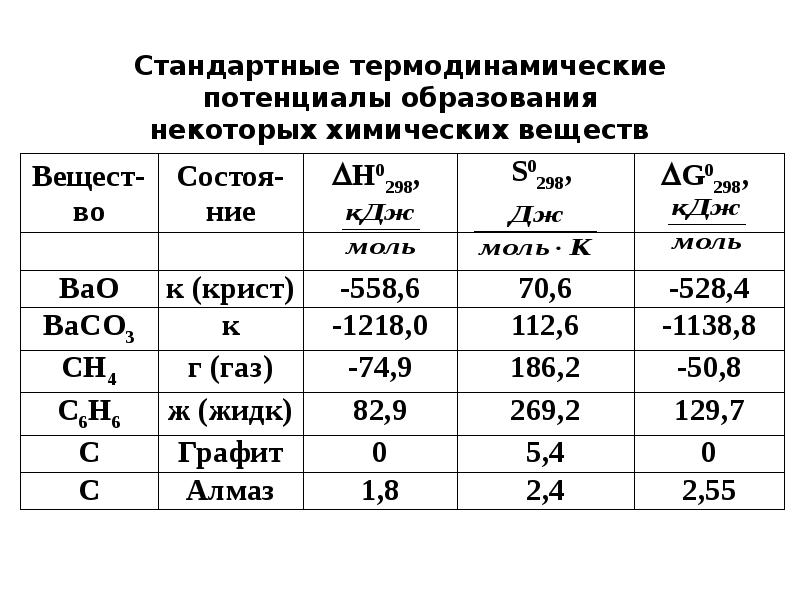
- 15. Для того, чтобы можно было теоретически рассчитать и сравнивать тепловые эффекты
- 17. Пример Рассчитать какое количество теплоты выделится при сгорании 8 г метана.
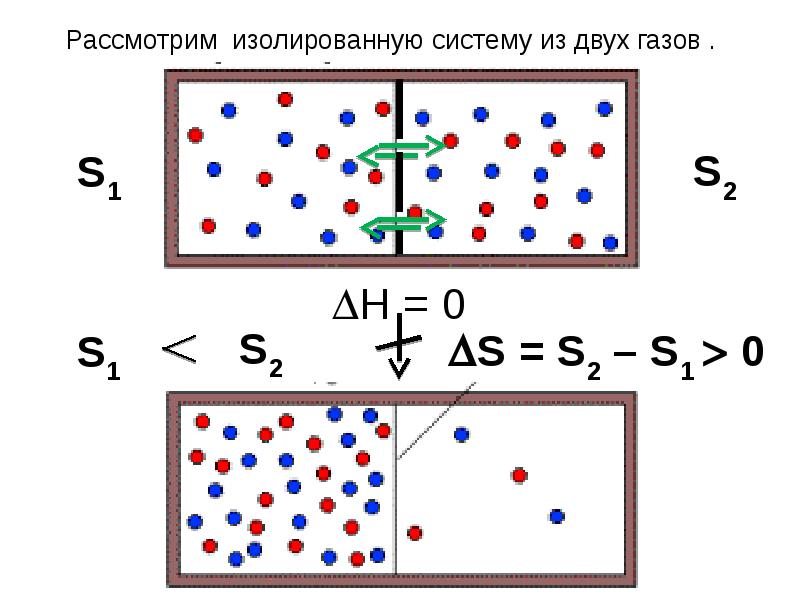
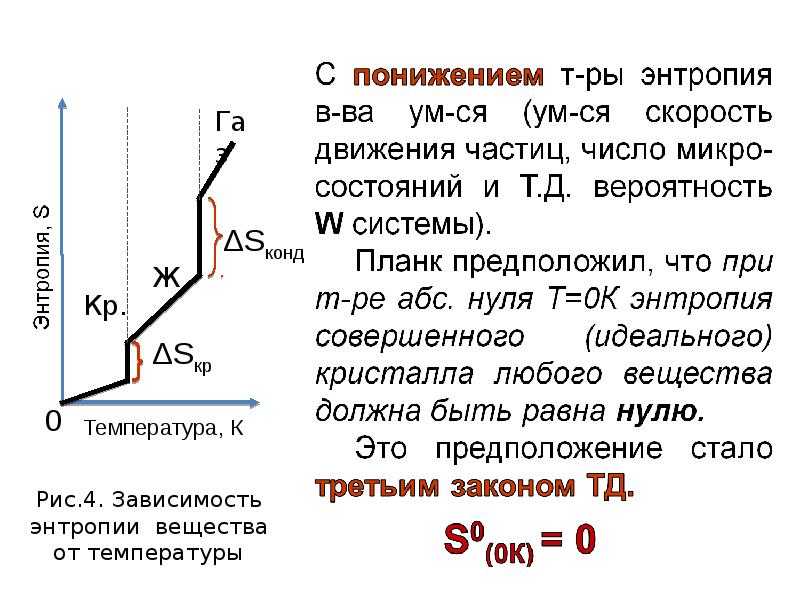
- 21. 2-ой закон термодинамики В изолированной системе самопроизвольно протекают такие процессы, которые
- 29. Скачать презентацию

























Слайды и текст этой презентации
Похожие презентации





























