Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе презентация
Содержание
- 5. Простые и комплексные соединения HgI2 + 2KI = K2[HgI4] SO3(т) +
- 6. Комплексные (координационные) соединения Комплексами называют сложные частицы, образованные из реально существующих
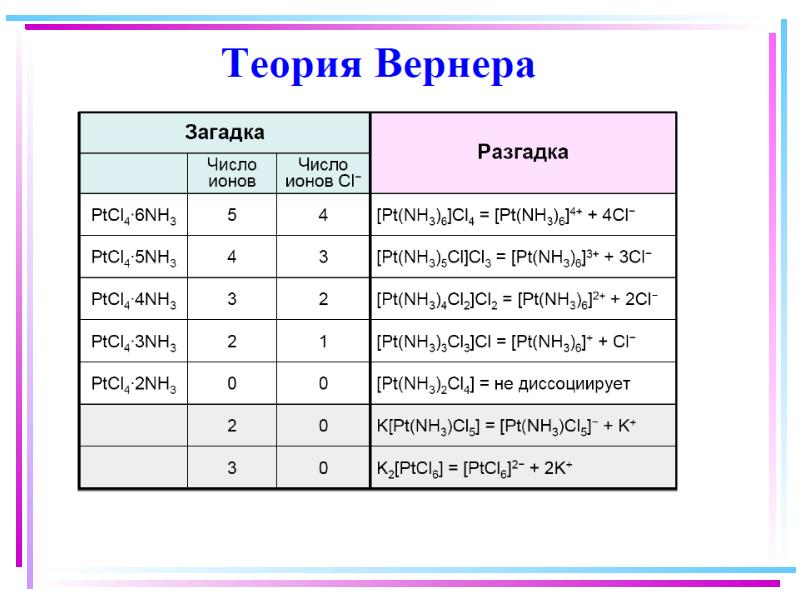
- 7. Координационная теория (1893 г. ) Внутренняя и внешняя сфера комплексного соединения
- 8. Внутренняя сфера [комплекс] Внешняя сфера (противоион) [Ni(NH3)6]Cl2 K4[Fe(CN)6]
- 9. Комплексообразователь, лиганды, КЧ и дентатность. Примеры [NH4]Cl – КЧ 4, дент.1
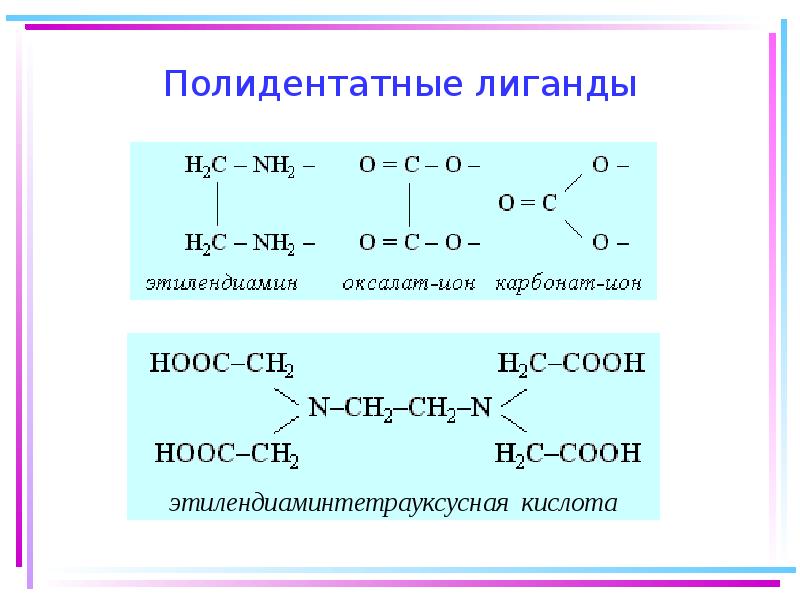
- 10. Полидентатные лиганды
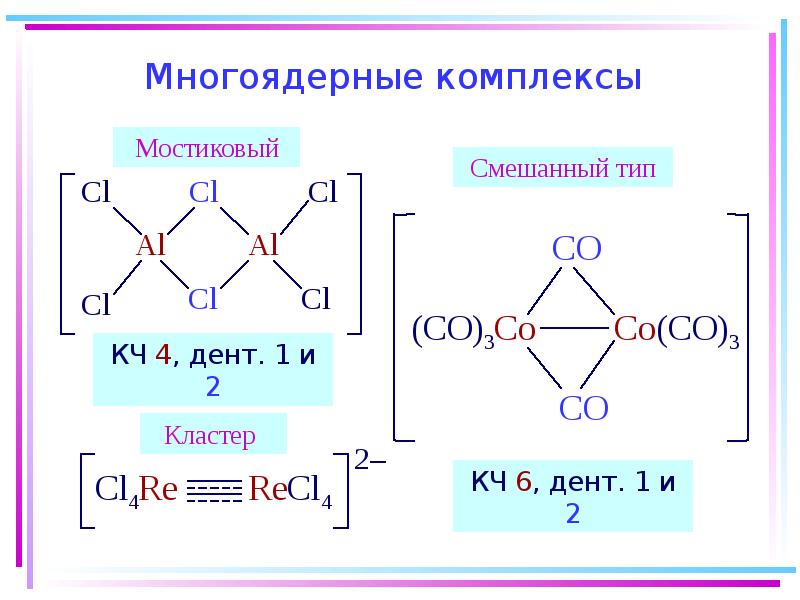
- 11. Многоядерные комплексы
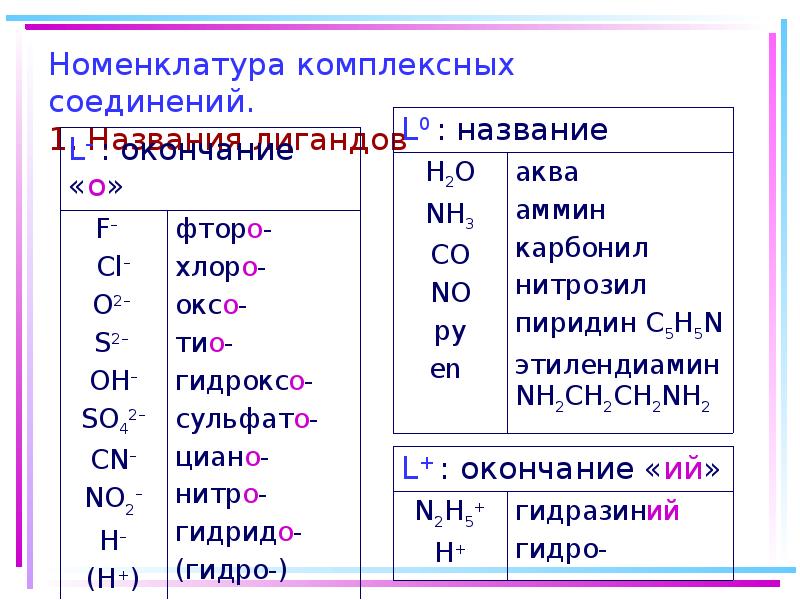
- 12. Номенклатура комплексных соединений. 1. Названия лигандов
- 13. 2. Формулы и названия компл. соединений. [M(L+)(L0)(L–)]±,0 Число лигандов – греч.
- 14. 3. Названия комплексных соединений А) Комплексы без внешней сферы [MLn]
- 15. Названия комплексных соединений Б) Комплексный катион [MLn]+X– «анион катиона»:
- 16. Названия комплексных соединений В) Комплексный анион X+[MLn]– «анион катиона»:
- 17. Упражнения: Na3[AgI(SO3S)2] – бис(тиосульфато)аргентат(I) натрия [PtII(py)4]2[FeII(CN)6] – гексацианоферрат(II) тетрапиридинплатины(II)
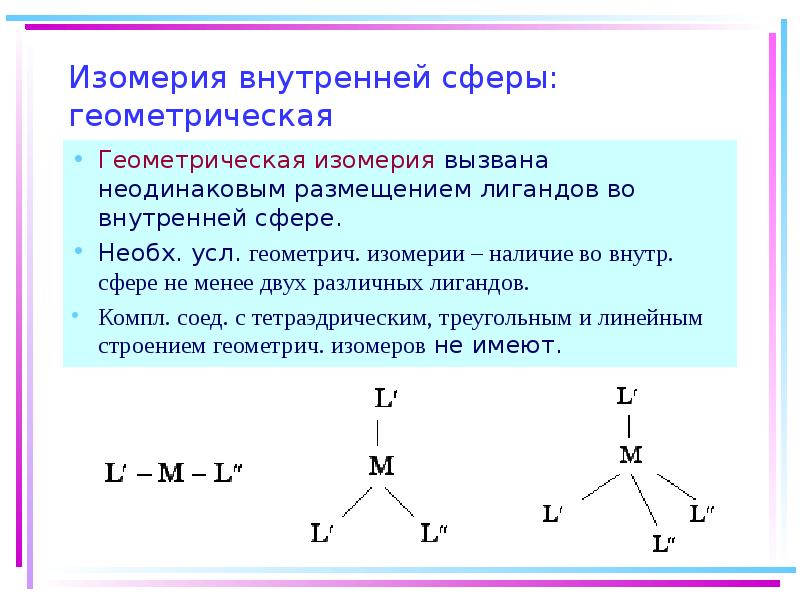
- 18. Изомерия комплексных соединений Изомерия – явление существования соединений, одинаковых по составу
- 19. Изомерия лигандов Связевая —NO2– и —ONO– нитро-
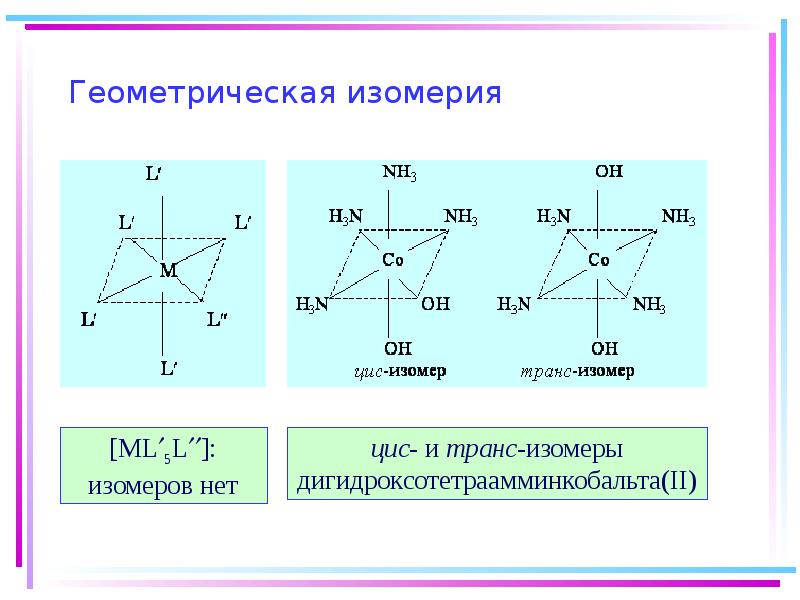
- 20. Изомерия внутренней сферы: геометрическая Геометрическая изомерия вызвана неодинаковым размещением лигандов во
- 21. Геометрическая изомерия Плоскоквадратные комплексы при наличии двух разных лигандов L и
- 22. Геометрическая изомерия
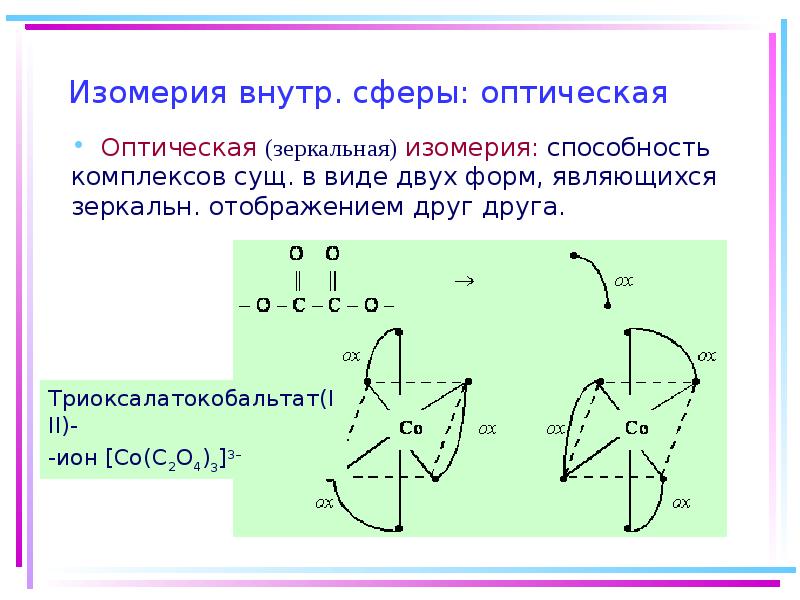
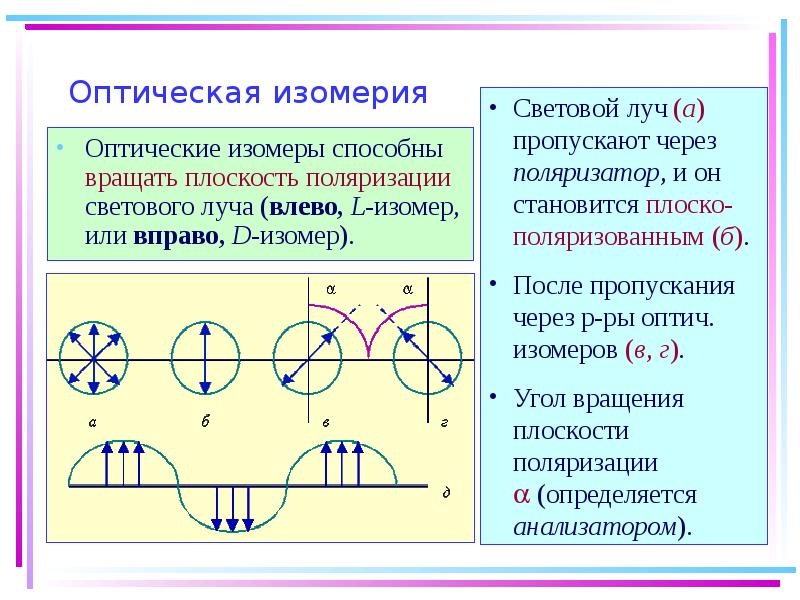
- 23. Изомерия внутр. сферы: оптическая Оптическая (зеркальная) изомерия: способность комплексов сущ. в
- 24. Оптическая изомерия Оптические изомеры способны вращать плоскость поляризации светового луча (влево,
- 25. Междусферная изомерия: 1) сольватная (гидратная); 2) ионная изомерия [Co(en)2Cl2]Cl ·
- 26. Междусферная изомерия Ионные (ионизационные) изомеры [Pt(NH3)4Cl2]Br2 и [Pt(NH3)4Br2]Cl2 [Pt(NH3)4SO4](OH)2 и
- 27. Комплексные соединения в растворах Неэлектролиты (слабые электролиты) [Pt(NH3)2Cl2] (ср. H2O2, CO(NH2)2
- 28. Реакции обмена лигандов [MLn] + H2O [MLn-1(H2O)] + L0 (n
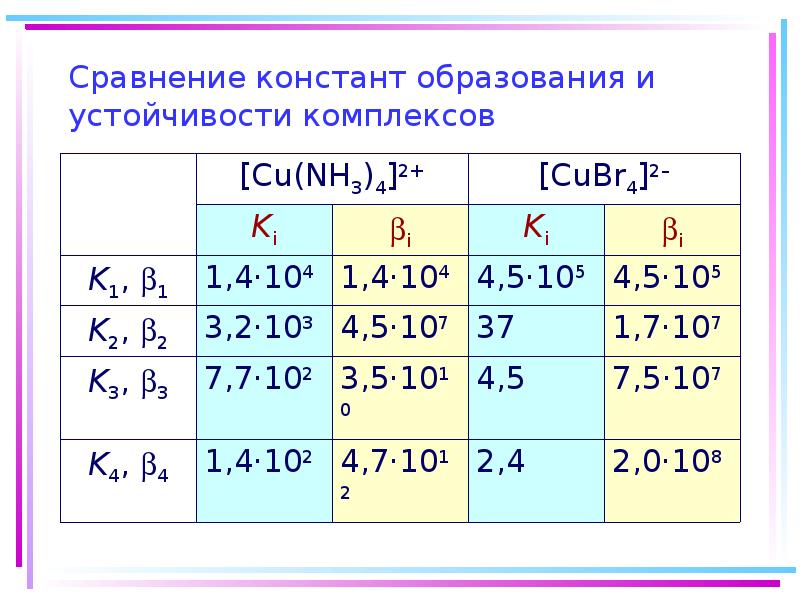
- 29. Ступенчатая константа образования комплекса Чем больше значение Ki(обр), тем сильнее смещено
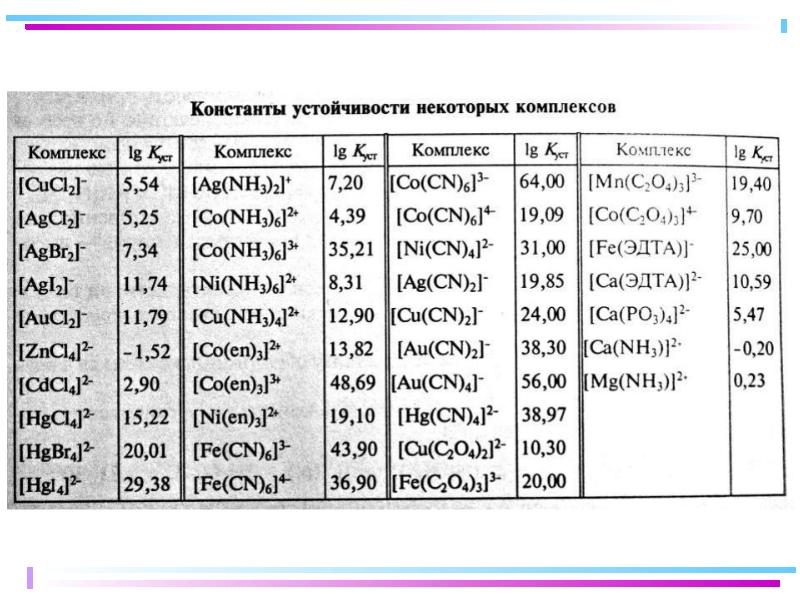
- 30. Полные (суммарные) константы образования Характеристика устойчивости комплексного соединения: чем больше значение
- 31. Связь между полной и ступенчатой константами образования n(обр) = K1(обр)·K2(обр)·K3(обр)·… ·Kn(обр)
- 32. Сравнение констант образования и устойчивости комплексов
- 33. Сравнение устойчивости аммиачных комплексов Ступени комплексообразования [Cu(NH3)2]+ K2(обр) = 5,0·104
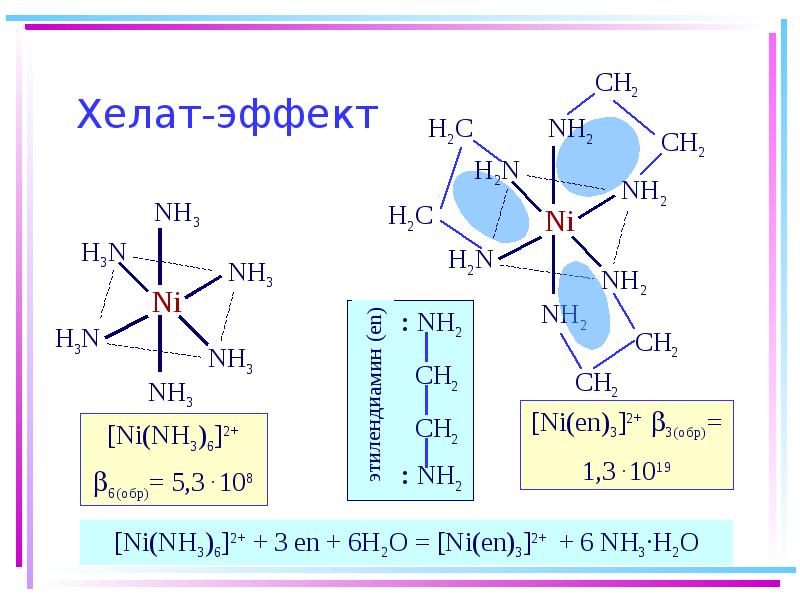
- 34. Хелат-эффект
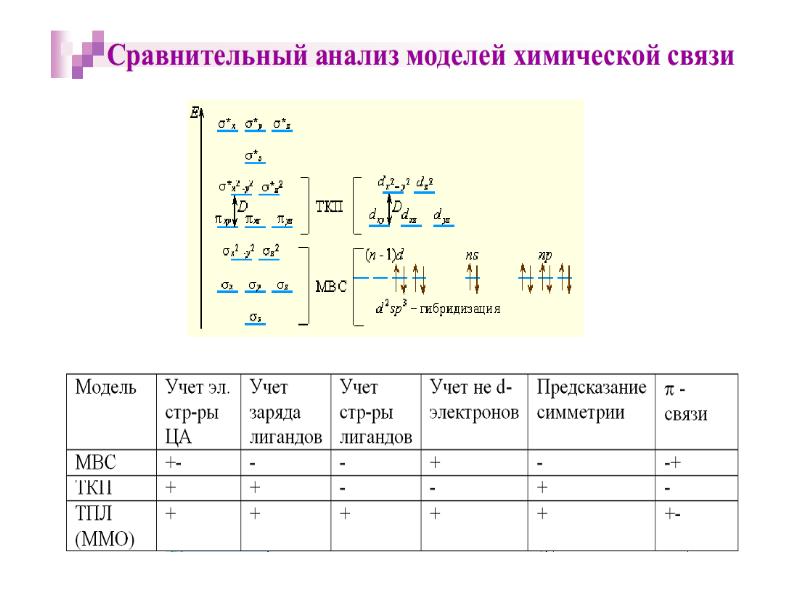
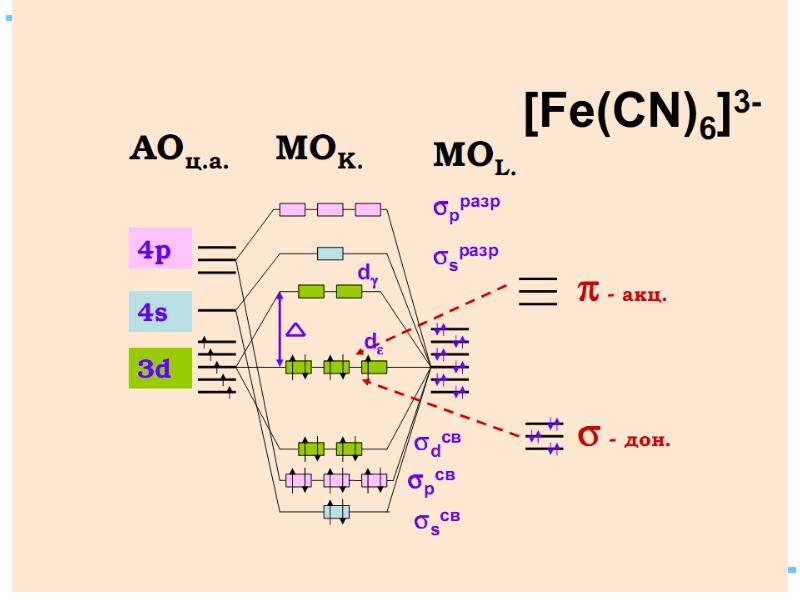
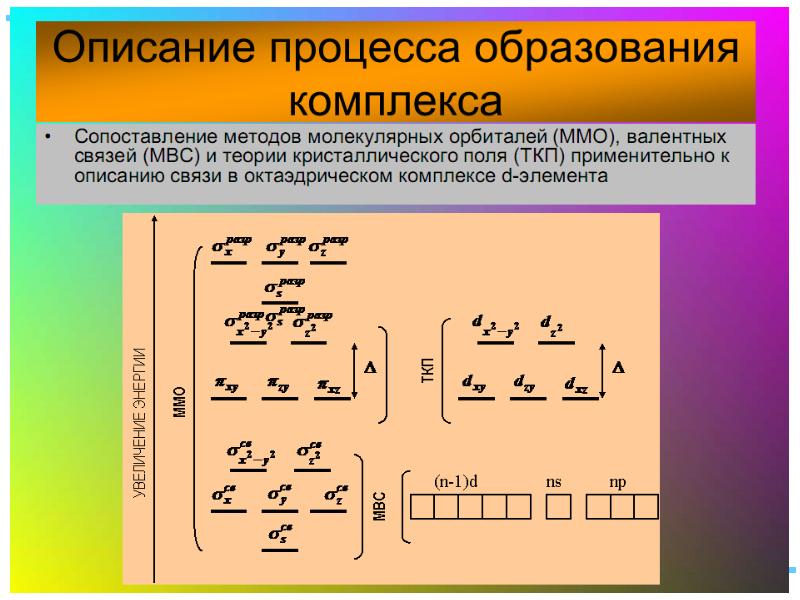
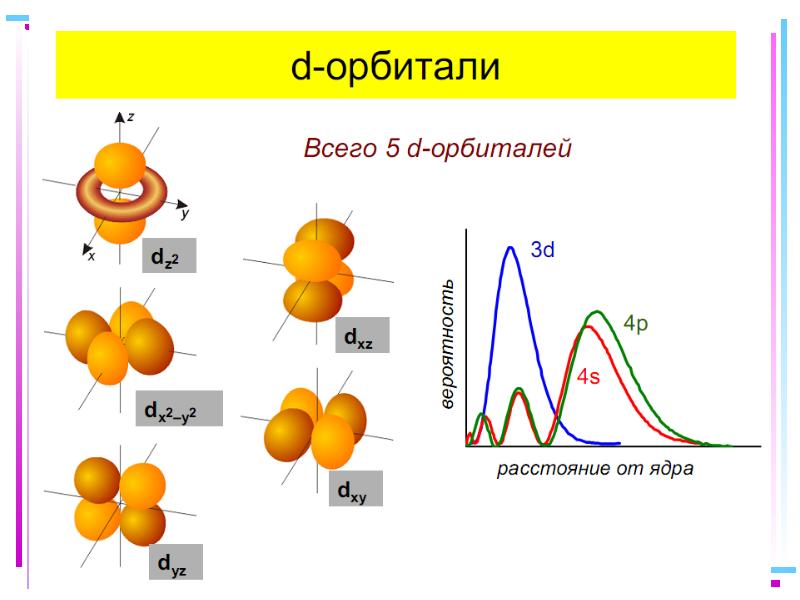
- 35. Квантовомеханические теории строения комплексных соединений Для объяснения строения комплексных соединений наиболее
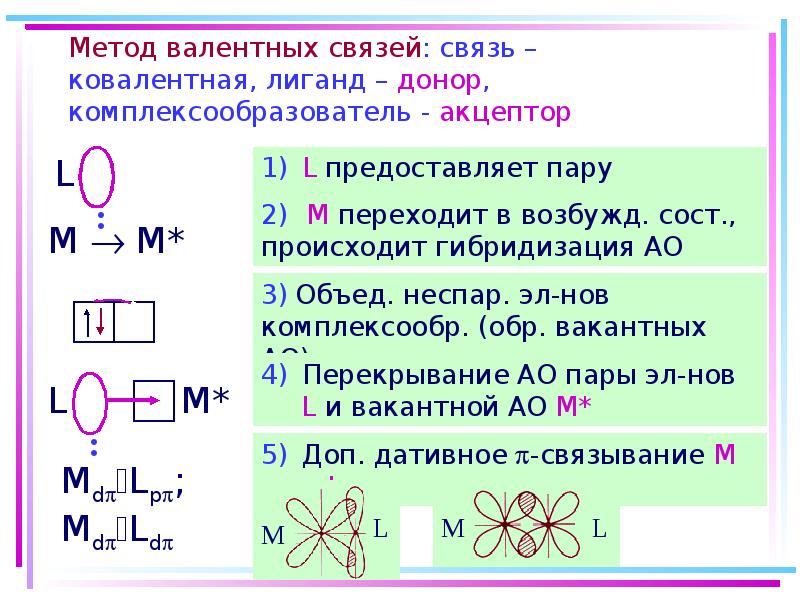
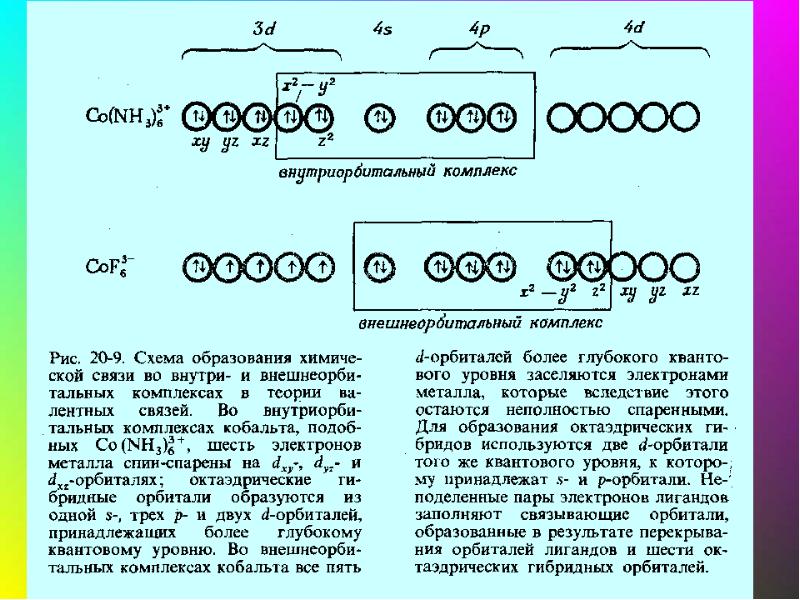
- 36. Метод валентных связей: связь – ковалентная, лиганд – донор, комплексообразователь -
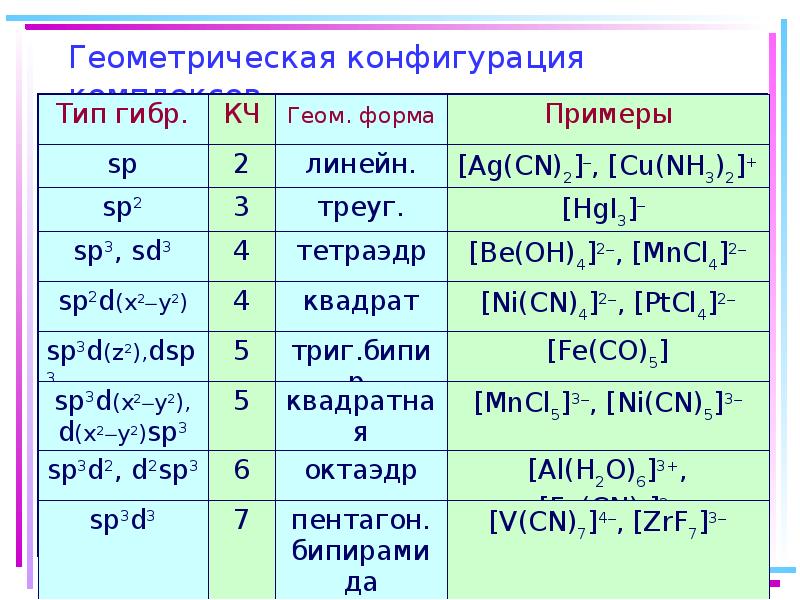
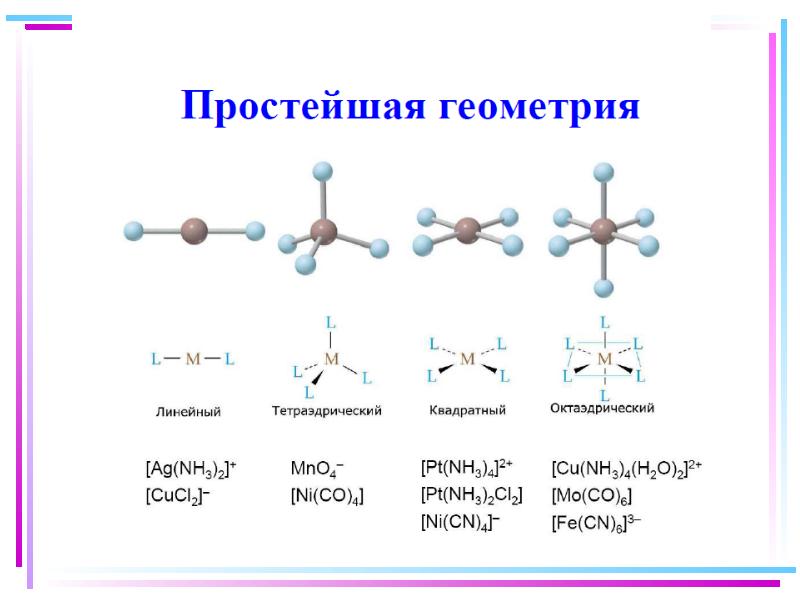
- 37. Геометрическая конфигурация комплексов
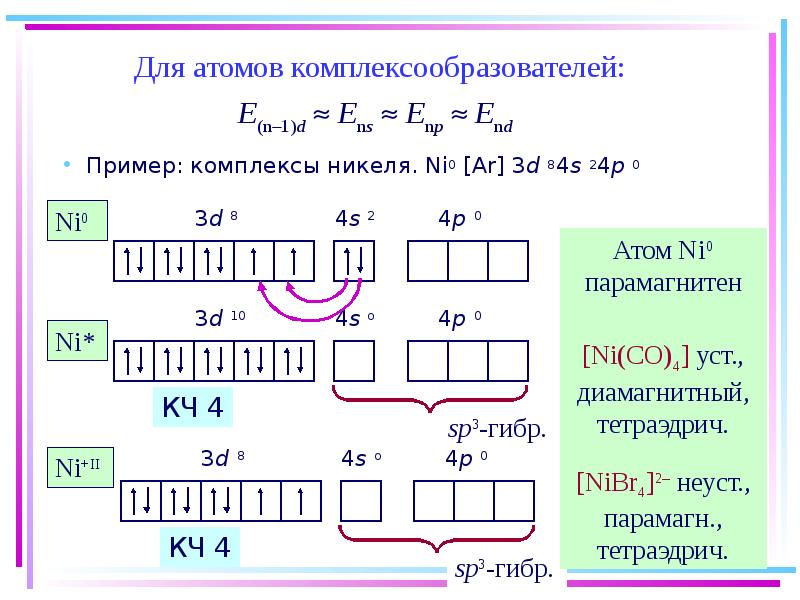
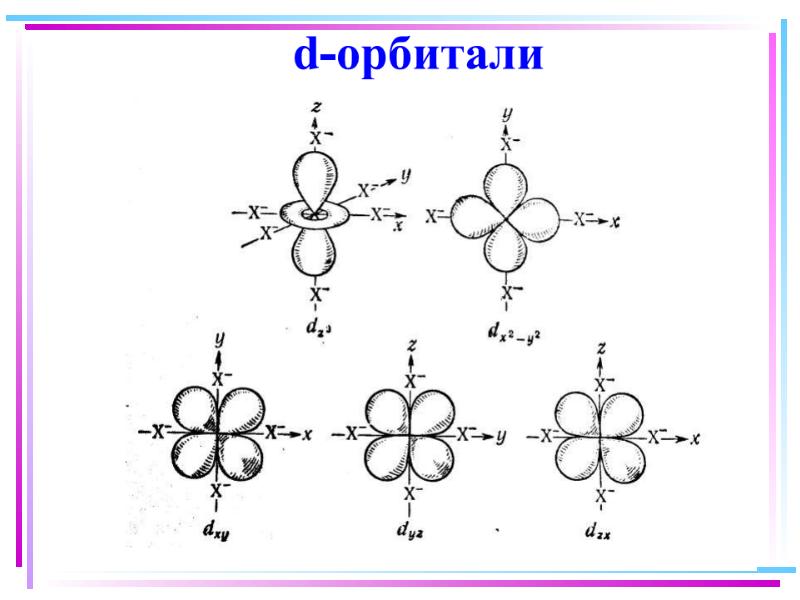
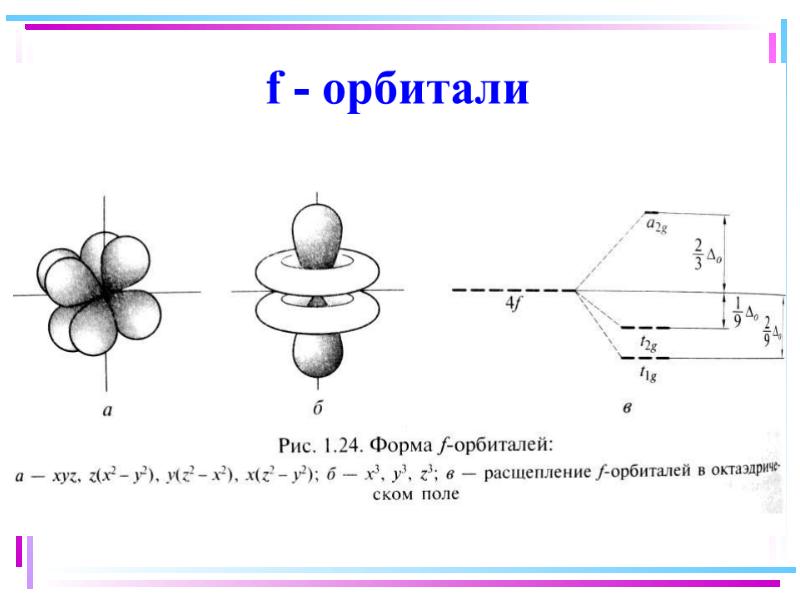
- 38. Для атомов комплексообразователей: E(n1)d Ens Enp End
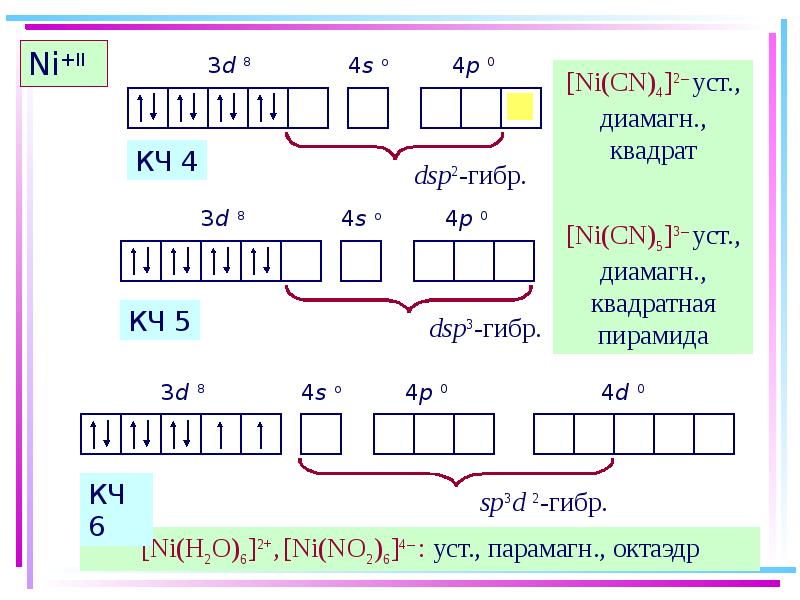
- 39. Ni+II
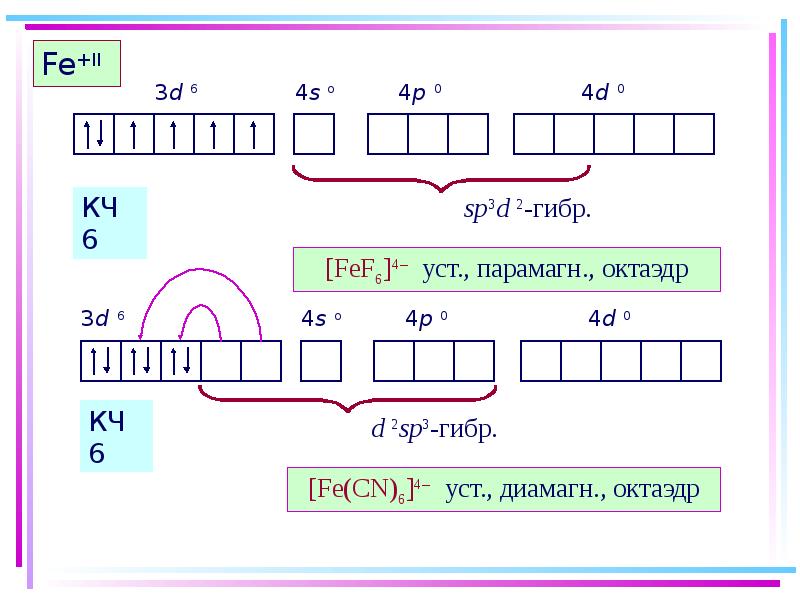
- 40. Fe+II
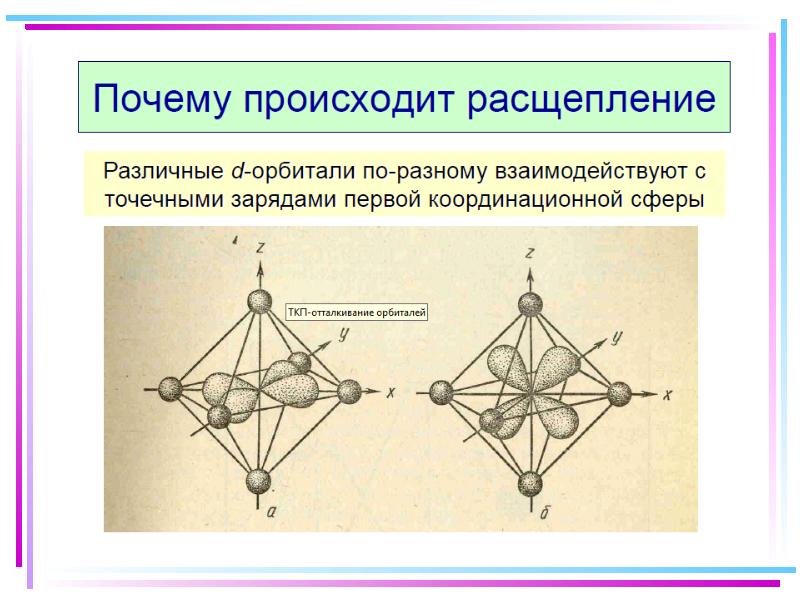
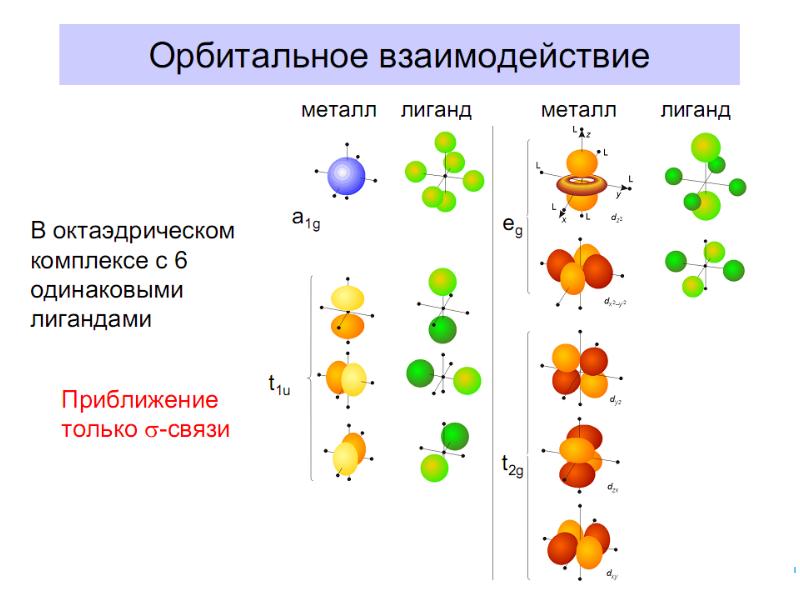
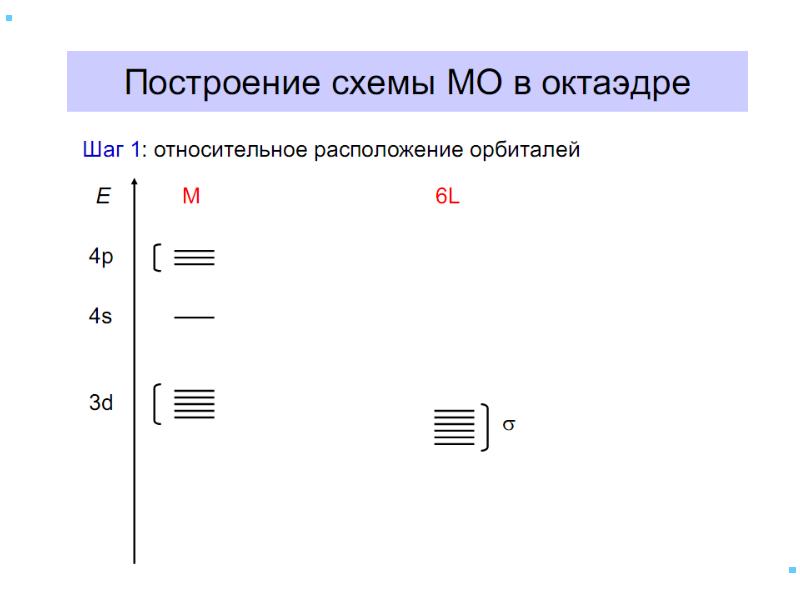
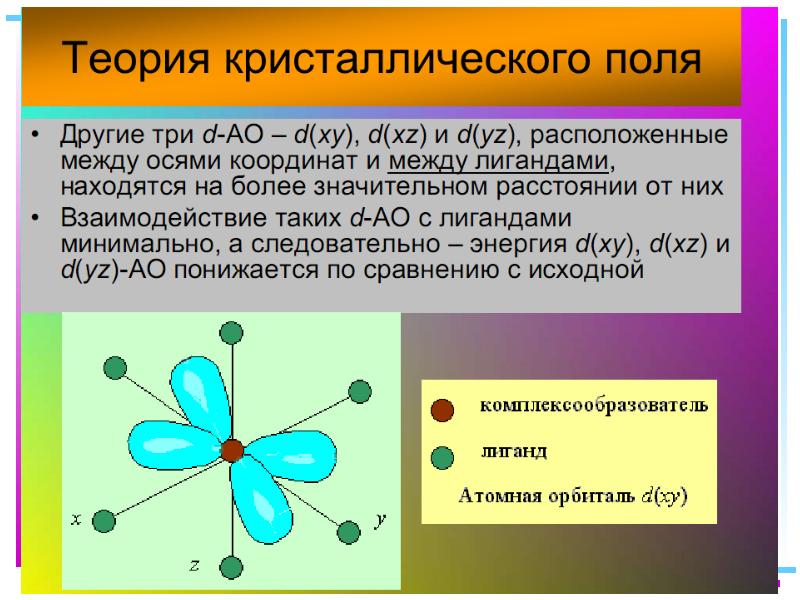
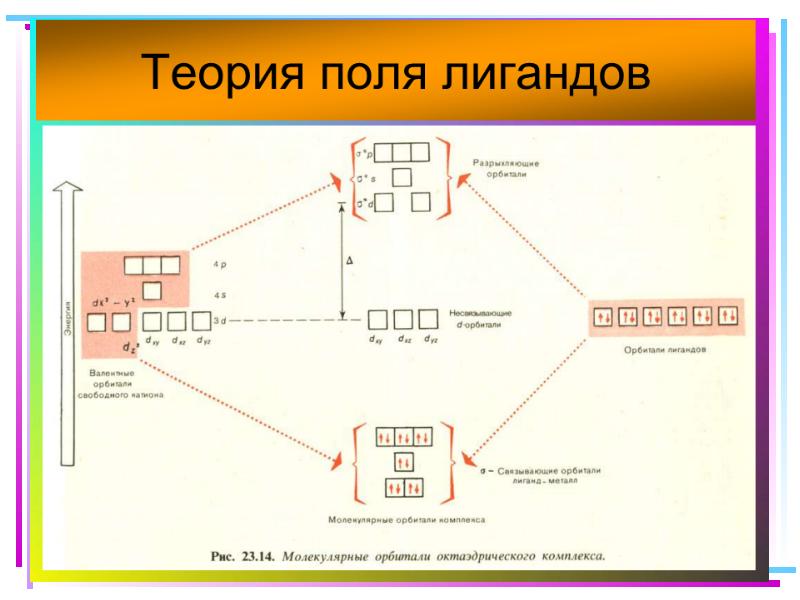
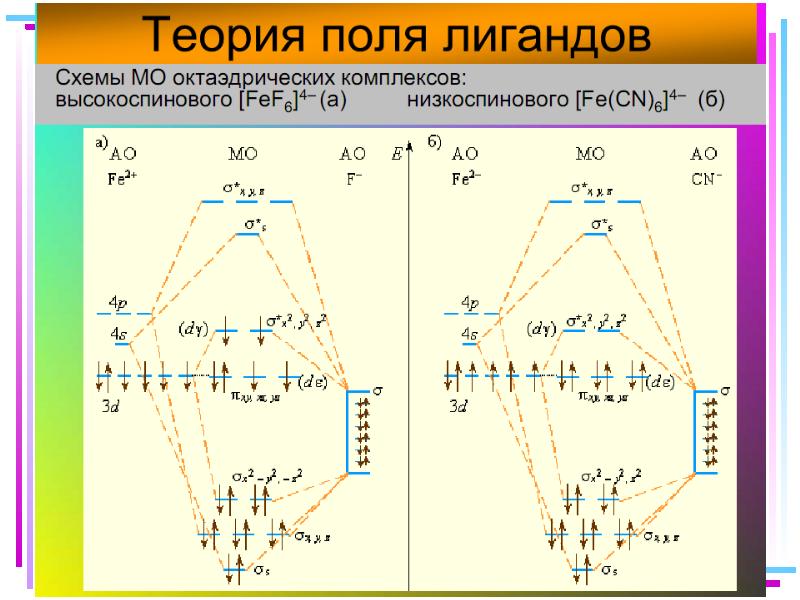
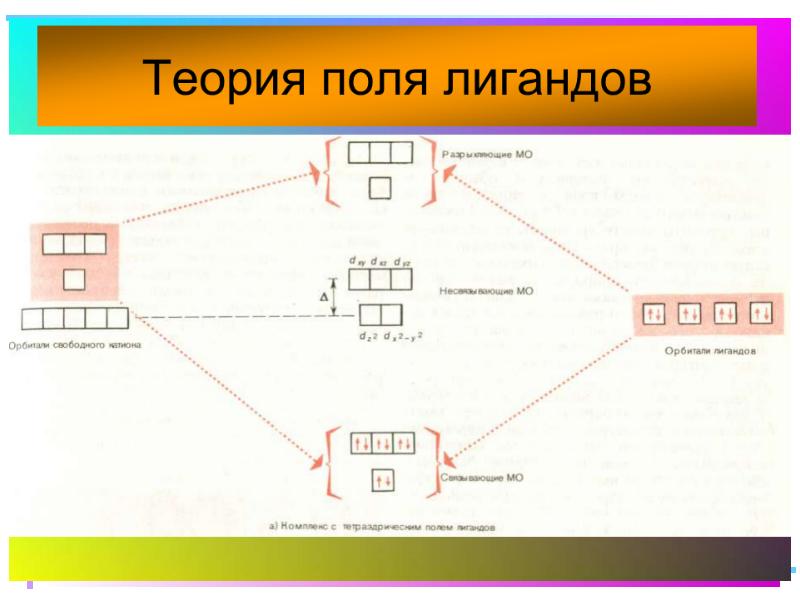
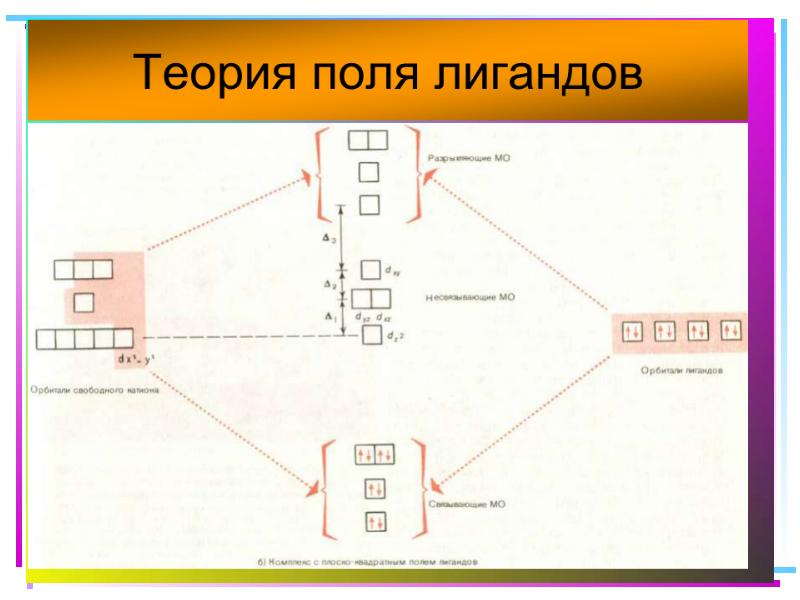
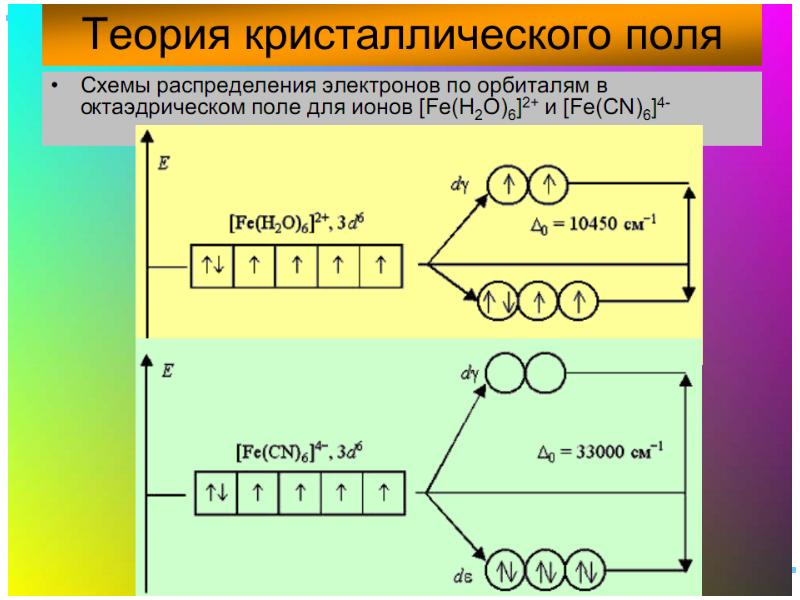
- 41. Основные положения теории кристаллического поля (поля лигандов) Связь комплексообразователя (центр. атома)
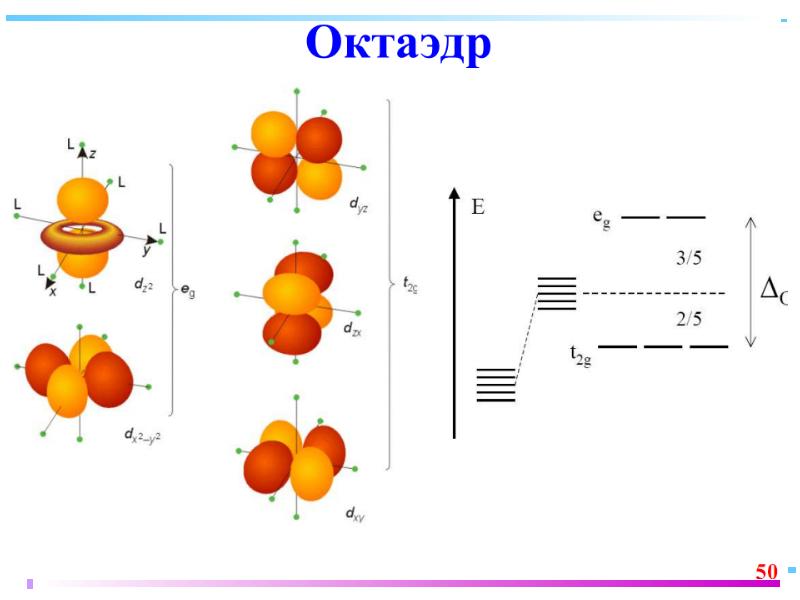
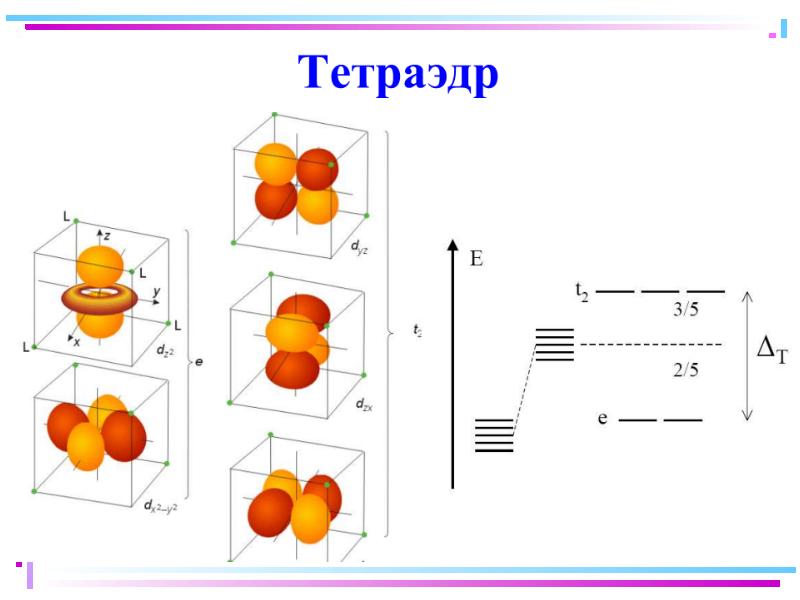
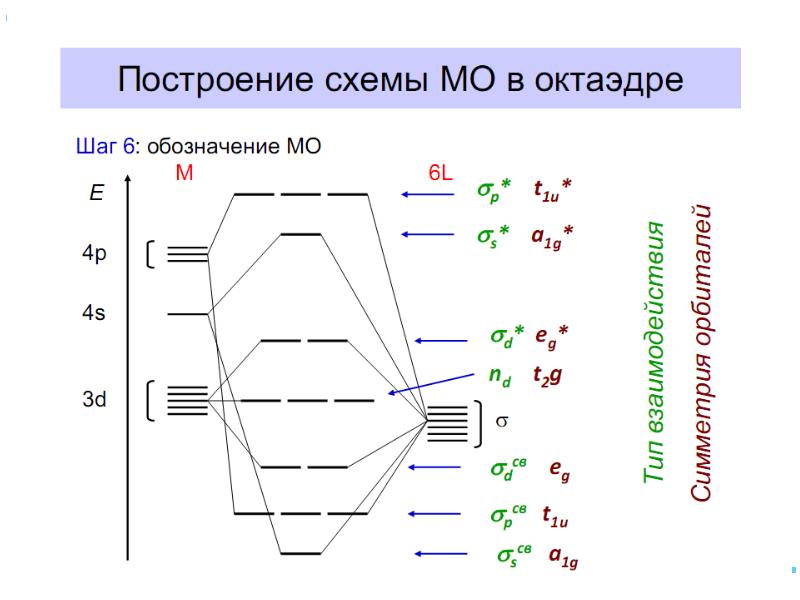
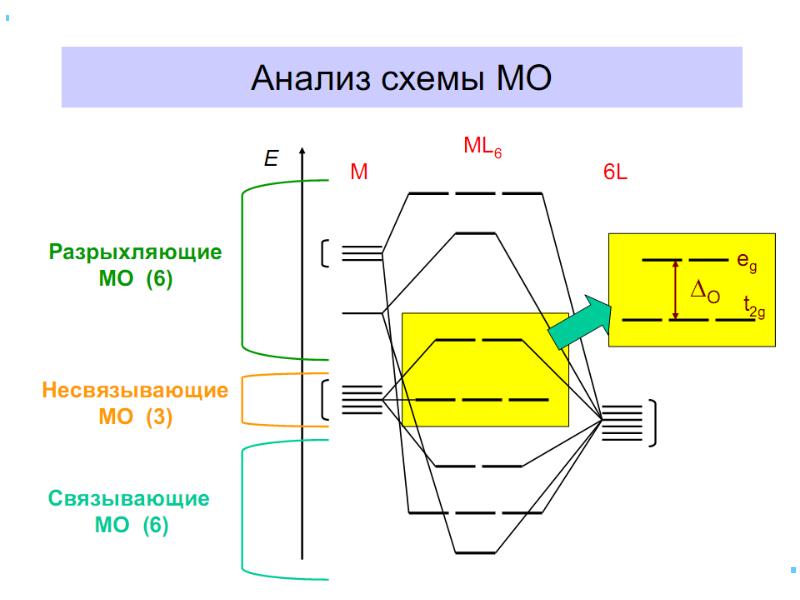
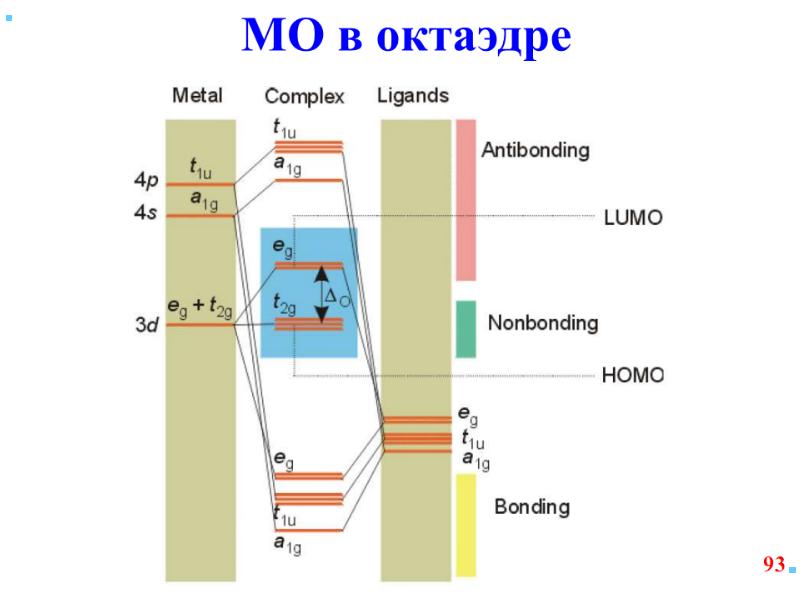
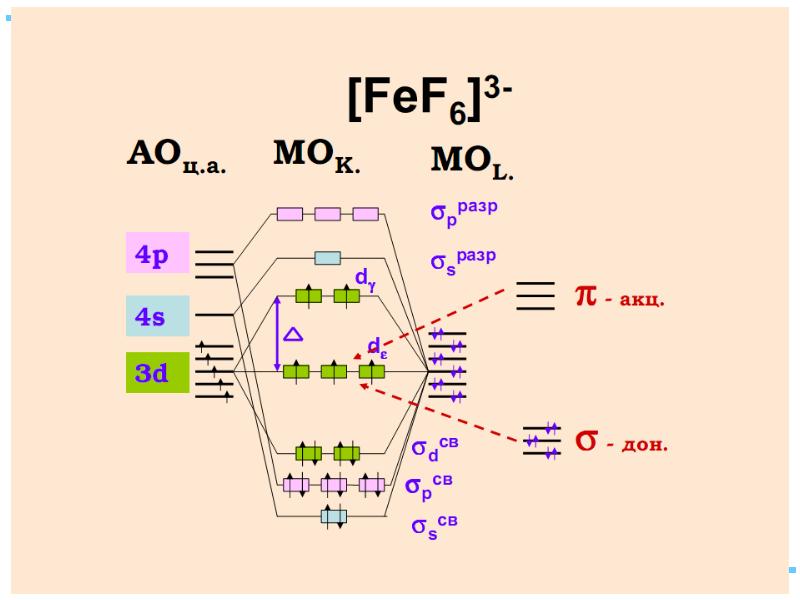
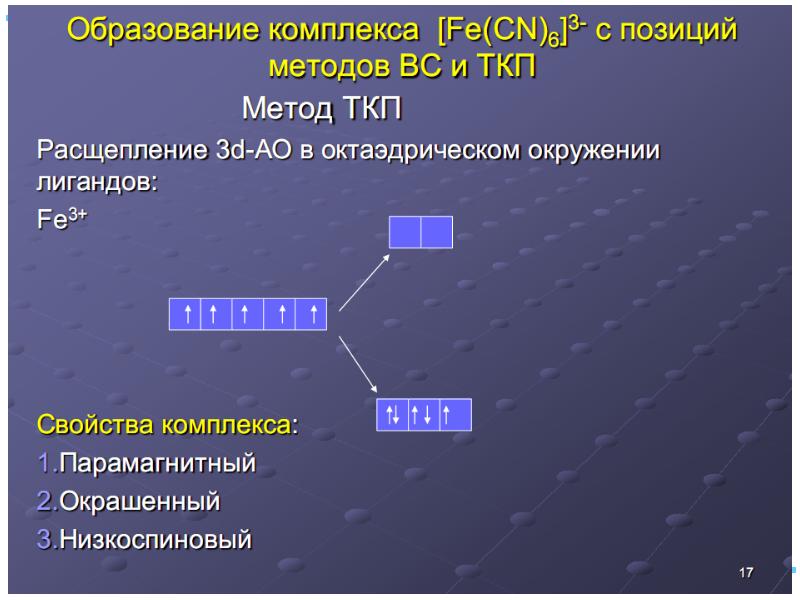
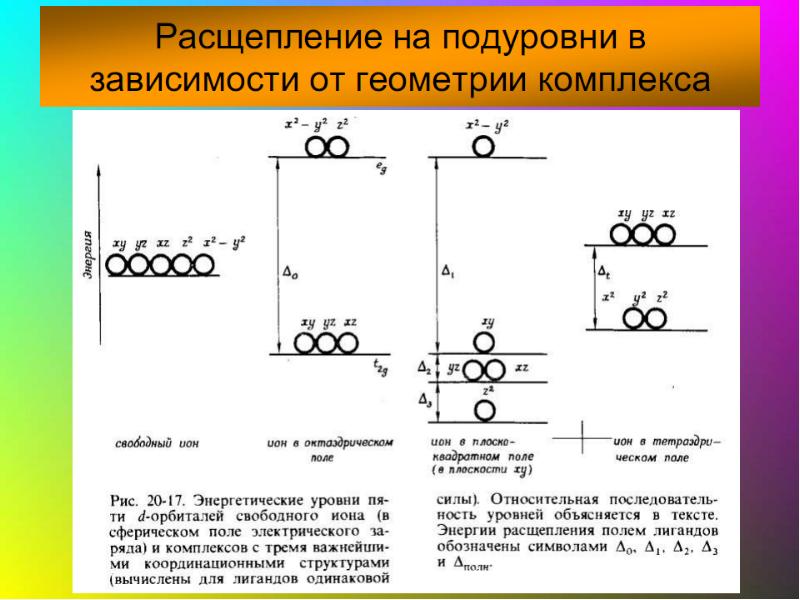
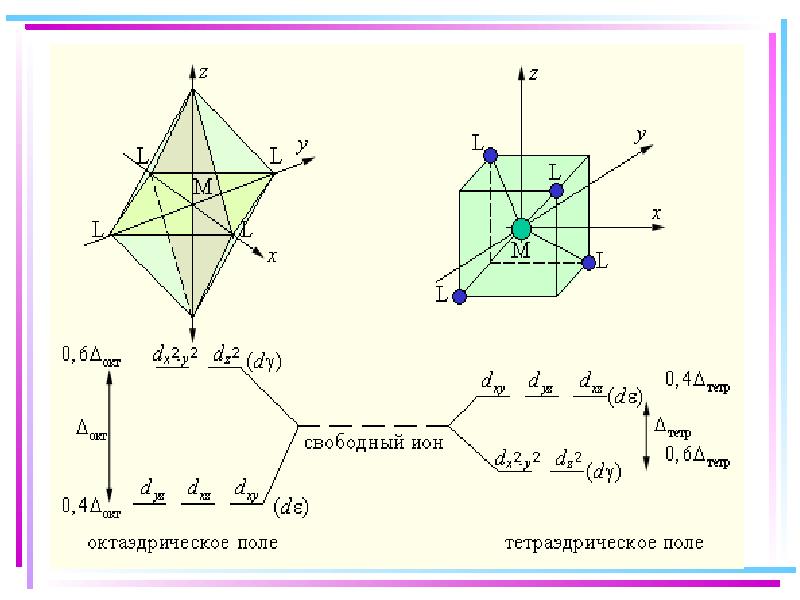
- 42. В случае [ML6]±,0 : октаэдрическое поле лигандов Поле слабо влияет (энергия
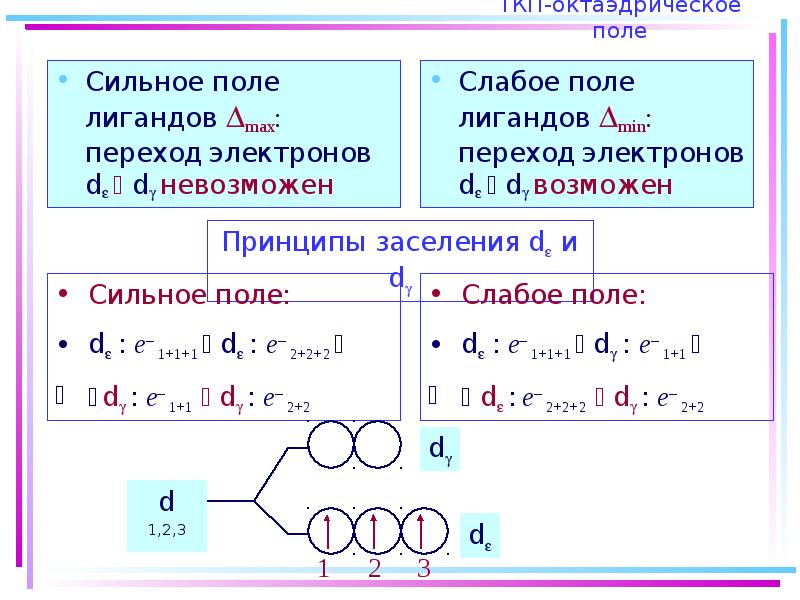
- 43. ТКП-октаэдрическое поле Сильное поле лигандов max: переход электронов d d
- 44. Параметр расщепления и волновое число 1 см–1 соответствует ок.
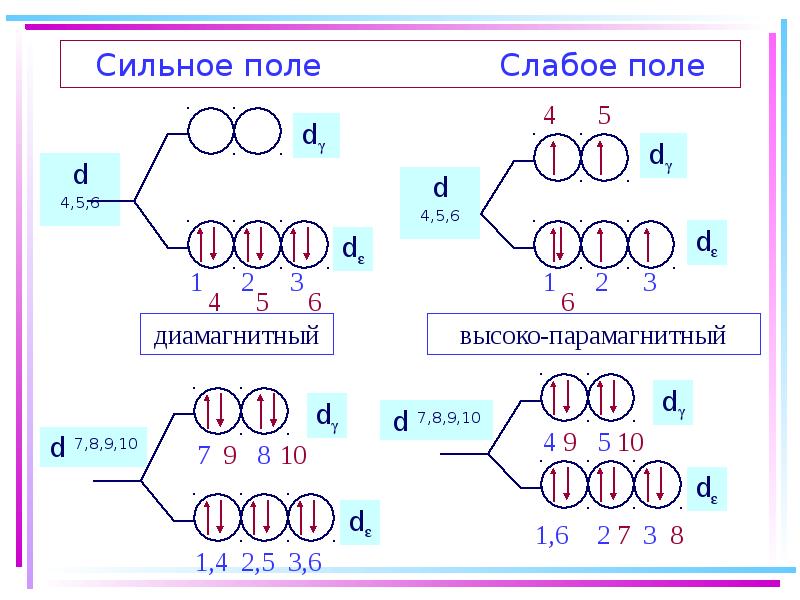
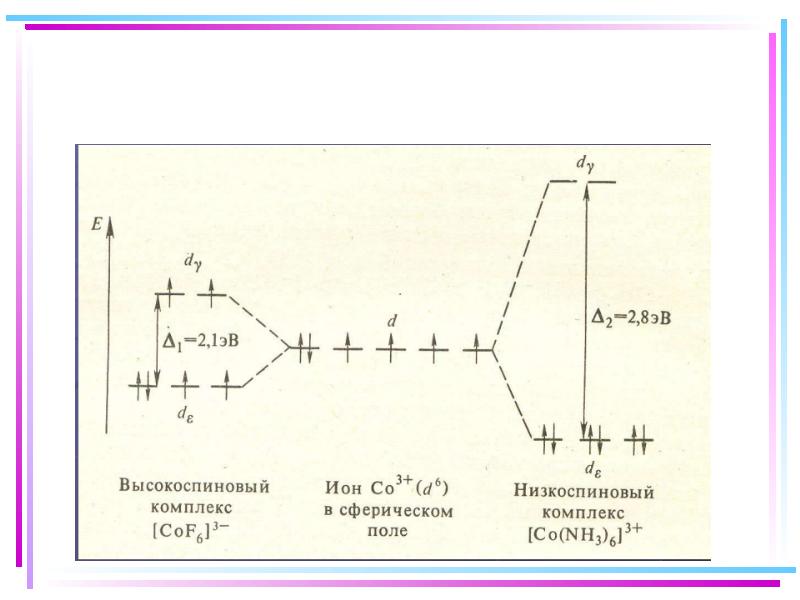
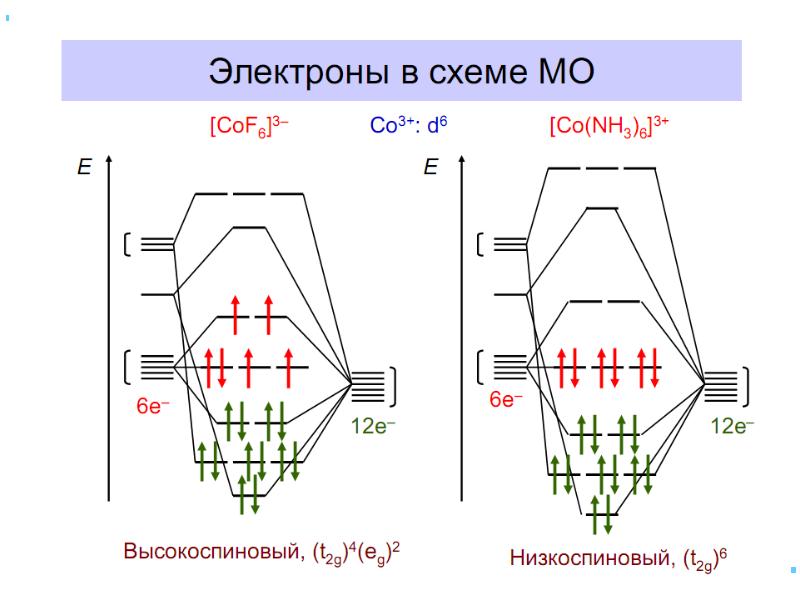
- 45. Сильное поле Слабое поле
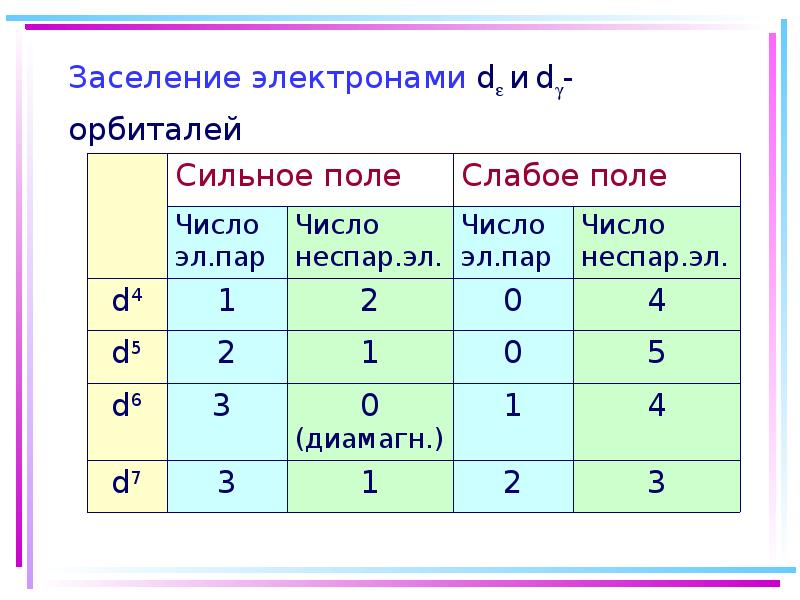
- 46. Заселение электронами d и d-орбиталей
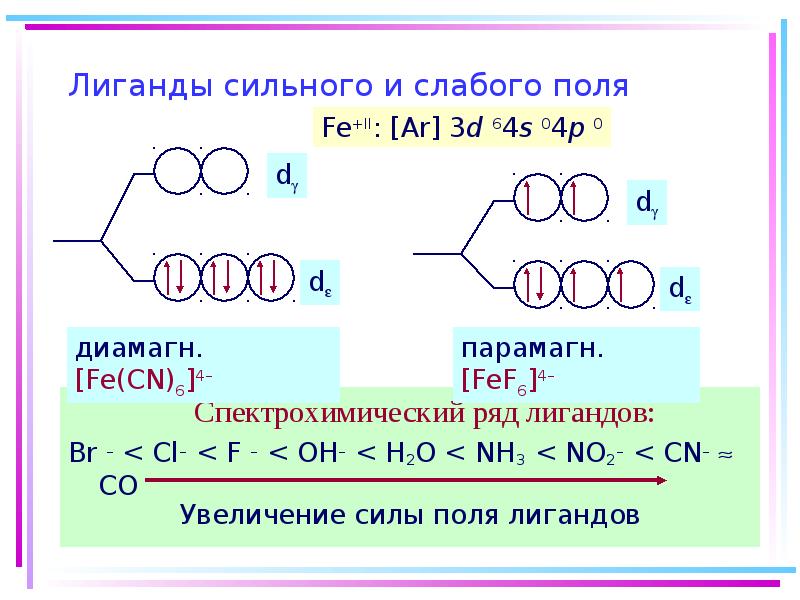
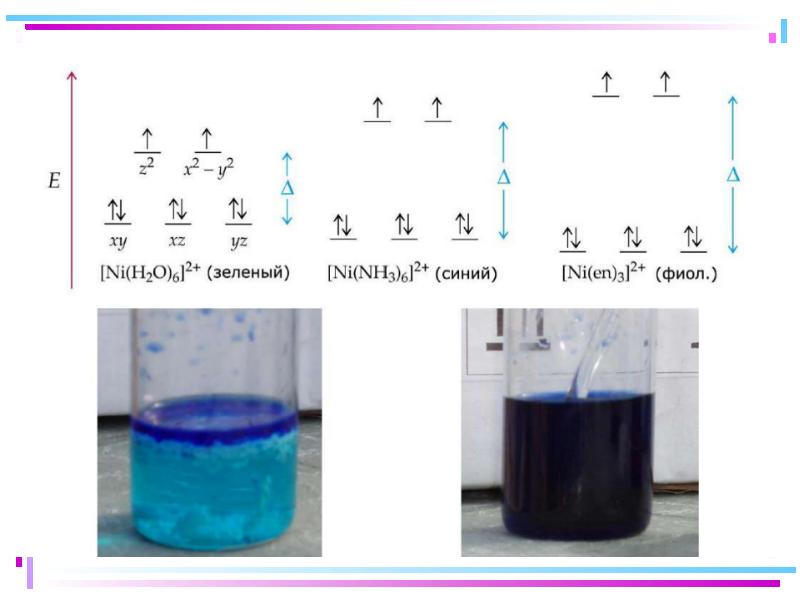
- 47. Лиганды сильного и слабого поля Спектрохимический ряд лигандов: Br – <
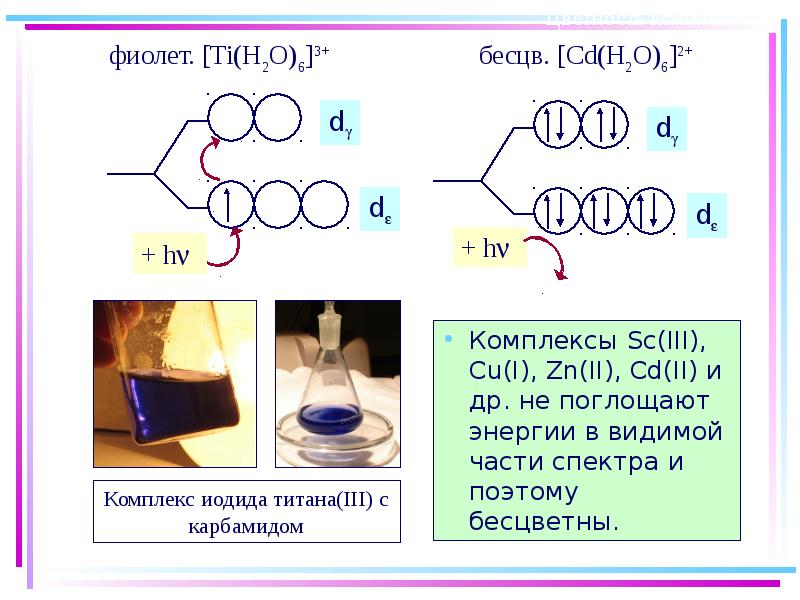
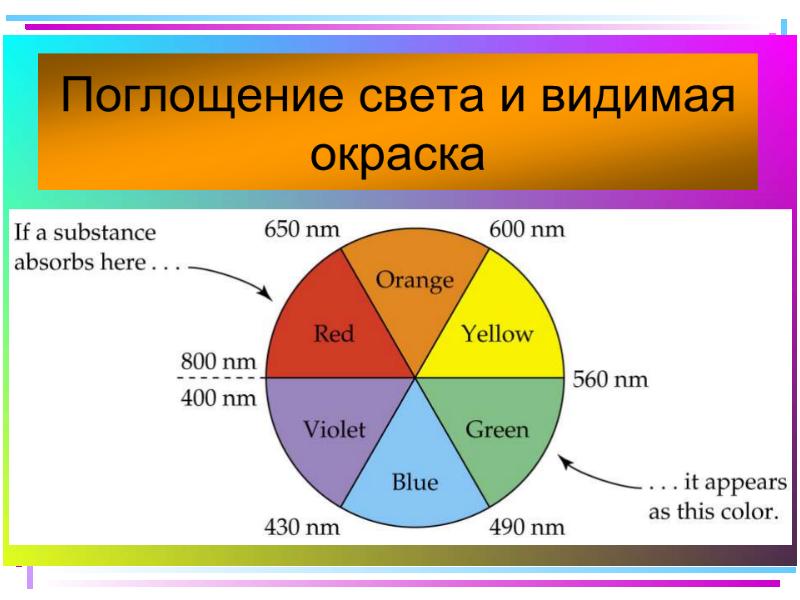
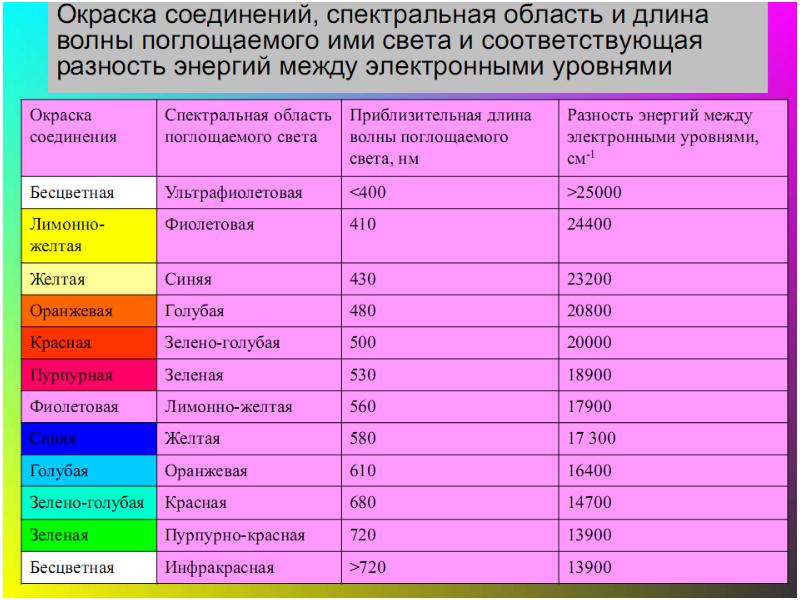
- 48. Цветность комплексных соединений При облучении образца в-ва светом видимой части спектра
- 49. Цветность комплексов Комплексы Sc(III), Cu(I), Zn(II), Cd(II) и др. не поглощают
- 50. Типы комплексных соединений. 1. Аквакомплексы В водных растворах: [Be(H2O)4]2+
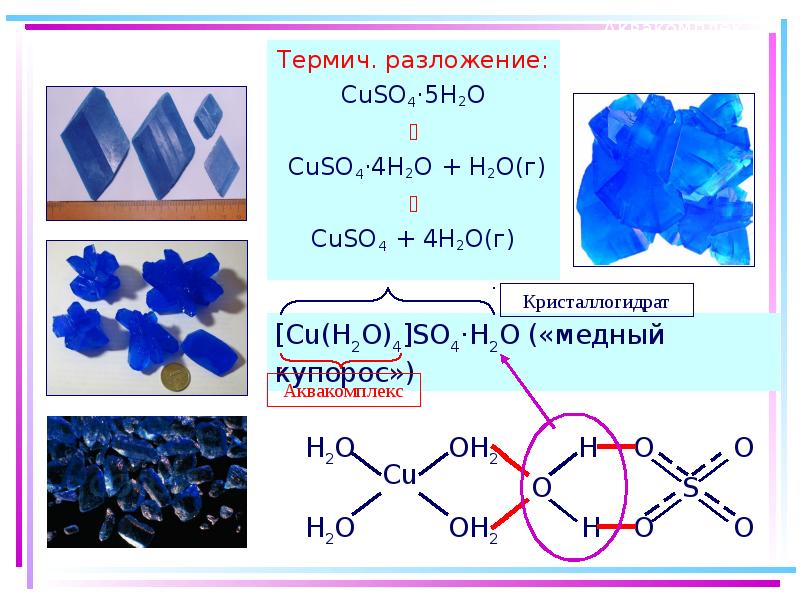
- 51. Аквакомплексы Термич. разложение: CuSO4·5H2O CuSO4·4H2O + H2O(г) CuSO4 +
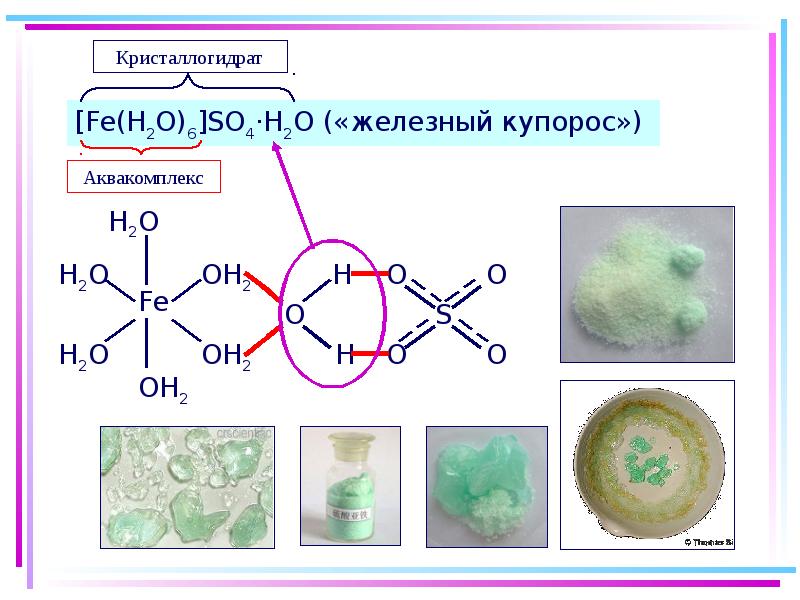
- 52. Аквакомплексы
- 53. 2. Гидроксокомплексы Получение: Zn(OH)2 + 2OH–(изб.) = [Zn(OH)4]2–; pH >>
- 54. 3. Аммины (аммиакаты) Получение: AgCl(т) + 2NH3·H2O(изб.) = [Ag(NH3)2]+ +Cl–
- 55. 4. Ацидокомплексы Получение: HgI2(т) + 2I–(изб.) = [HgI4]2–
- 56. 6. Анионгалогенаты M[ЭГmГn] (Э, Г и Г – галогены) Получение:
- 57. 5. Гидридокомплексы Получение: 4 NaH + B(OCH3)3 = Na[BH4] +
- 58. 8. Карбонилы Получение: Ni(т) + 4CO(г) = [Ni(CO)4](ж) (ниже
- 59. Правило Сиджвика для определения состава комплексов
- 60. Правило Сиджвика (примеры) * 27Co0 [Ar]3d74s2 || 36Kr * 18 –
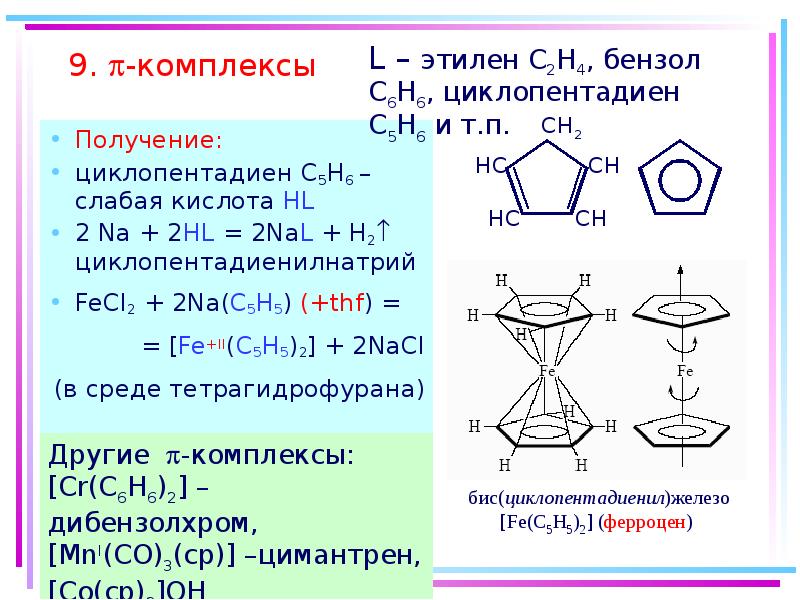
- 61. 9. -комплексы Получение: циклопентадиен С5H6 – слабая кислота HL 2 Na
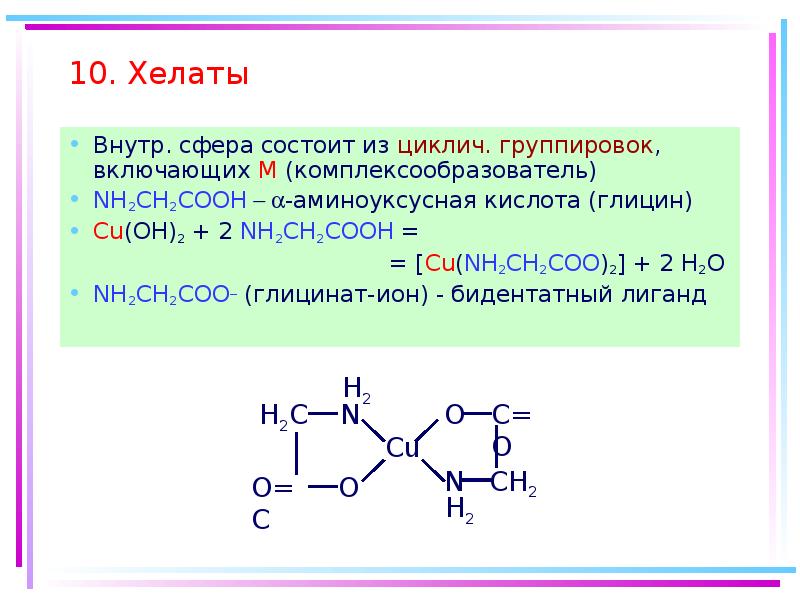
- 62. 10. Хелаты Внутр. сфера состоит из циклич. группировок, включающих M
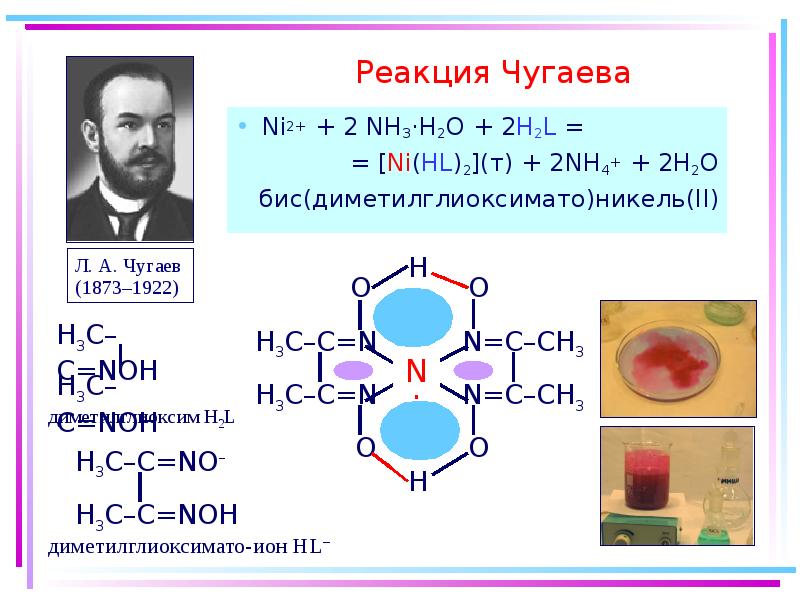
- 63. Реакция Чугаева Ni2+ + 2 NH3·H2O + 2H2L =
- 64. Методы синтеза комплексных соединений Реакция обмена лигандов А) в водном растворе
- 65. Методы синтеза комплексных соединений Д) ОВР + реакции обмена лигандов
- 66. Решение задач. 1. Растворение осадка при комплексообразовании AgBr(т) Ag+ +
- 67. Решение задач. 2. Реакция обмена лигандов [Co(NH3)6]3+ + 6 CN–
- 68. Решение задач. 3. Разрушение комплекса [Cu(NH3)4]2+ + 4 H3O+ [Cu(H2O)4]2+
- 69. Решение задач. 4. Направление реакции CuCN(т) + H2O + HCN
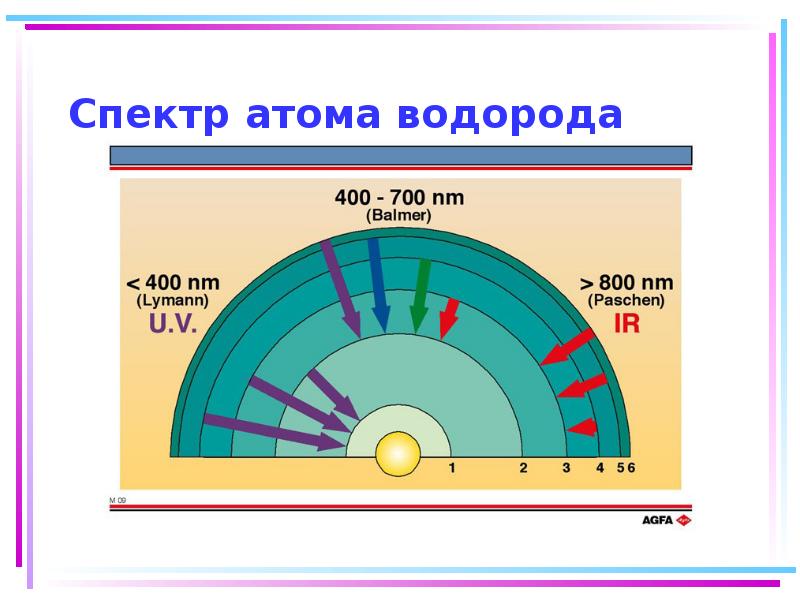
- 112. Спектр атома водорода
- 113. Спектр атома водорода
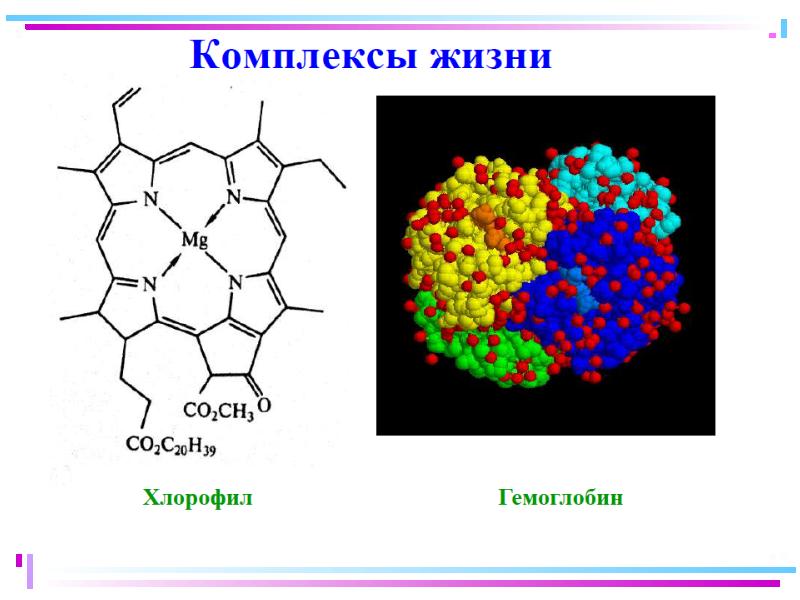
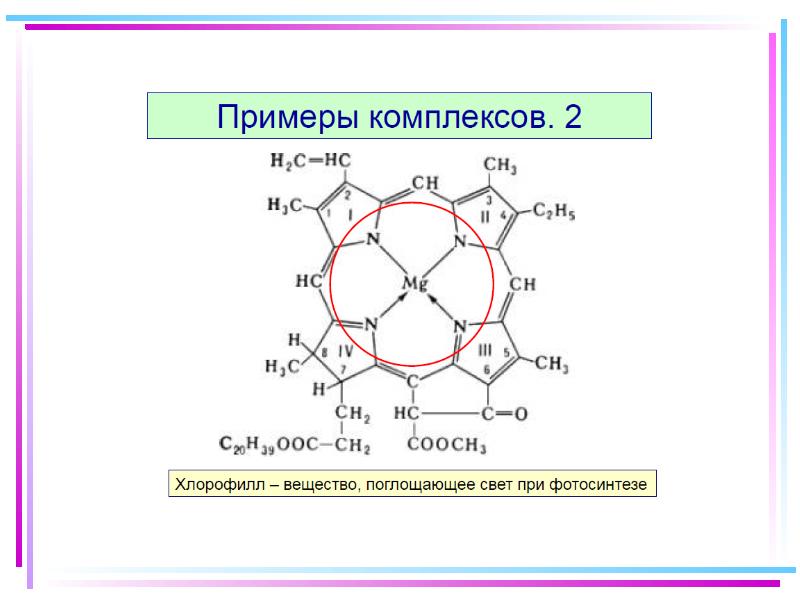
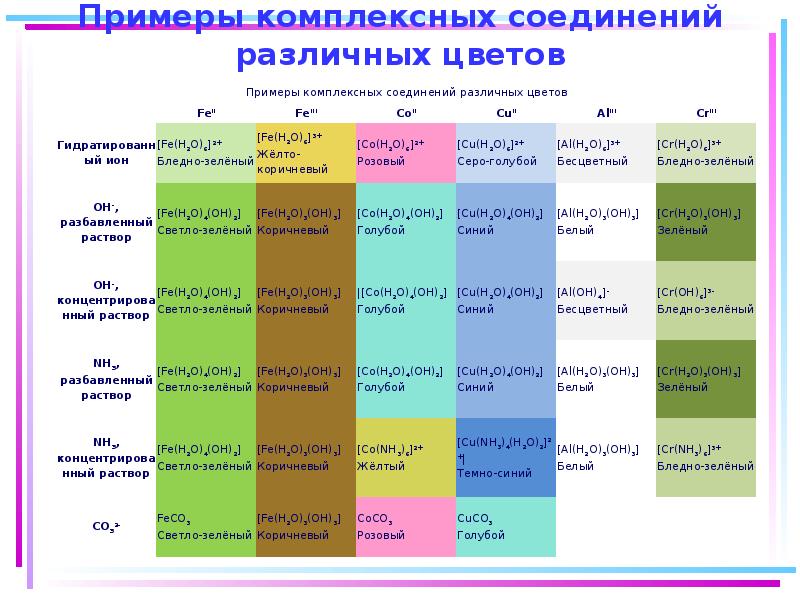
- 125. Примеры комплексных соединений различных цветов
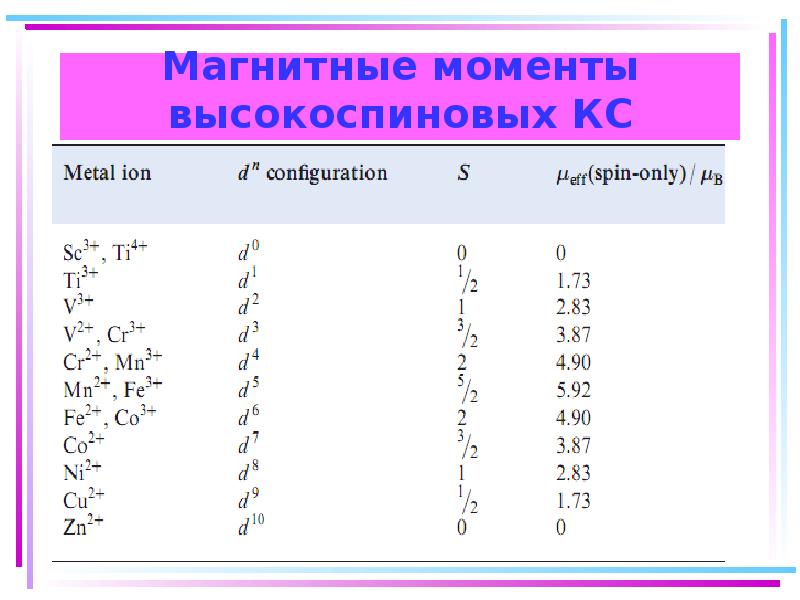
- 128. Магнитные моменты высокоспиновых КС
- 129. Содержание Введение Комплексные ионы Комплексные соединения Реакции комплексообразования
- 130. Глава 4. Изомерия комплексных соединений Глава 4. Изомерия комплексных соединений 4.1.
- 131. Глава 7. Типы комплексных соединений 7.1. Аквакомплексы 7.2. Гидроксокомплексы
- 132. Скачать презентацию


![Простые и комплексные соединения
HgI2 + 2KI = K2[HgI4]
SO3(т) + Простые и комплексные соединения
HgI2 + 2KI = K2[HgI4]
SO3(т) +](/documents_3/8421a5f28a3580fb4776cfaf2d584101/img4.jpg)


![Внутренняя сфера [комплекс] Внешняя сфера (противоион)
[Ni(NH3)6]Cl2
Внутренняя сфера [комплекс] Внешняя сфера (противоион)
[Ni(NH3)6]Cl2](/documents_3/8421a5f28a3580fb4776cfaf2d584101/img7.jpg)
![Комплексообразователь, лиганды, КЧ и дентатность. Примеры
[NH4]Cl – КЧ 4, дент.1
Комплексообразователь, лиганды, КЧ и дентатность. Примеры
[NH4]Cl – КЧ 4, дент.1](/documents_3/8421a5f28a3580fb4776cfaf2d584101/img8.jpg)
![2. Формулы и названия компл. соединений. [M(L+)(L0)(L–)]±,0
Число лигандов – 2. Формулы и названия компл. соединений. [M(L+)(L0)(L–)]±,0
Число лигандов –](/documents_3/8421a5f28a3580fb4776cfaf2d584101/img12.jpg)
![3. Названия комплексных соединений
А) Комплексы без внешней сферы
[MLn] 3. Названия комплексных соединений
А) Комплексы без внешней сферы
[MLn]](/documents_3/8421a5f28a3580fb4776cfaf2d584101/img13.jpg)
![Названия комплексных соединений
Б) Комплексный катион
[MLn]+X–
«анион Названия комплексных соединений
Б) Комплексный катион
[MLn]+X–
«анион](/documents_3/8421a5f28a3580fb4776cfaf2d584101/img14.jpg)
![Названия комплексных соединений
В) Комплексный анион
X+[MLn]–
«анион Названия комплексных соединений
В) Комплексный анион
X+[MLn]–
«анион](/documents_3/8421a5f28a3580fb4776cfaf2d584101/img15.jpg)
![Упражнения:
Na3[AgI(SO3S)2] –
бис(тиосульфато)аргентат(I) натрия
[PtII(py)4]2[FeII(CN)6] –
гексацианоферрат(II) тетрапиридинплатины(II)
Упражнения:
Na3[AgI(SO3S)2] –
бис(тиосульфато)аргентат(I) натрия
[PtII(py)4]2[FeII(CN)6] –
гексацианоферрат(II) тетрапиридинплатины(II)](/documents_3/8421a5f28a3580fb4776cfaf2d584101/img16.jpg)



![Междусферная изомерия: 1) сольватная (гидратная); 2) ионная изомерия
[Co(en)2Cl2]Cl · Междусферная изомерия: 1) сольватная (гидратная); 2) ионная изомерия
[Co(en)2Cl2]Cl ·](/documents_3/8421a5f28a3580fb4776cfaf2d584101/img24.jpg)
![Междусферная изомерия
Ионные (ионизационные) изомеры
[Pt(NH3)4Cl2]Br2 и [Pt(NH3)4Br2]Cl2
[Pt(NH3)4SO4](OH)2 и Междусферная изомерия
Ионные (ионизационные) изомеры
[Pt(NH3)4Cl2]Br2 и [Pt(NH3)4Br2]Cl2
[Pt(NH3)4SO4](OH)2 и](/documents_3/8421a5f28a3580fb4776cfaf2d584101/img25.jpg)
![Комплексные соединения в растворах
Неэлектролиты (слабые электролиты) [Pt(NH3)2Cl2] (ср. H2O2, CO(NH2)2 Комплексные соединения в растворах
Неэлектролиты (слабые электролиты) [Pt(NH3)2Cl2] (ср. H2O2, CO(NH2)2](/documents_3/8421a5f28a3580fb4776cfaf2d584101/img26.jpg)
![Реакции обмена лигандов
[MLn] + H2O [MLn-1(H2O)] + L0 (n Реакции обмена лигандов
[MLn] + H2O [MLn-1(H2O)] + L0 (n](/documents_3/8421a5f28a3580fb4776cfaf2d584101/img27.jpg)



![Сравнение устойчивости аммиачных комплексов
Ступени комплексообразования
[Cu(NH3)2]+ K2(обр) = 5,0·104
Сравнение устойчивости аммиачных комплексов
Ступени комплексообразования
[Cu(NH3)2]+ K2(обр) = 5,0·104](/documents_3/8421a5f28a3580fb4776cfaf2d584101/img32.jpg)


![В случае [ML6]±,0 : октаэдрическое поле лигандов
Поле слабо влияет (энергия В случае [ML6]±,0 : октаэдрическое поле лигандов
Поле слабо влияет (энергия](/documents_3/8421a5f28a3580fb4776cfaf2d584101/img41.jpg)


![Типы комплексных соединений. 1. Аквакомплексы
В водных растворах:
[Be(H2O)4]2+ Типы комплексных соединений. 1. Аквакомплексы
В водных растворах:
[Be(H2O)4]2+](/documents_3/8421a5f28a3580fb4776cfaf2d584101/img49.jpg)
![2. Гидроксокомплексы
Получение:
Zn(OH)2 + 2OH–(изб.) = [Zn(OH)4]2–; pH 2. Гидроксокомплексы
Получение:
Zn(OH)2 + 2OH–(изб.) = [Zn(OH)4]2–; pH](/documents_3/8421a5f28a3580fb4776cfaf2d584101/img52.jpg)
![3. Аммины (аммиакаты)
Получение:
AgCl(т) + 2NH3·H2O(изб.) = [Ag(NH3)2]+ +Cl– 3. Аммины (аммиакаты)
Получение:
AgCl(т) + 2NH3·H2O(изб.) = [Ag(NH3)2]+ +Cl–](/documents_3/8421a5f28a3580fb4776cfaf2d584101/img53.jpg)
![4. Ацидокомплексы
Получение:
HgI2(т) + 2I–(изб.) = [HgI4]2–
4. Ацидокомплексы
Получение:
HgI2(т) + 2I–(изб.) = [HgI4]2–](/documents_3/8421a5f28a3580fb4776cfaf2d584101/img54.jpg)
![6. Анионгалогенаты M[ЭГmГn] (Э, Г и Г – галогены)
Получение:
6. Анионгалогенаты M[ЭГmГn] (Э, Г и Г – галогены)
Получение:](/documents_3/8421a5f28a3580fb4776cfaf2d584101/img55.jpg)
![5. Гидридокомплексы
Получение:
4 NaH + B(OCH3)3 = Na[BH4] + 5. Гидридокомплексы
Получение:
4 NaH + B(OCH3)3 = Na[BH4] +](/documents_3/8421a5f28a3580fb4776cfaf2d584101/img56.jpg)
 8. Карбонилы
Получение:
Ni(т) + 4CO(г) = [Ni(CO)4](ж)](/documents_3/8421a5f28a3580fb4776cfaf2d584101/img57.jpg)

![Правило Сиджвика (примеры)
* 27Co0 [Ar]3d74s2 || 36Kr
* 18 – Правило Сиджвика (примеры)
* 27Co0 [Ar]3d74s2 || 36Kr
* 18 –](/documents_3/8421a5f28a3580fb4776cfaf2d584101/img59.jpg)



![Решение задач. 2. Реакция обмена лигандов
[Co(NH3)6]3+ + 6 CN– Решение задач. 2. Реакция обмена лигандов
[Co(NH3)6]3+ + 6 CN– ](/documents_3/8421a5f28a3580fb4776cfaf2d584101/img66.jpg)
![Решение задач. 3. Разрушение комплекса
[Cu(NH3)4]2+ + 4 H3O+ [Cu(H2O)4]2+ Решение задач. 3. Разрушение комплекса
[Cu(NH3)4]2+ + 4 H3O+ [Cu(H2O)4]2+](/documents_3/8421a5f28a3580fb4776cfaf2d584101/img67.jpg)


















Слайды и текст этой презентации
Скачать презентацию на тему Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе можно ниже:
Похожие презентации





























