Закон сохранения массы веществ. Химические уравнения презентация
Содержание
- 2. Закон сохранения массы веществ. Химические уравнения. 1748 г – Михаил Васильевич
- 3. Закон сохранения массы веществ. Химические уравнения. 1748 - Михаил Васильевич Ломоносов
- 4. масса реагентов = массе продуктов
- 5. Закон сохранения массы веществ. Химические уравнения.
- 6. Формулы простых веществ записываются символом без индекса, кроме:
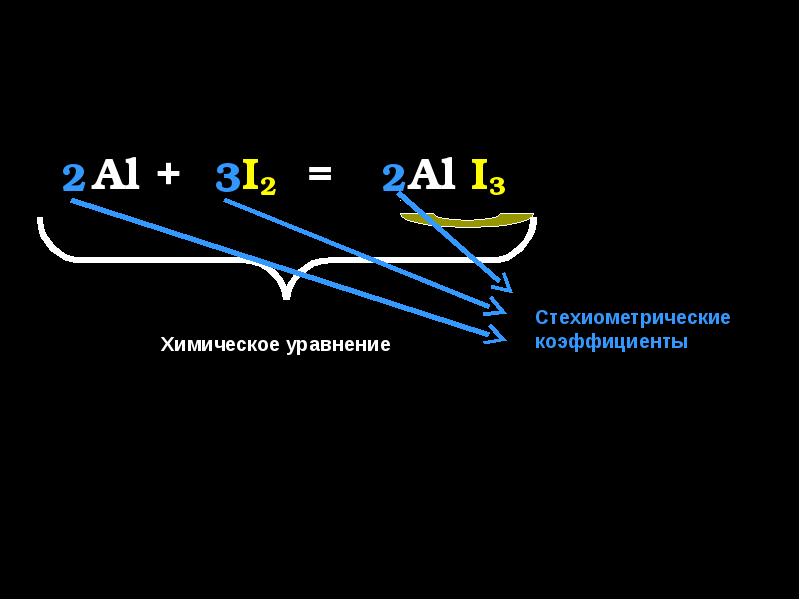
- 7. При взаимодействии алюминия с йодом образовался иодид алюминия
- 8. Al + I2 = Al I3
- 9. Na + S Na2S Na + S Na2S Na
- 10. O2 + P = N2 +
- 11. Химическое уравнение – это условная запись химической реакции посредством химических формул
- 12. Горение простых веществ – это взаимодействие простого вещества с кислородом О2
- 13. Д.З.: § 14, 15, № 4 стр. 47
- 16. Бинарные соединения можно получить при взаимодействии простых веществ.
- 17. Определите валентность марганца в следующих соединениях: Mn2O7, MnO2, MnCl2, MnO. Определите
- 20. При взаимодействии алюминия с йодом образовался иодид алюминия
- 21. Скачать презентацию


















Слайды и текст этой презентации
Скачать презентацию на тему Закон сохранения массы веществ. Химические уравнения можно ниже:
Похожие презентации





























