Закономерности протекания химических процессов. Основы химической термодинамики. (Лекция 2) презентация
Содержание
- 2. Лекция 2. Закономерности протекания химических процессов Основы химической термодинамики П Л
- 3. Предмет химической термодинамики Термодинамика (от греч. «термос» - теплота, «динамос» -
- 4. Химическая ТД изучает: превращения энергии при химических реакциях; энергетические эффекты, сопровождающие
- 5. Химическая ТД позволяет: Рассчитывать тепловые эффекты процессов и энергии связей
- 6. Основные понятия и определения ТД Объект исследования ТД - термодинамическая система
- 7. Классификация систем По взаимодействию с окружающей средой: Изолированные – не обменивается
- 8. Классификация систем По агрегатному состоянию: Гомогенные – состоящие из одной фазы.
- 9. Совокупность всех физических и химических свойств системы характеризует ее состояние.
- 10. Термодинамические функции – переменные величины, которые не могут быть непосредственно измерены
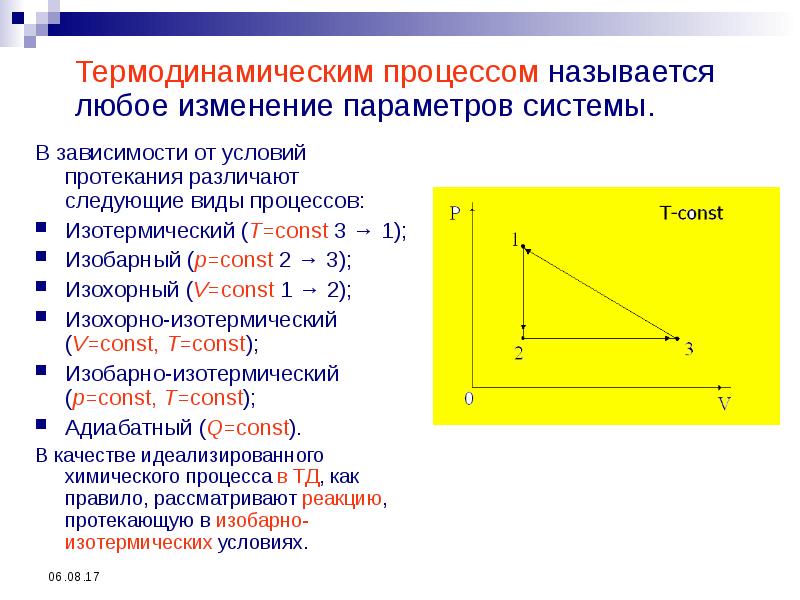
- 11. Термодинамическим процессом называется любое изменение параметров системы. В зависимости от условий
- 12. В зависимости от способа проведения термодинамические процессы могут быть: Самопроизвольные
- 13. Состояние системы, при котором ее свойства постоянны во времени и пространстве
- 14. Система, совершившая равновесный процесс, может вернуться в исходное состояние, которое она
- 15. Первый закон термодинамики Это закон сохранения энергии в изолированной системе. Энергия
- 16. Внутренняя энергия U Характеризует общий запас энергии в системе, включает в
- 17. Энергия может передаваться от одной системы к другой двумя путями: В
- 18. При совершении работы A против внешних сил (макроскопическая форма передачи энергии
- 19. Приложение первого закона ТД к различным процессам Изохорный процесс (V=const, dV=0,
- 20. Изобарный процесс (p=const, dp=0): Изобарный процесс (p=const, dp=0): δQр= dU +
- 21. Термохимия Это применение первого начала термодинамики к химическим процессам. Термохимия –
- 22. Основные термохимические законы Закон Лавуазье–Лапласа: Теплота разложения данного химического соединения на
- 23. Термохимические уравнения Химические уравнения, в которых указаны тепловые эффекты реакций и
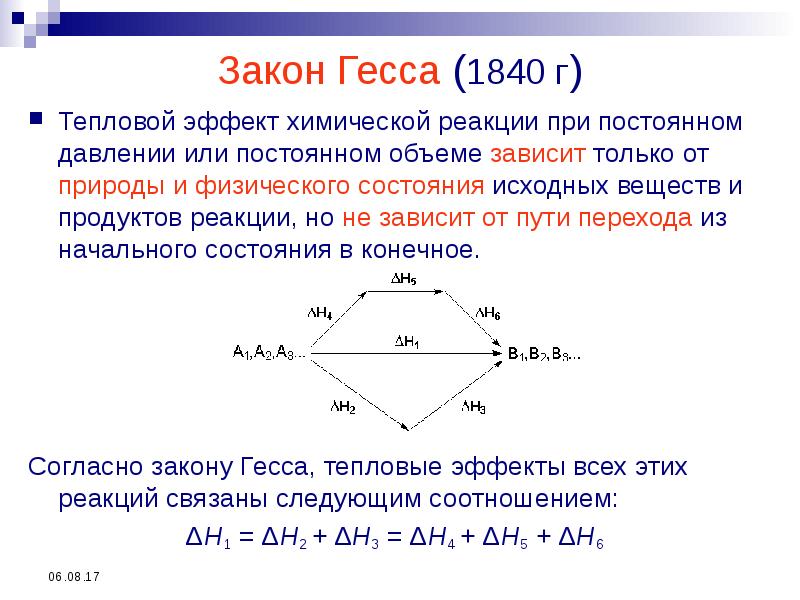
- 24. Закон Гесса (1840 г) Тепловой эффект химической реакции при постоянном давлении
- 25. На основании закона Гесса с термохимическими уравнениями можно оперировать так же,
- 26. Первое следствие закона Гесса: Энтальпия реакции равна сумме энтальпий образования продуктов
- 27. Задача 1. При взаимодействии кристаллического оксида алюминия и газообразного оксида серы(VI)
- 28. Задача 2. Учитывая термохимическое уравнение реакции: Н2(г) + F2(г) = 2HF(г)
- 29. Второе следствие закона Гесса: Энтальпия реакции равна сумме энтальпий сгорания исходных
- 30. I закон термодинамики и закон Гесса позволяют составить энергетический баланс процесса
- 31. Вопрос о направленности химического процесса решается в рамках II закона термодинамики.
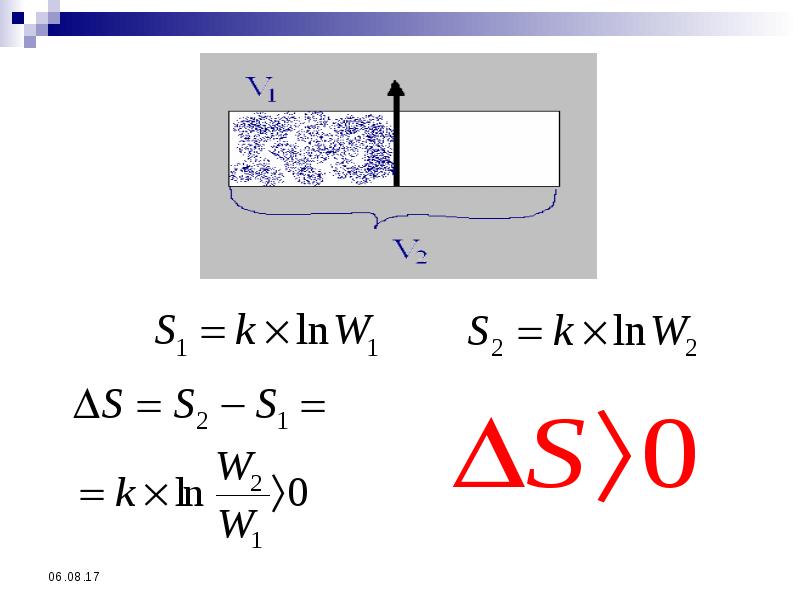
- 32. Понятие об энтропии Состояние вещества можно охарактеризовать двояко: Указать конкретные
- 33. Число микросостояний, с помощью которых можно осуществить данное макросостояние, - термодинамическая
- 35. II Закон термодинамики В изолированной системе самопроизвольные процессы происходят в направлении
- 36. Второй закон термодинамики Невозможен самопроизвольный переход теплоты от холодного тела к
- 37. Энтропия – приведенная теплота (формулировка Клаузиуса) Если система получает некоторое количество
- 38. Изменение энтропии при различных процессах Нагревание вещества: ΔS > 0; Охлаждение:
- 39. Сложность строения молекул: Сложность строения молекул: а) аллотропия – чем вещество
- 40. III Закон термодинамики (постулат Планка) При температуре абсолютного нуля (Т =
- 41. Расчет энтропии S – термодинамическая функция состояния. Единицы измерения: [Дж/моль×К].
- 42. Зависимость ΔH° и ΔS° от температуры Теплоемкостью с называется количество теплоты,
- 43. Для расчета ΔH при заданной температуре интегрируем уравнение Кирхгофа: Для расчета
- 44. При использовании средних теплоемкостей (таблицы): При использовании средних теплоемкостей (таблицы): Δср
- 45. Критерии направленности самопроизвольного процесса Изолированная система (dU=0; dV=0): dS ≥
- 46. ■ Процессы, протекающие при постоянных
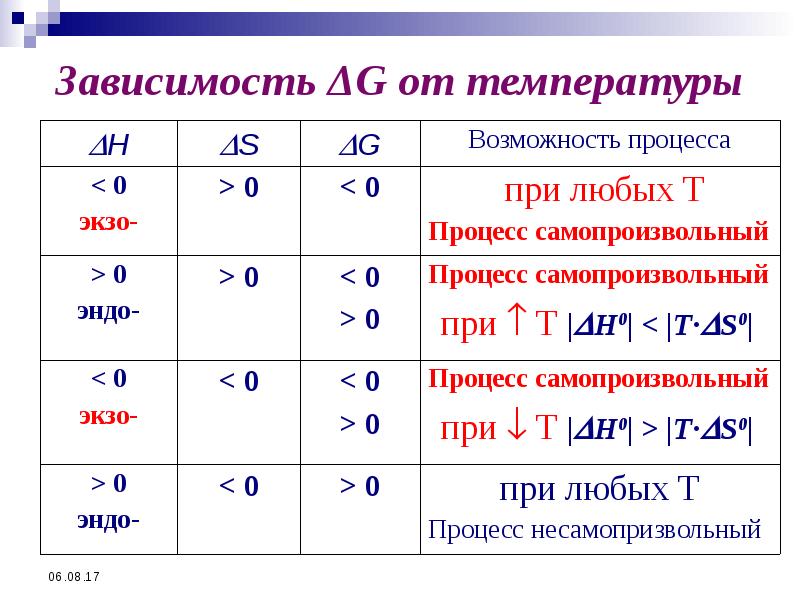
- 47. В закрытой системе в изобарно-изотермических условиях знак изменения dG - критерий
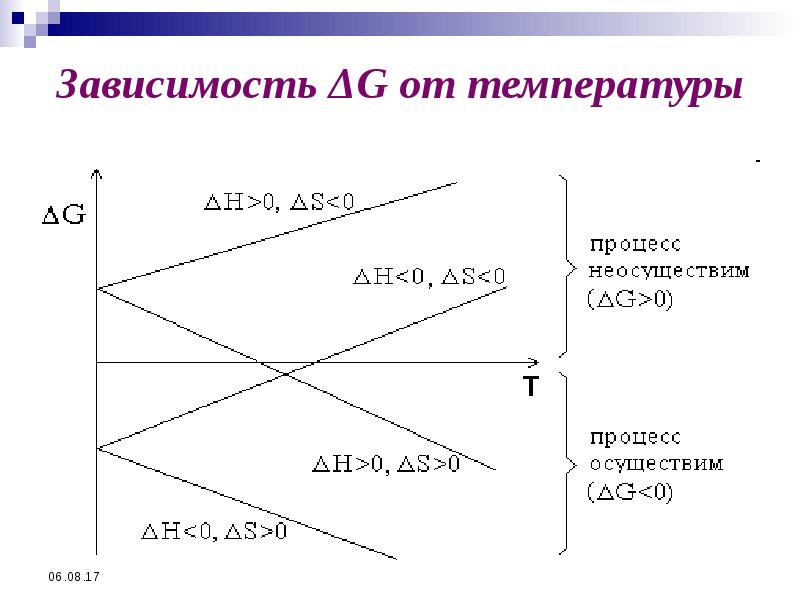
- 48. Зависимость ΔG от температуры
- 49. Зависимость ΔG от температуры
- 50. Расчет энергии Гиббса Изменение энергии Гиббса можно вычислить по формуле: G0Т
- 51. Химическое равновесие Большинство химический реакций обратимо, т.е. протекает одновременно в противоположных
- 52. Термодинамическим равновесием называется такое термодинамическое состояние системы, которое при постоянстве внешних
- 53. Количественной характеристикой химического равновесия является константа равновесия, которая может быть выражена
- 54. Уравнение изотермы химической реакции Устанавливает связь между G0 и константой равновесия
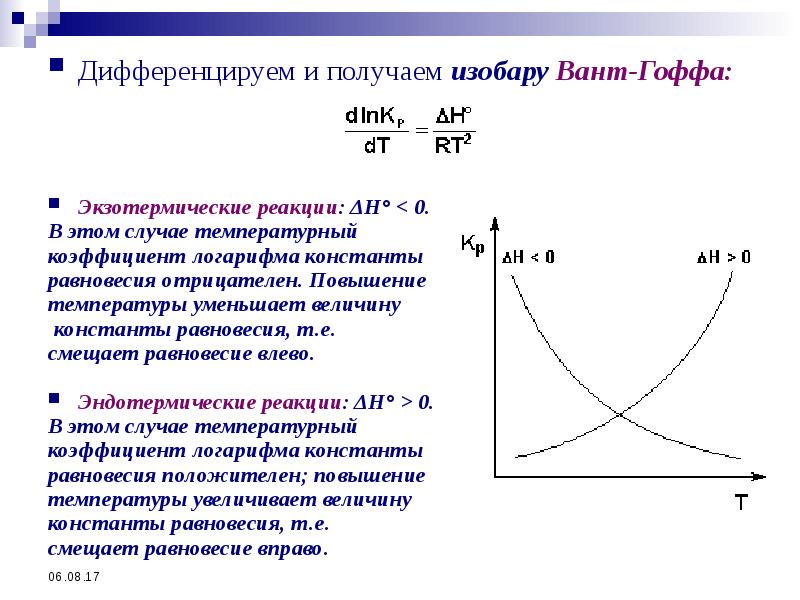
- 55. Зависимость Кр от температуры По уравнению изотермы можно рассчитать Кр: Кр
- 56. Дифференцируем и получаем изобару Вант-Гоффа: Дифференцируем и получаем изобару Вант-Гоффа:
- 57. Уравнение изотермы химической реакции Устанавливает связь между G0 и константой равновесия
- 58. Скачать презентацию





































![Расчет энтропии
S – термодинамическая функция состояния.
Единицы измерения: [Дж/моль×К].
Расчет энтропии
S – термодинамическая функция состояния.
Единицы измерения: [Дж/моль×К].](/documents_3/ccb7e03107a3b9cc53d6128317f4dc04/img40.jpg)













Слайды и текст этой презентации
Скачать презентацию на тему Закономерности протекания химических процессов. Основы химической термодинамики. (Лекция 2) можно ниже:
Похожие презентации