Закономірності протікання хімічних реакцій презентация
Содержание
- 2. План
- 3. Тепловий ефект хімічної реакції – Q – це кількість теплоти ,
- 4. Види систем Відкриті Закриті Ізольовані Гомогенні Гетерогенні Ізобарні Ізохорні
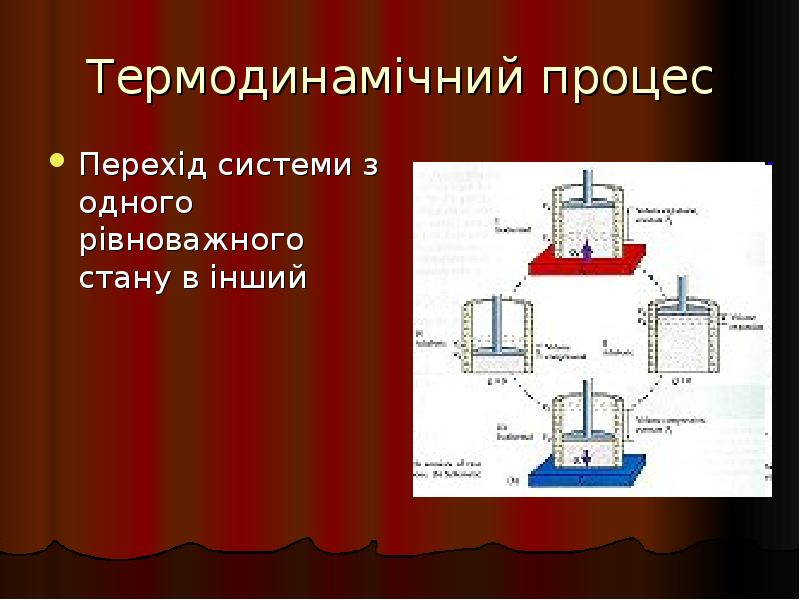
- 5. Термодинамічний процес Перехід системи з одного рівноважного стану в інший
- 6. Параметри систем Параметри – це показники, що характеризують стан системи: температура,
- 7. Функції стану системи Внутрішня енергія системи (U)– це загальний запас енергії
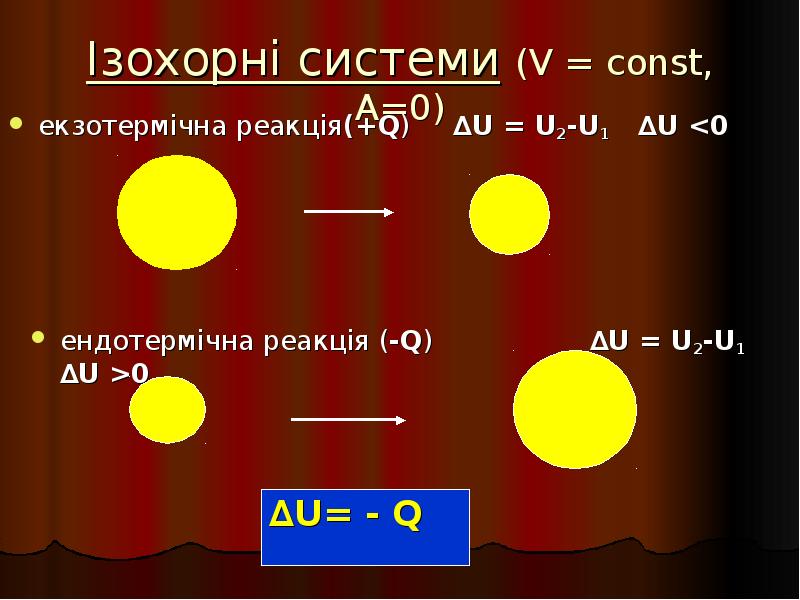
- 8. Ізохорні системи (V = const, A=0) екзотермічна реакція(+Q) ∆U =
- 9. ЕНТАЛЬПІЯ U + P∙ V = H – ентальпія – тепловмість
- 10. Ізобарні системи (Р = const, A0) Перший закон термодинаміки (1847
- 11. Закони термохімії Закон Лавуазьє-Лапласа: Ентальпія утворення даної сполуки чисельно
- 12. Закон Гесса Тепловий ефект залежить тільки від стану вихідних і кінцевих
- 13. Наслідки з закону Гесса Hх.р. = nHутв. продуктів - nHутв.
- 14. Залежність теплового ефекту від температури Теплоємність (середня) системи дорівнює кількості
- 15. Залежність теплоємності від температури При сталому тиску теплота отримана системою
- 16. Залежність Кірхгофа інтегрування рівняння теплоємності від Т1 до Т2 отримаємо залежність
- 17. Принцип Бертло (1867р.): принцип самочинного перебігу хімічних реакцій: Самочинно протікають лише
- 18. Термодинамічна імовірність W Кількість мікростанів, з яких складається макроскопічний стан системи,
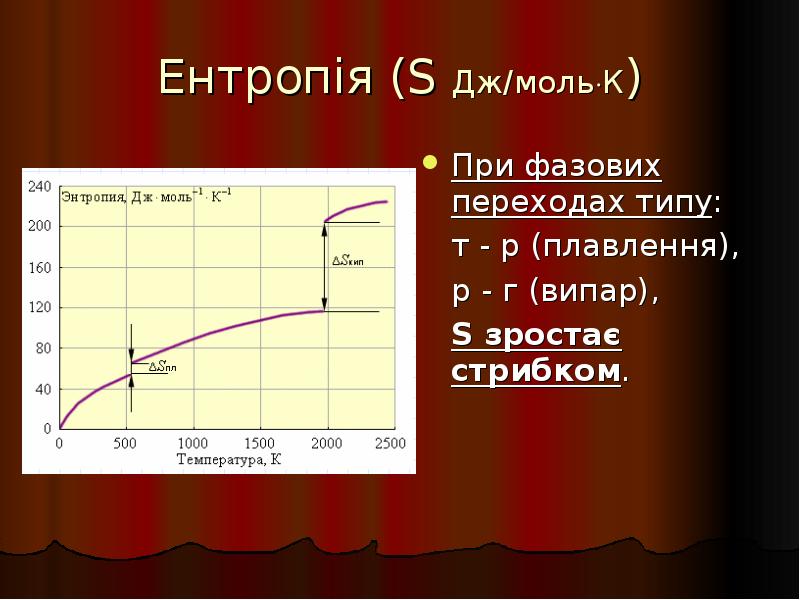
- 19. Ентропія (S Дж/мольК) При фазових переходах типу: т - р
- 20. Ентропія (S Дж/мольК) Кількісною мірою ймовірності стану, невпорядкованості, безладдя – є
- 21. ІІ – закон термодинаміки (1850 Р.Клаузиус ) Будь-яка ізольована система представлена
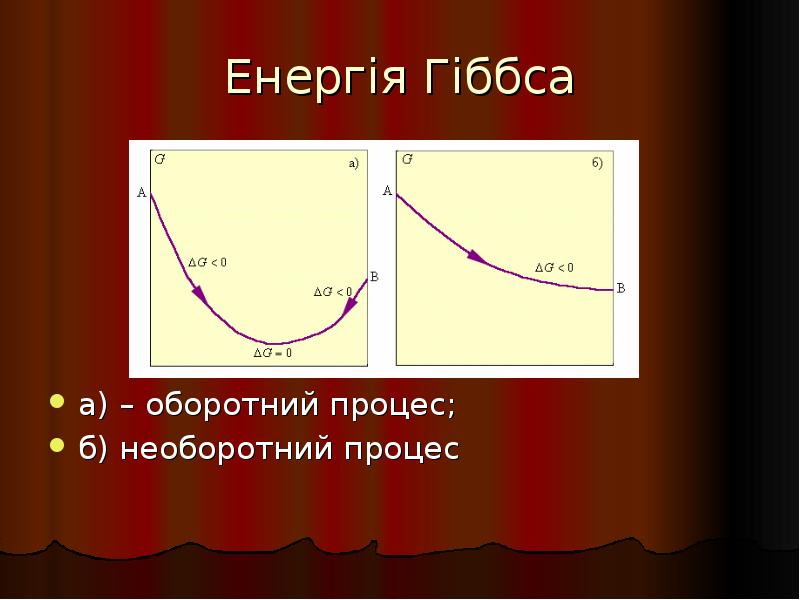
- 22. Енергія Гіббса
- 23. Енергія Гіббса а) – оборотний процес; б) необоротний процес
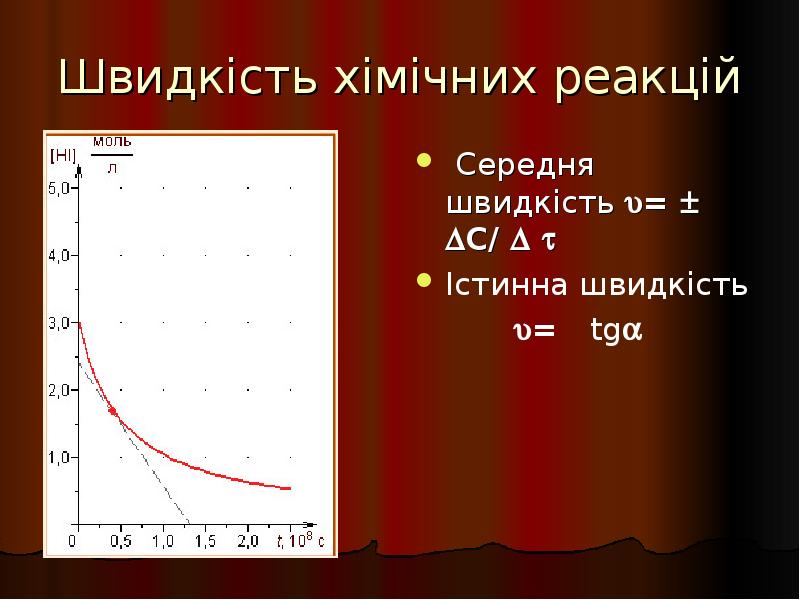
- 24. Швидкість хімічних реакцій Середня швидкість = C/ Істинна
- 25. Закон діючих мас (Гульдберг і Вааге, 1867р.) При постійній температурі
- 26. Залежність швидкості реакції від температури правило Вант-Гоффа швидкість збільшується приблизно
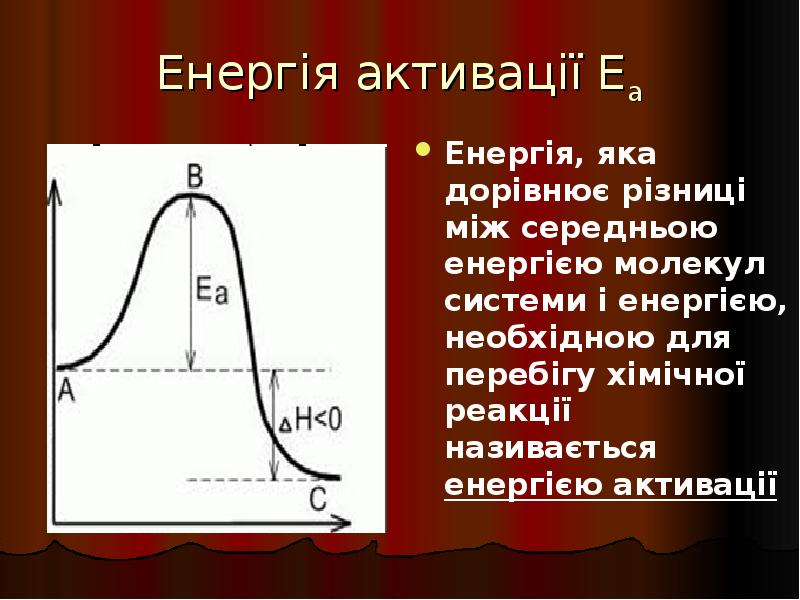
- 27. Енергія активації Еа
- 28. Рівняння Арреніуса Залежність швидкості реакції від температури й енергії активації
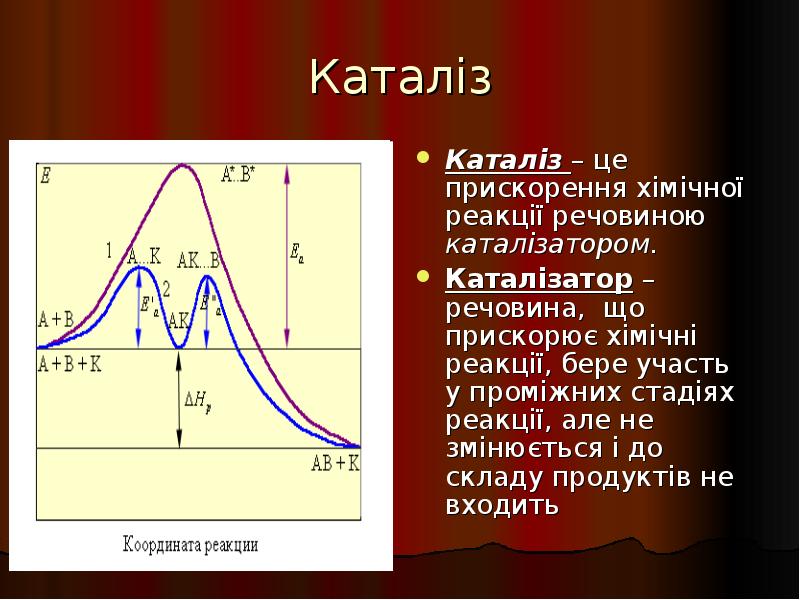
- 29. Каталіз Каталіз – це прискорення хімічної реакції речовиною каталізатором. Каталізатор –
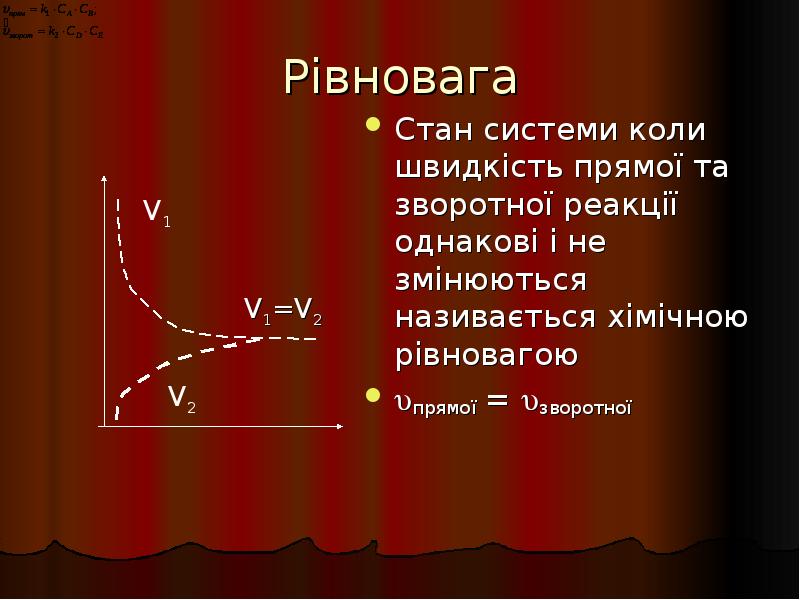
- 30. Рівновага Стан системи коли швидкість прямої та зворотної реакції однакові і
- 31. Константа хімічної рівноваги Реакція відбувається за рівнянням: А + В
- 32. Зміщення рівноваги Принцип Ле-Шательє: Якщо на систему, що знаходиться в
- 33. Каталізатор Каталізатор – речовина, що прискорює хімічні реакції, але сам якісно
- 34. Ферменти (ензими) В 1902 р. в лабораторії І. П. Павлова були
- 35. Склад ферментів Білкова частина – апофермент; Небілкова частина – кофактор може
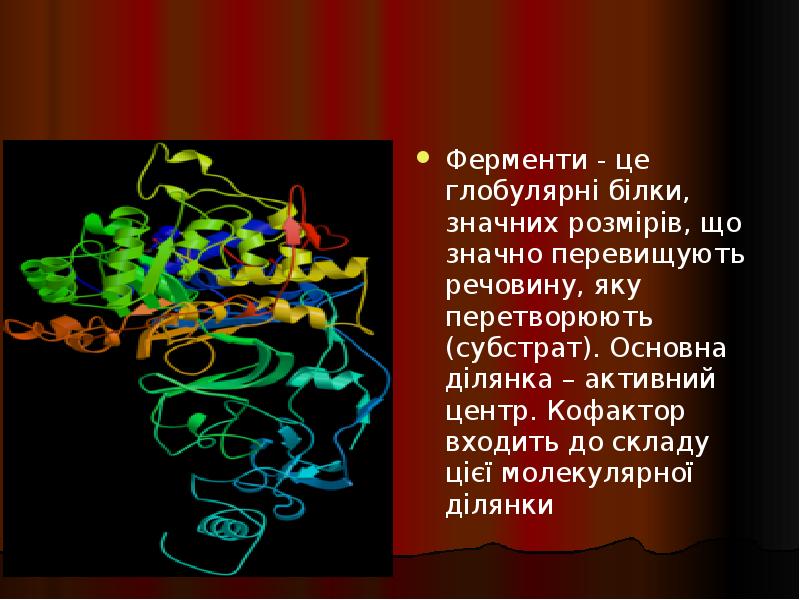
- 36. Ферменти - це глобулярні білки, значних розмірів, що значно перевищують речовину,
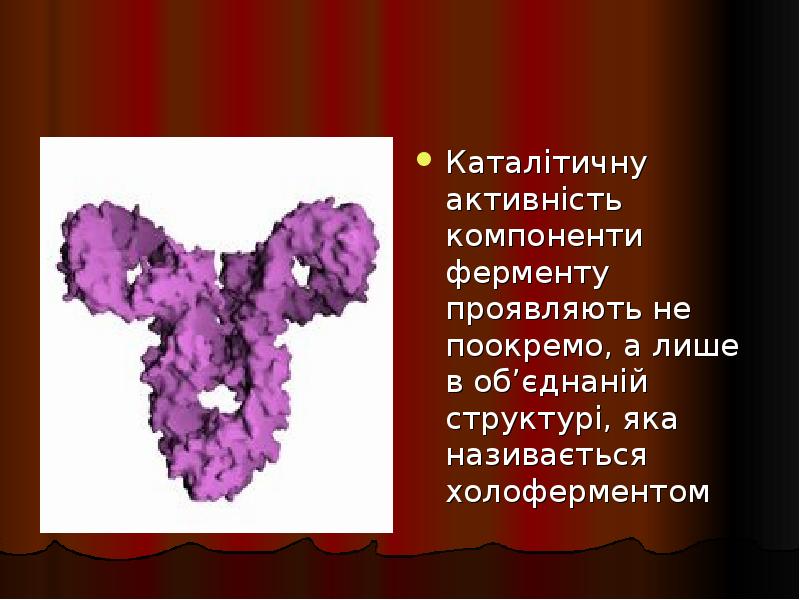
- 37. Каталітичну активність компоненти ферменту проявляють не поокремо, а лише в об’єднаній
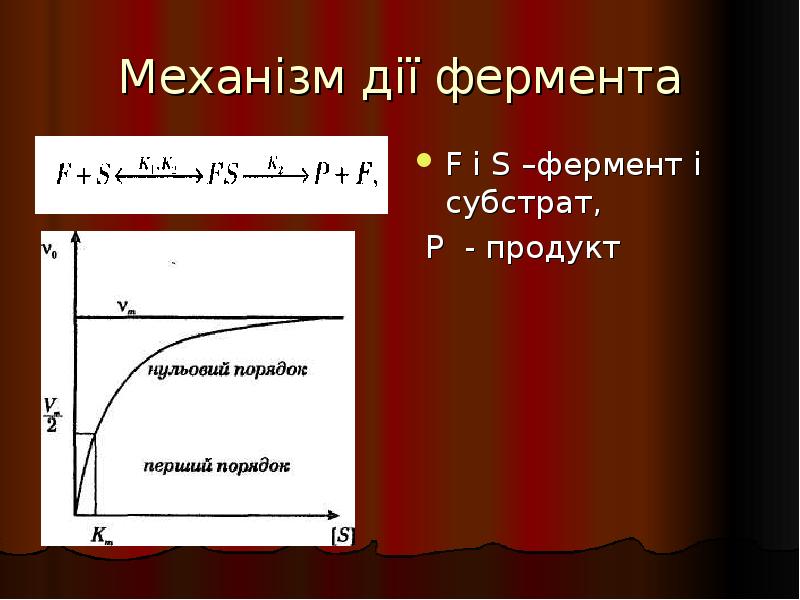
- 38. Механізм дії фермента F і S –фермент і субстрат, Р
- 39. Скачать презентацию



























Слайды и текст этой презентации
Скачать презентацию на тему Закономірності протікання хімічних реакцій можно ниже:
Похожие презентации





























