Эволюция понятия “валентность” презентация
Содержание
- 3. Эволюция понятия “валентность” – В начале XIX века Дж. Дальтоном
- 4. В конце 50-х гг. XIX вeка А.С. Купер и А.Кекуле постулировали
- 10. ЗАДАНИЕ
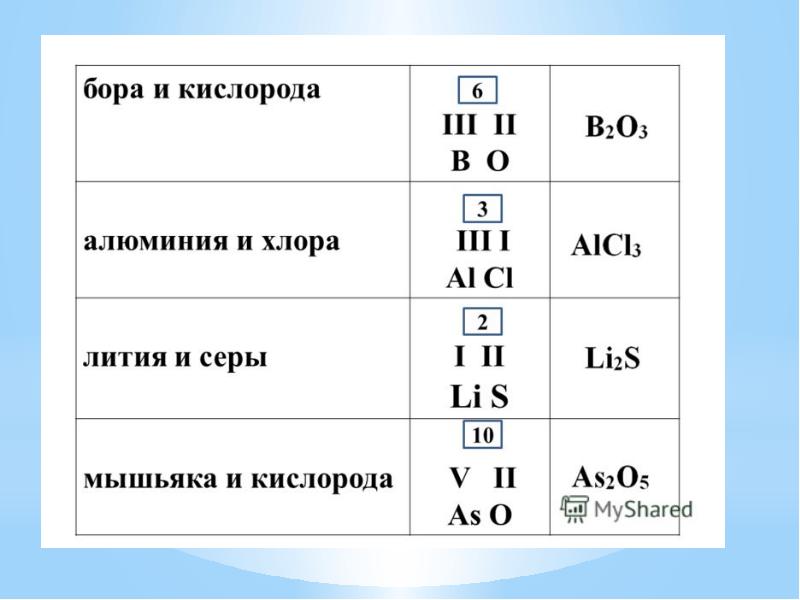
- 16. Валентность. Определение валентности элемента в оксиде.
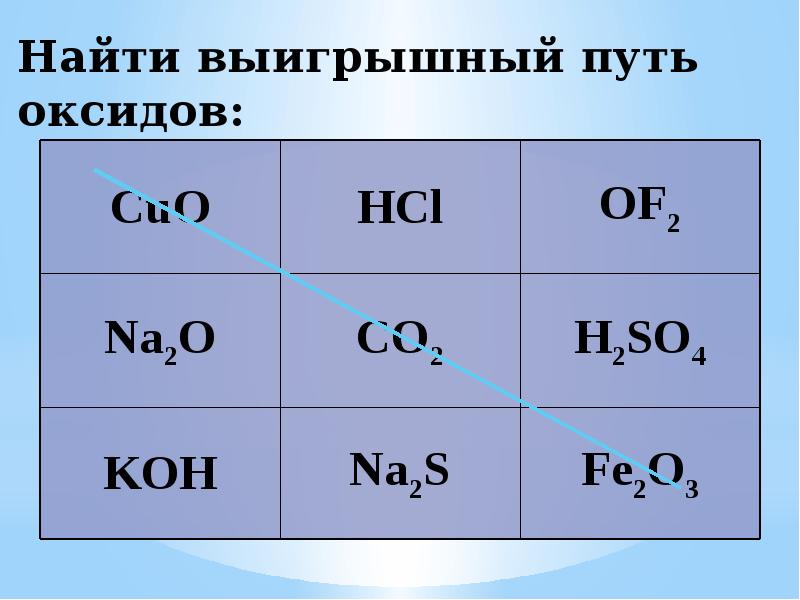
- 17. Найти выигрышный путь оксидов:
- 18. Важнейшие оксиды
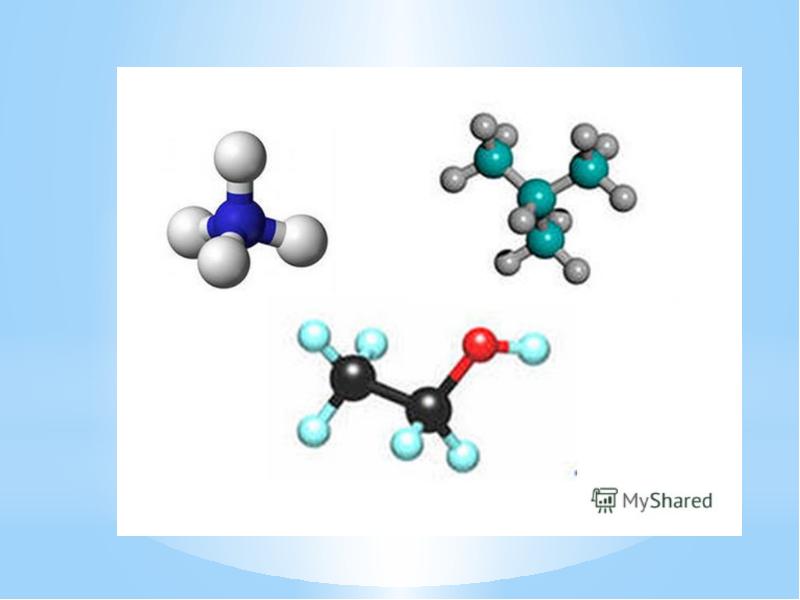
- 22. Сравните качественный и количественный состав в молекулах: HCl , H2O, NH3,
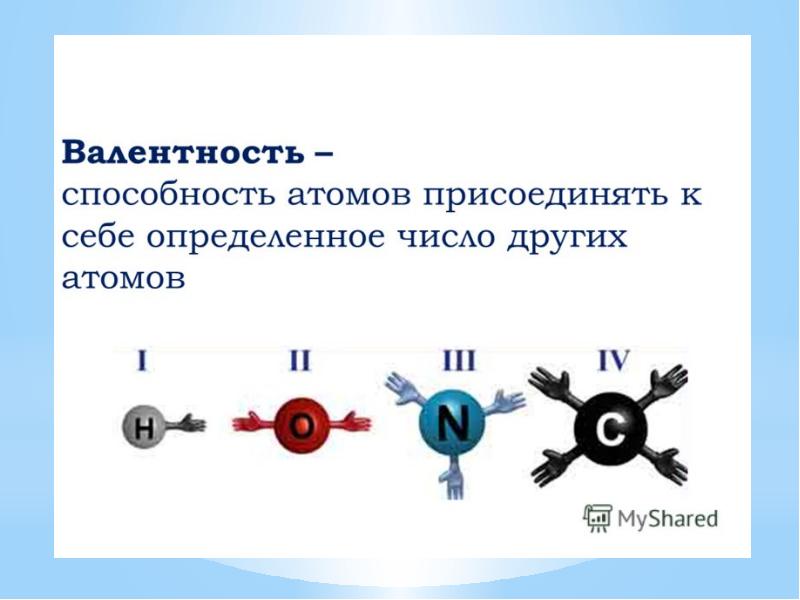
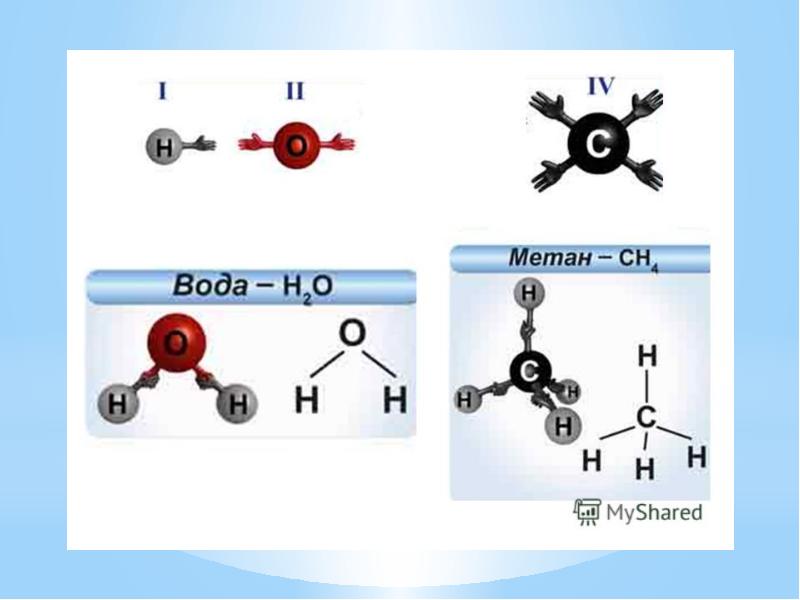
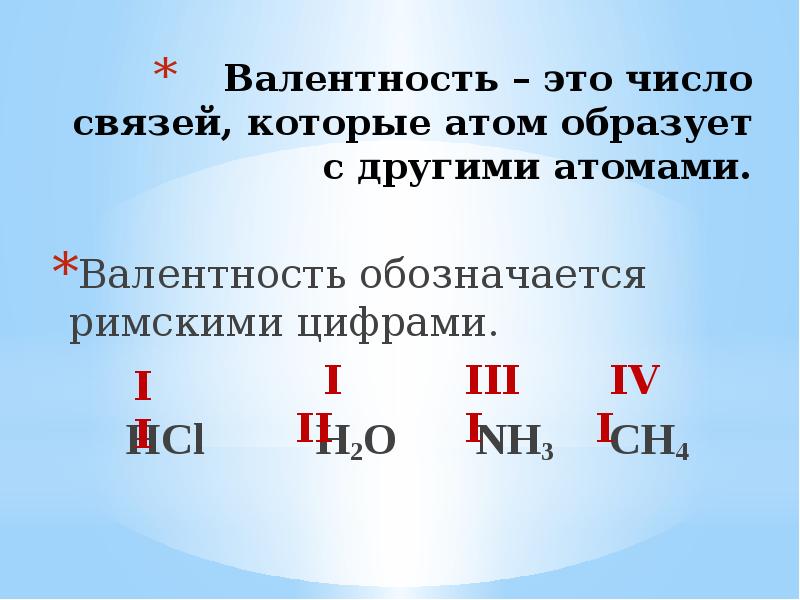
- 23. Валентность – это число связей, которые атом образует с другими атомами.
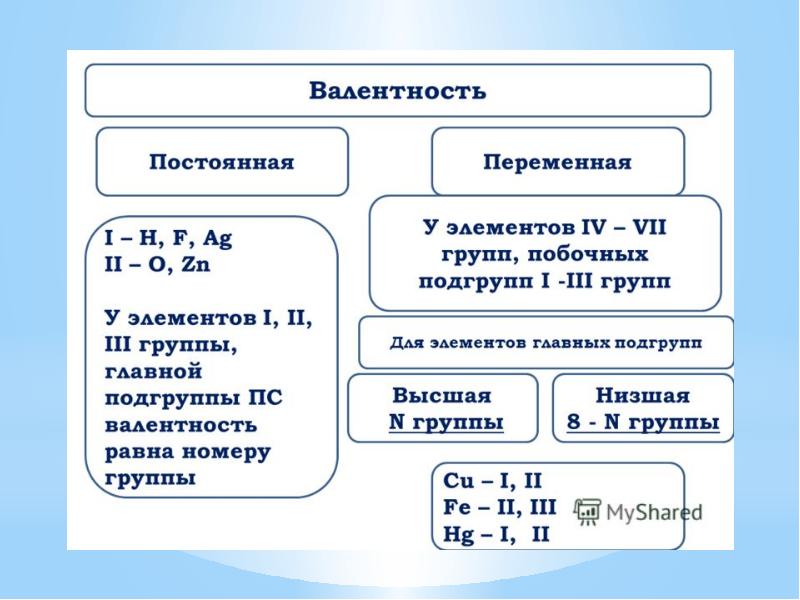
- 24. Определение валентности атомов элементов в соединениях
- 25. Скачать презентацию

















Слайды и текст этой презентации
Похожие презентации





























