Маңызды химиялық өндірістер презентация
Содержание
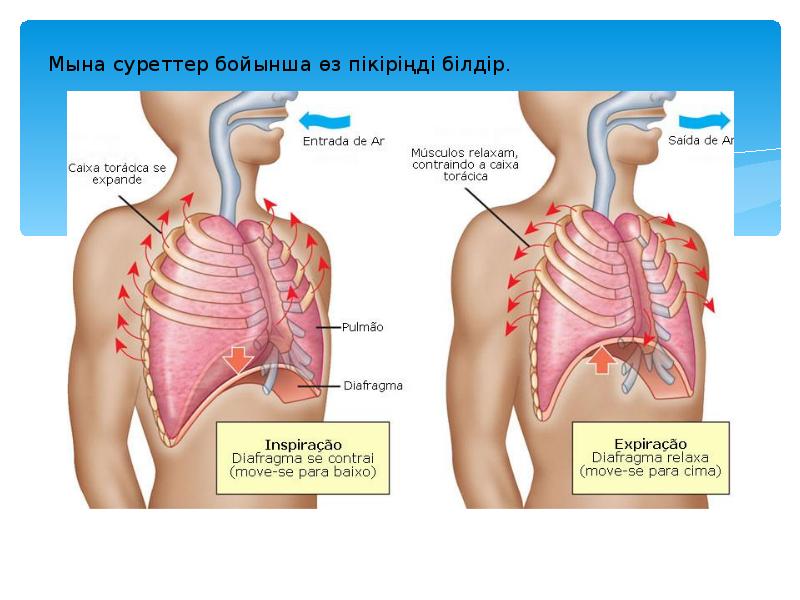
- 2. Оқыту мақсаты -(10.1В) тотықсыздану бұл сутегінің қосылуы немесе оттегінің жойылуы екендігін
- 3. Оқыту мақсаты (10.1С) Қазақстан Республикасында жүзеге асырылатын негізгі өндірістерді және өндірістік
- 5. Zn + 2HCl → ZnCl2 + H2 Zn +
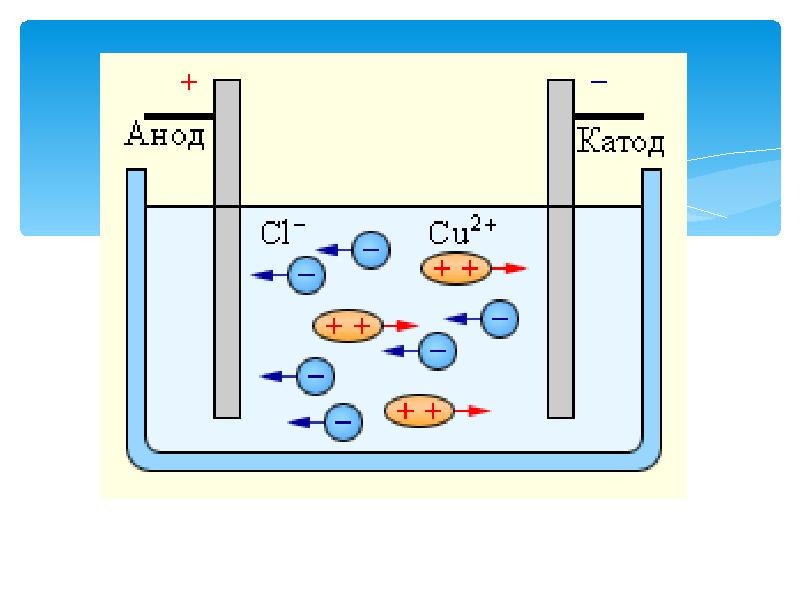
- 13. 1. Молекулаарлық тотығу – тотықсыздану реакциялары 1. Молекулаарлық тотығу – тотықсыздану
- 14. Қалыптастырушы жұмыс
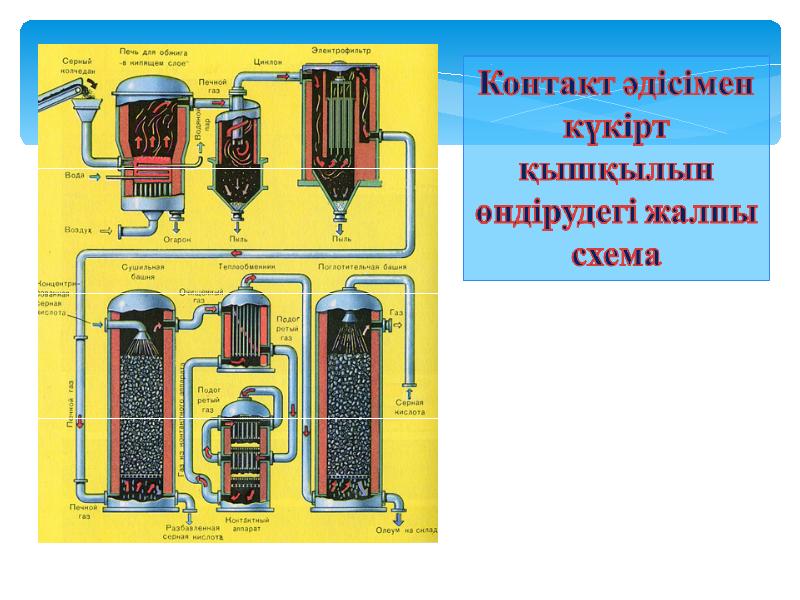
- 16. Контакт әдісімен күкірт қышқылын өндіру әдісі
- 17. Күкірт қышқылын өндіруге қажетті шикізаттар: 1. Бос күкірт S 2.
- 19. Бірінші саты- пиритті өртеу «қайнау қабатты пеш" Бірінші сатының реакция теңдеуі
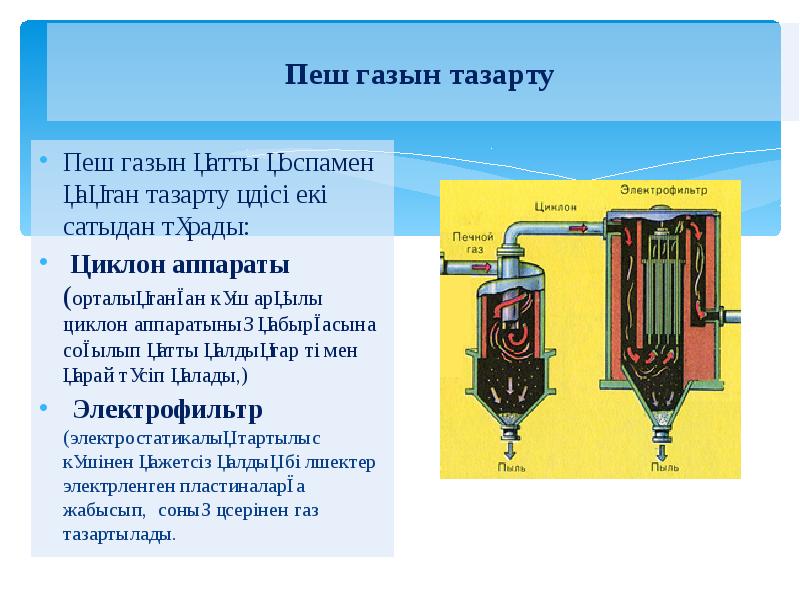
- 20. Пеш газын тазарту Пеш газын қатты қоспамен қақтан тазарту әдісі
- 21. Пеш газының кептірілуі Пеш газының кептірілуі кептіргіш мұнарада жүргізіледі. Төменнен жоғары
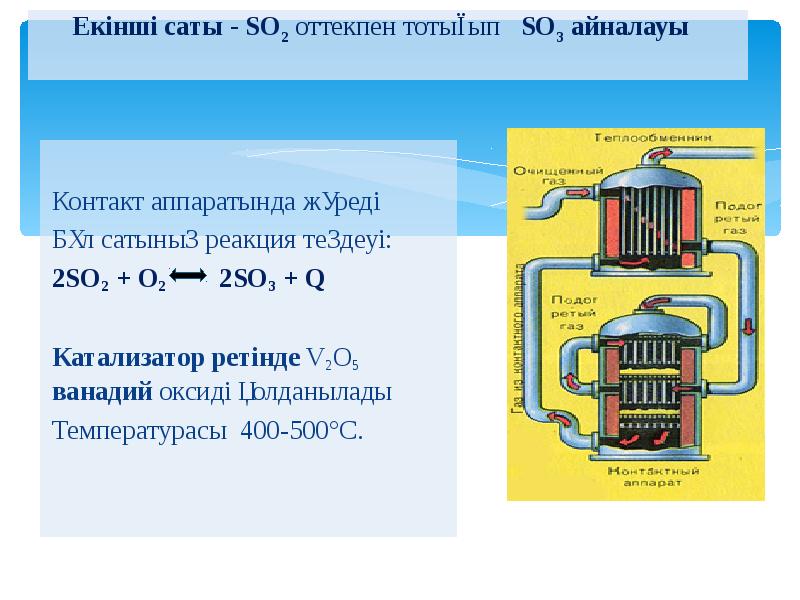
- 22. Екінші саты - SO2 оттекпен тотығып SO3 айналауы Контакт аппаратында
- 23. Үшінші саты- SO3 сіңіріп күкірт қышқылын өндіру Сіңіру мұнарасында жүреді Күкірт
- 24. Үй тапсырмасы
- 25. Скачать презентацию


















Слайды и текст этой презентации
Похожие презентации





























