Основи процесів горіння. Полум’я. Процеси, що відбуваються у полум’ї. (Розділ 1.1.2) презентация
Содержание
- 2. План лекції 1. Будова полум’я 1.1. Зони полум’я 1.2. Температурний
- 3. 1. БУДОВА ПОЛУМ’Я Полум’я – це газовий об’єм, в якому відбуваються
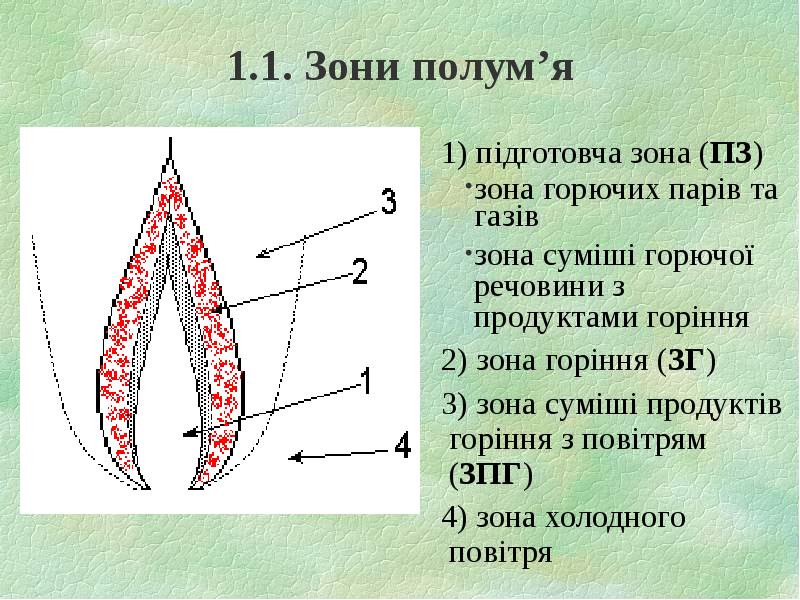
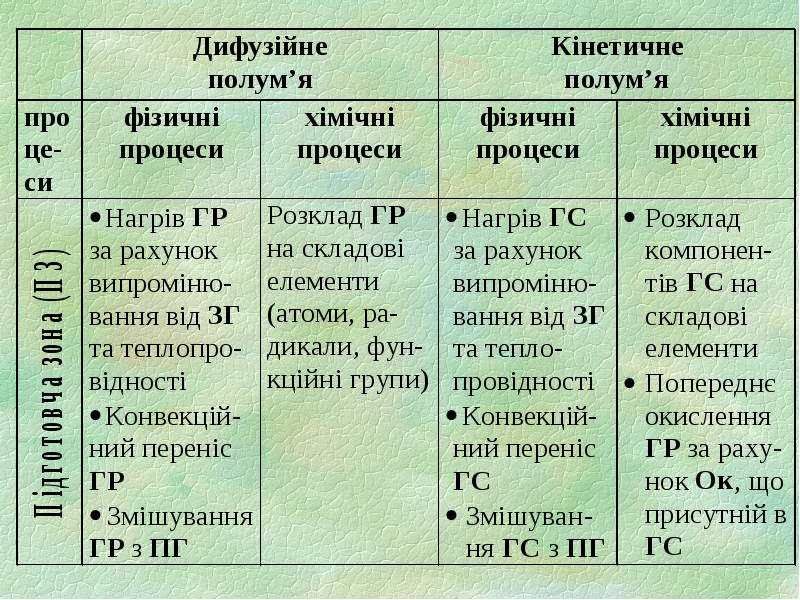
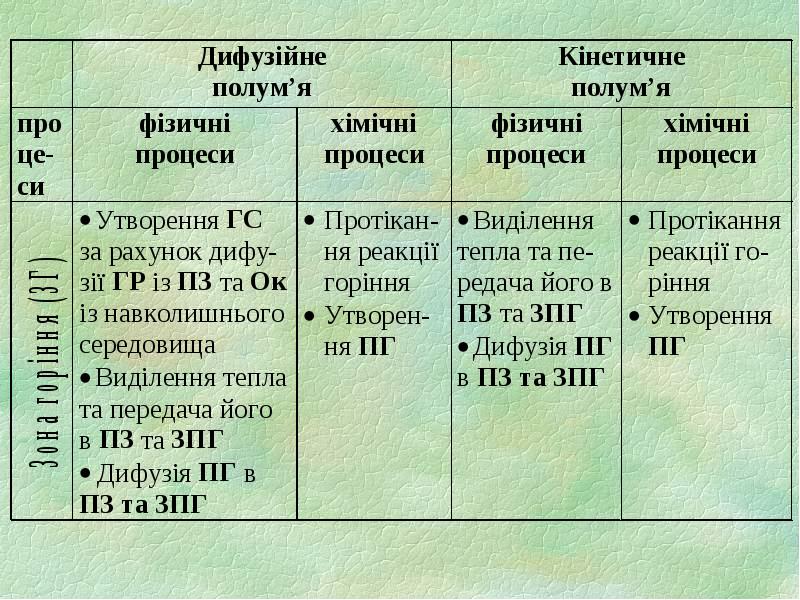
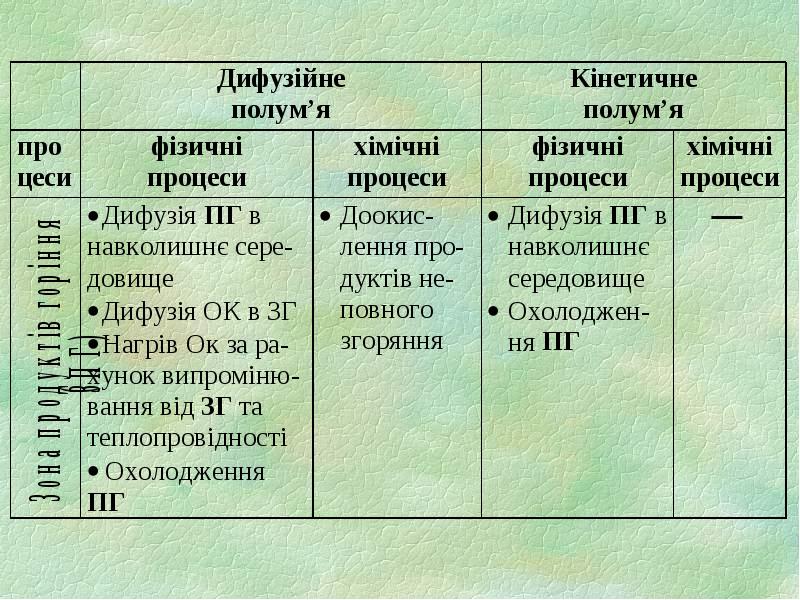
- 4. 1.1. Зони полум’я 1) підготовча зона (ПЗ) зона горючих парів та
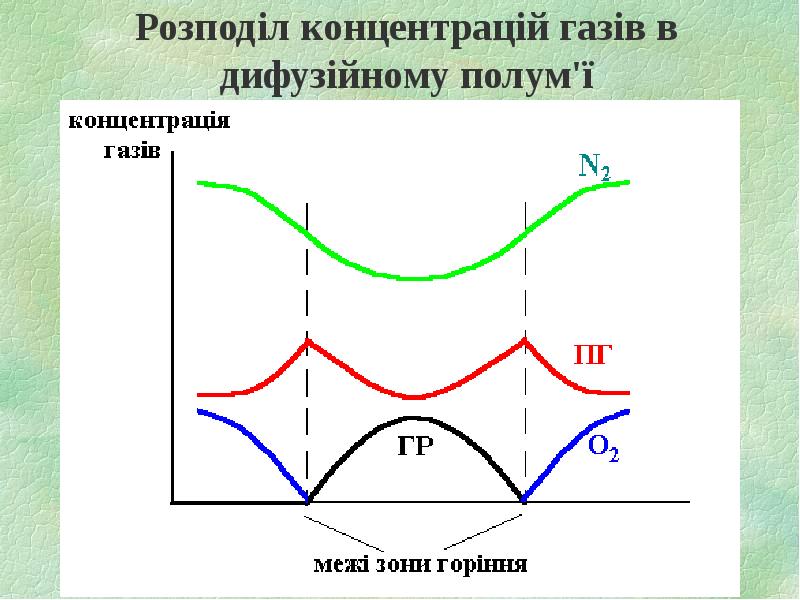
- 8. Розподіл концентрацій газів в дифузійному полум'ї
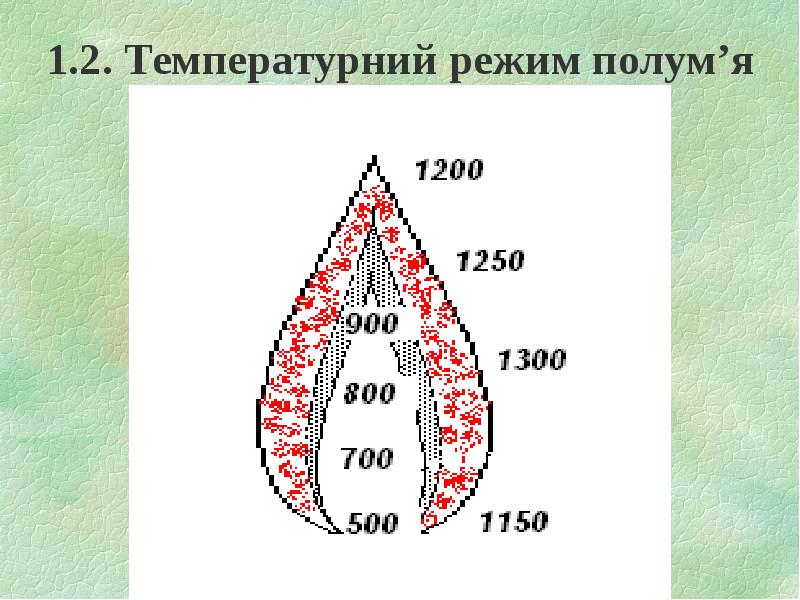
- 9. 1.2. Температурний режим полум’я
- 10. Температура в ПЗ значно нижча, ніж в ЗГ. Температура в ПЗ
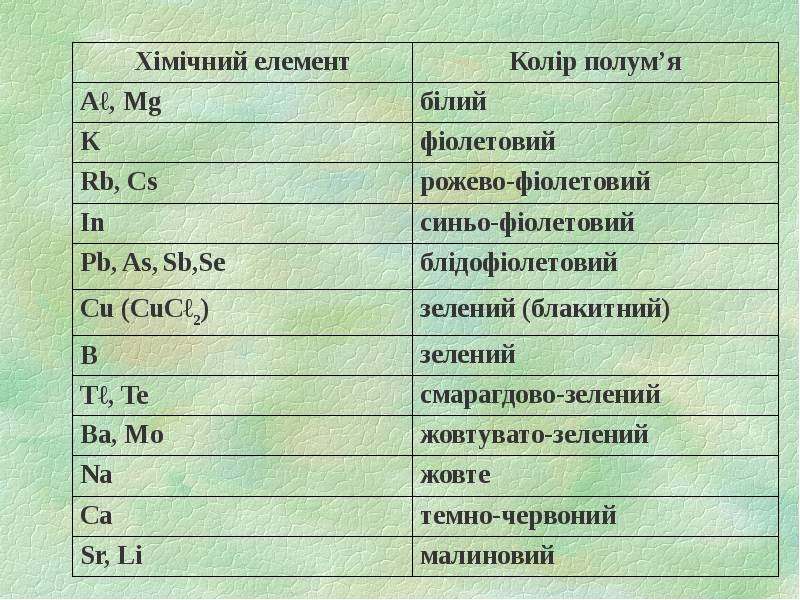
- 11. 1.3. Колір дифузійного полум’я Термічне розкладання речовин в підготовчій зоні: СН2О2
- 12. Залежність кольору дифузійного полум’я від вмісту деяких компонентів Залежність кольору дифузійного
- 14. 2. ОСНОВНІ ТЕОРІЇ, ЩО ПОЯСНЮЮТЬ ПРОЦЕСИ В ПОЛУМ’Ї 2.1. Ланцюгова теорія
- 15. ТИПИ ЛАНЦЮГОВИХ РЕАКЦІЙ Зародження (ініціювання) ланцюгів - стадія ланцюгової реакції, в
- 16. Розгалуження ланцюгів - стадія ланцюгового процесу, у якій перетворення активних проміжних
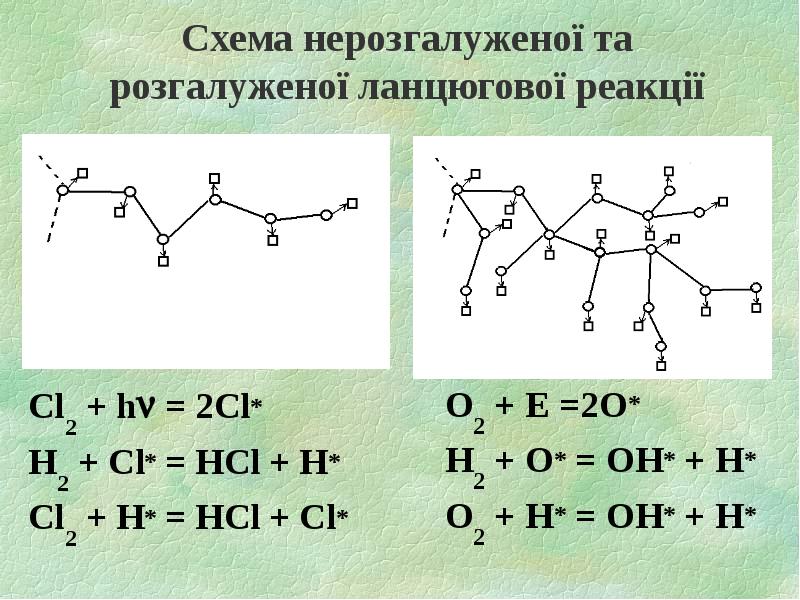
- 17. Схема нерозгалуженої та розгалуженої ланцюгової реакції
- 18. Швидкість ланцюгової реакції: Швидкість ланцюгової реакції: лр = о +
- 19. 2.2. Перекисна теорія окислення 2.2. Перекисна теорія окислення
- 20. Пожежна небезпека органічних перекисей 1. Сильні окисники С4H100 + 12Н202
- 21. Завдання на самопідготовку: 1. Вивчити теоретичний матеріал 1.1. Демидов, Шандыба,
- 22. Скачать презентацию













Слайды и текст этой презентации
Скачать презентацию на тему Основи процесів горіння. Полум’я. Процеси, що відбуваються у полум’ї. (Розділ 1.1.2) можно ниже:
Похожие презентации





























