Строение атомов (Структура атома) презентация
Содержание
- 2. Основные определения атома (the concept of the atom) Атом – наименьшая
- 3. Что такое атом? (What is an atom?) Атом - сложная частица.
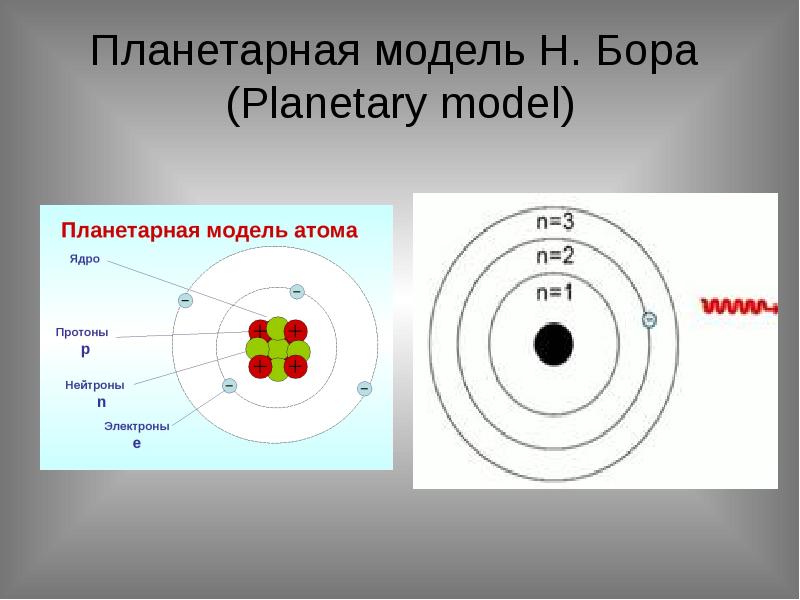
- 4. Планетарная модель Н. Бора (Planetary model)
- 5. Химические элементы – это разные виды атомов В природе существует 88
- 6. Изотопы (Isotopes) Один вид элементов может содержать разное количество нейтронов и
- 7. Ядро атома Ядро атома состоит из протонов и нейтронов. Эти частицы
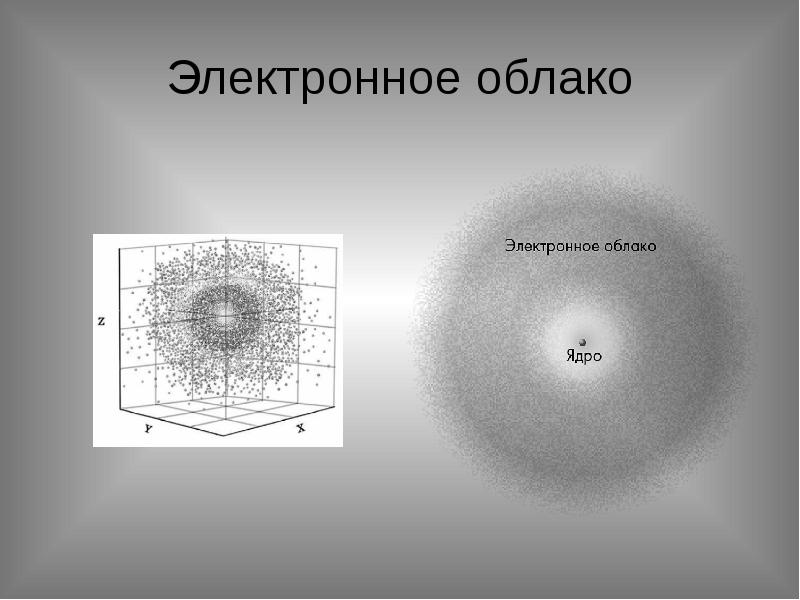
- 8. Электронное облако
- 9. Электронное облако молекулы водорода (Electron cloud of the hydrogen molecule)
- 10. Ядро и его масса (The nucleus and its mass) Протоны несут
- 11. Массовое число элемента (mass number) Масса протона и нейтрона приблежается к
- 12. Основные термины, понятия и определения (Basic terms, concepts and definitions) Атом
- 13. Скачать презентацию










Слайды и текст этой презентации
Скачать презентацию на тему Строение атомов (Структура атома) можно ниже:
Похожие презентации





























