1. Электрохимическая кинетика. Электрохимические системы в неравновесном презентация
Содержание
- 2. Электрохимические системы в условиях прохождения электрического тока
- 3. Возникновение разности между U и E обусловлено омическим падением напряжения внутри
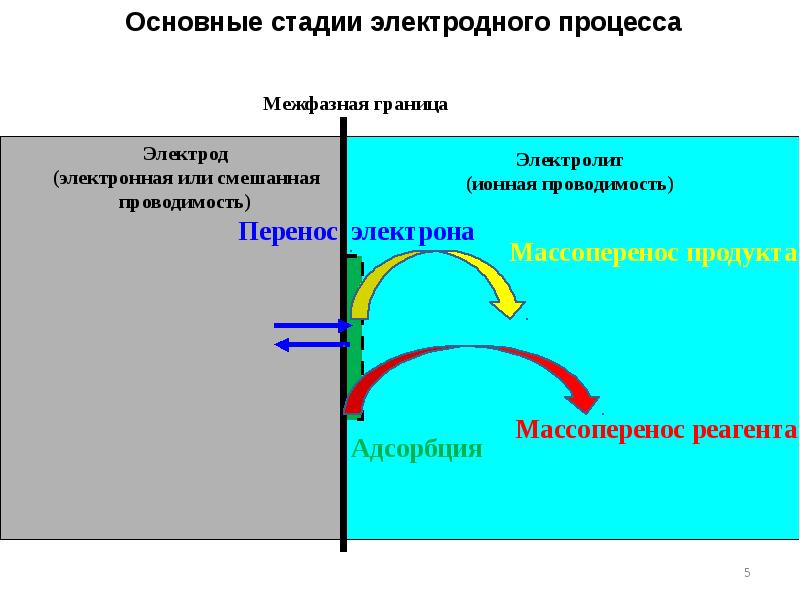
- 4. Электрический ток связан с протеканием электродного процесса и с заряжением двойного
- 7. Пример кинетики электродного процесса
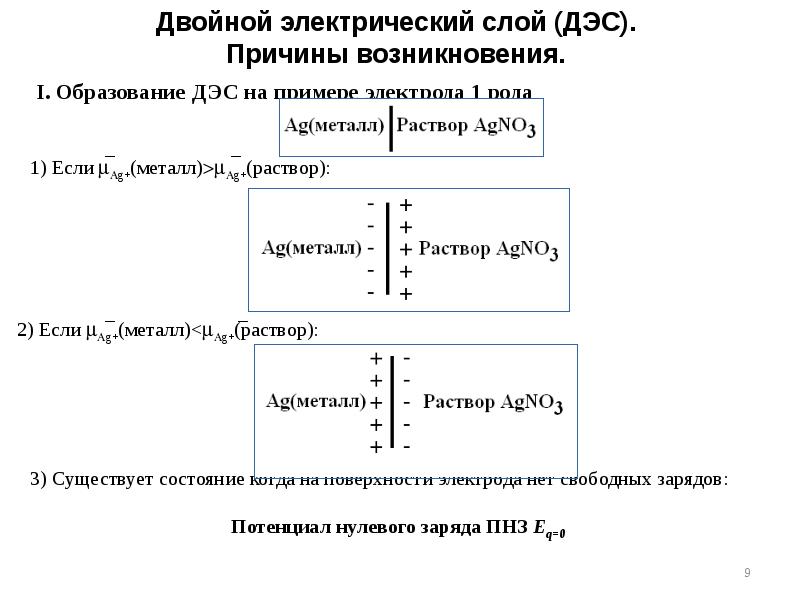
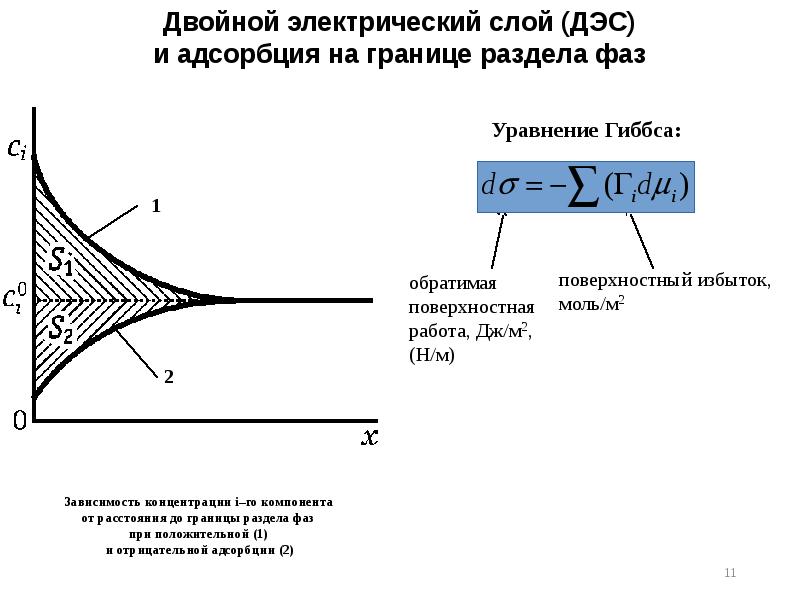
- 8. Различные случаи образования двойного электрического слоя Образование ДЭС на примере электрода
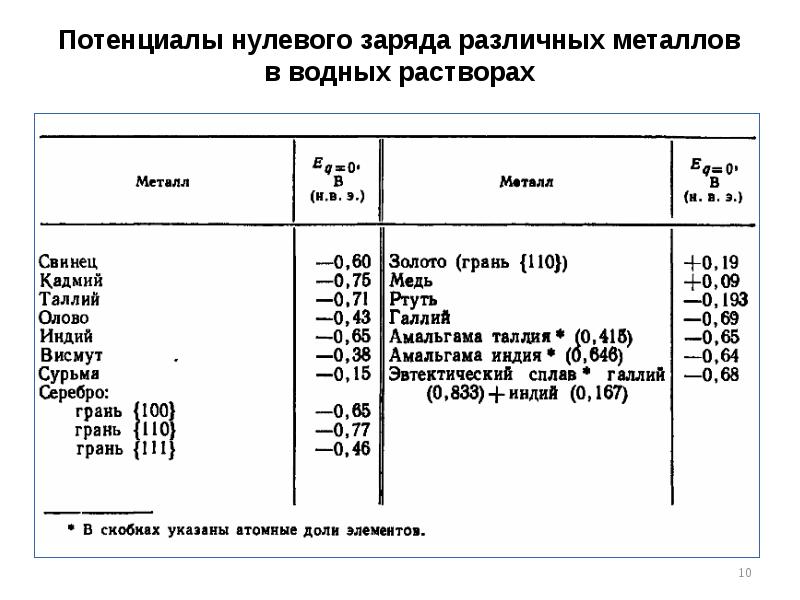
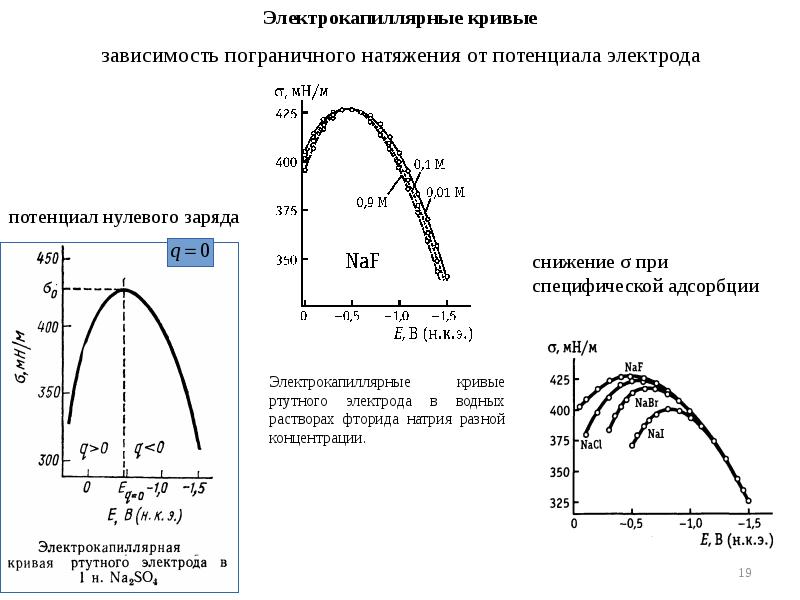
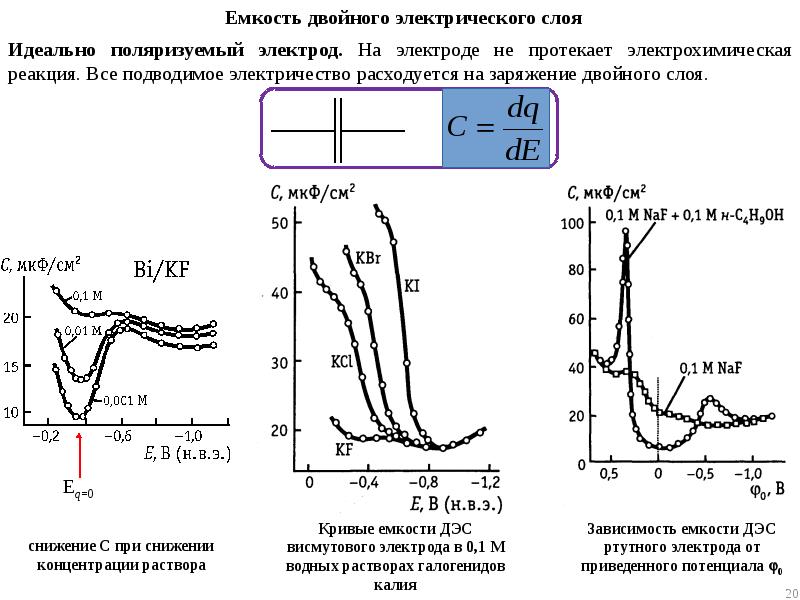
- 10. Потенциалы нулевого заряда различных металлов в водных растворах
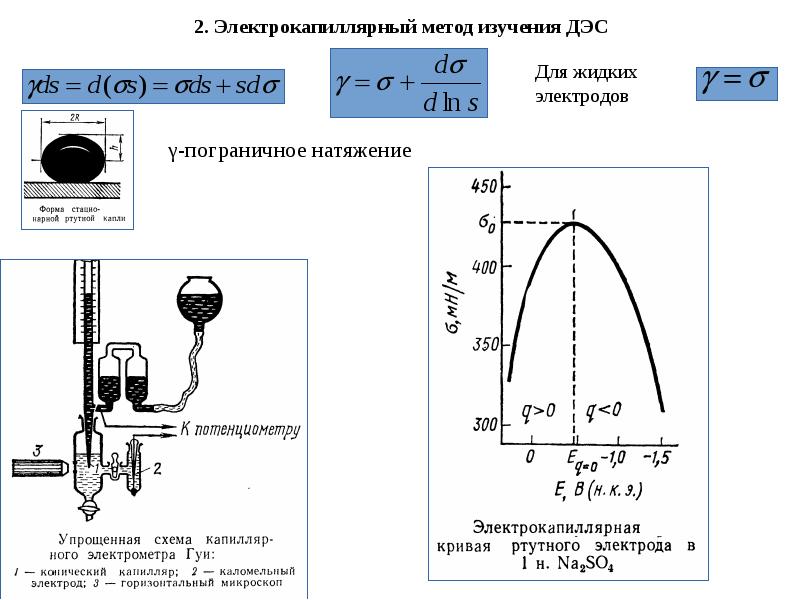
- 17. 2. Электрокапиллярный метод изучения ДЭС
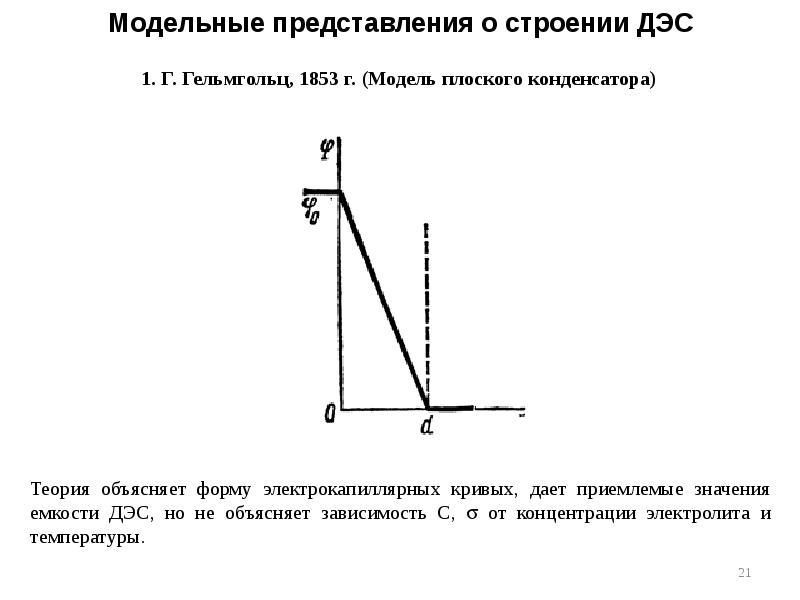
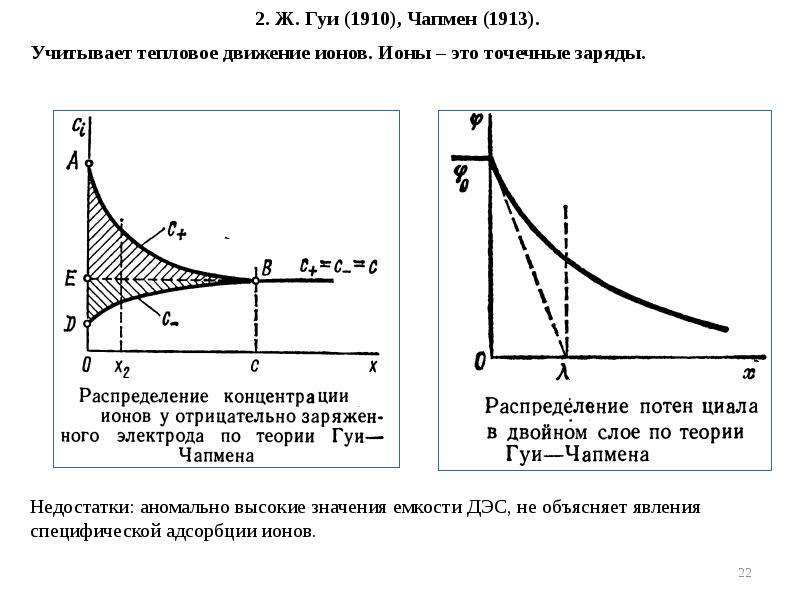
- 21. Модельные представления о строении ДЭС
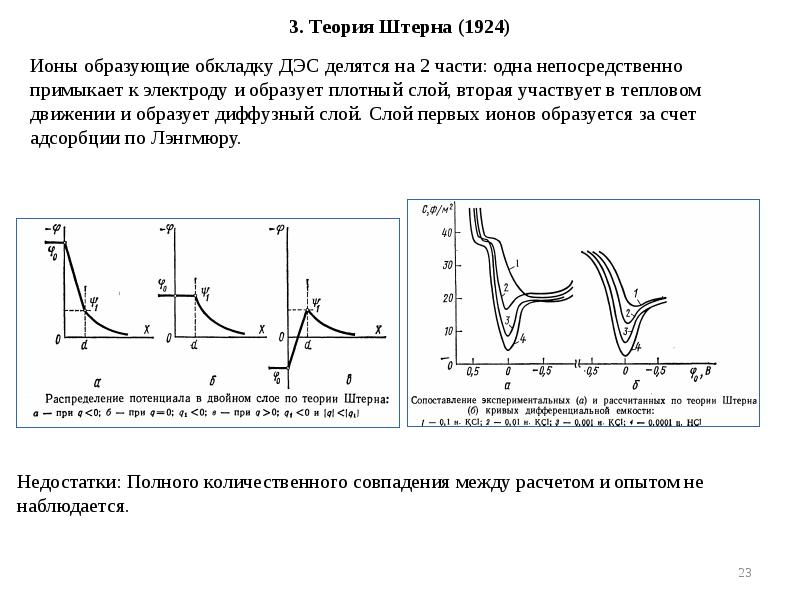
- 23. 3. Теория Штерна (1924)
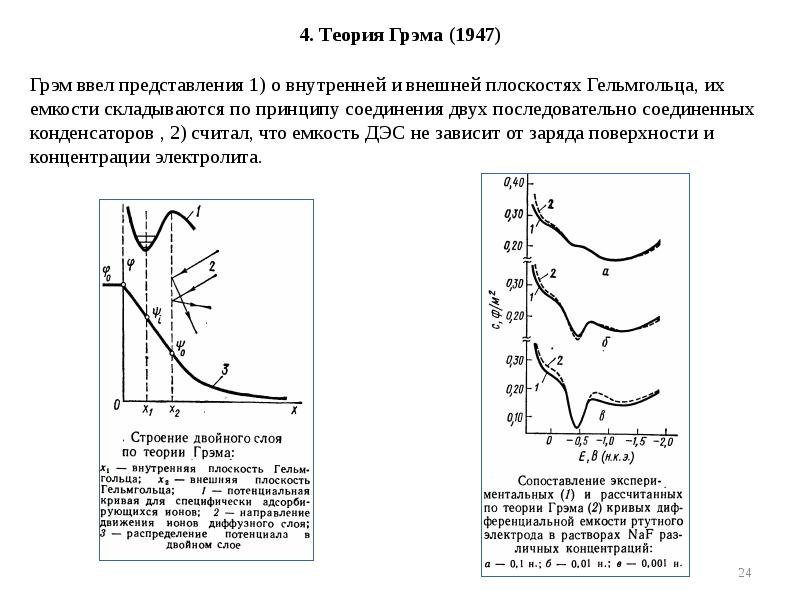
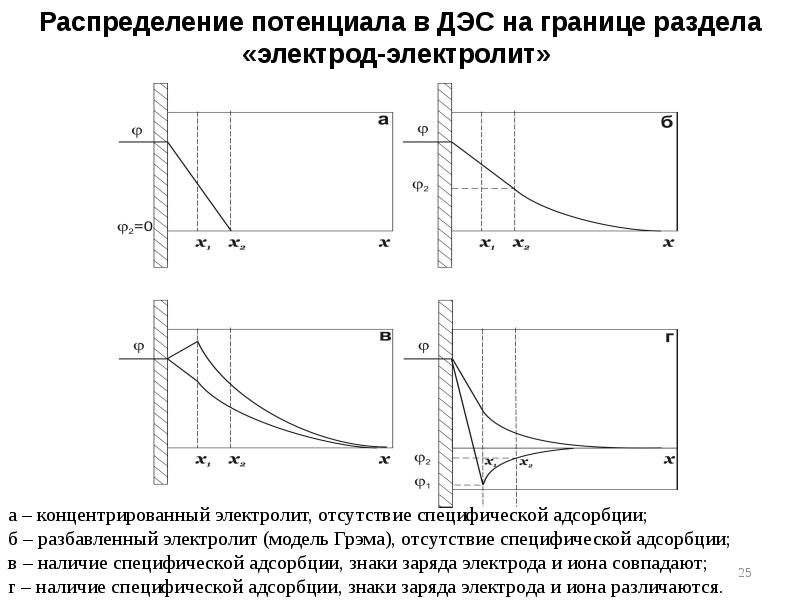
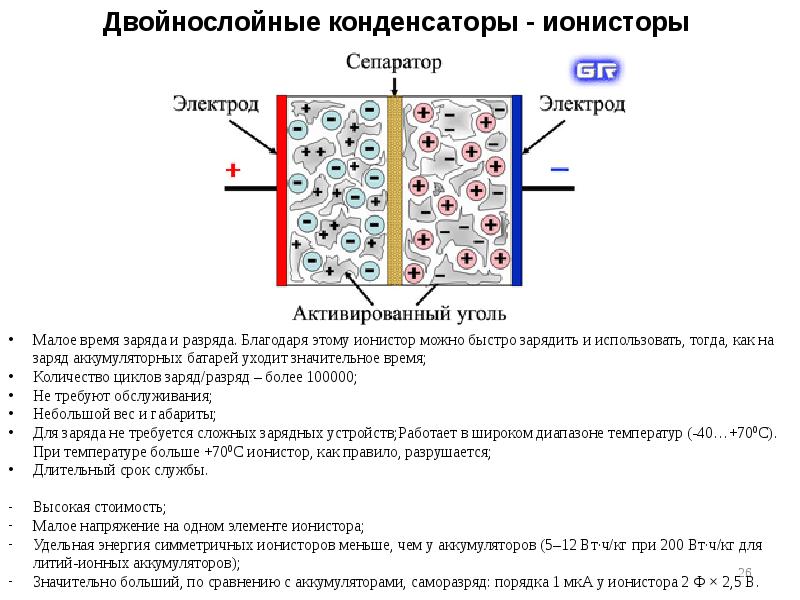
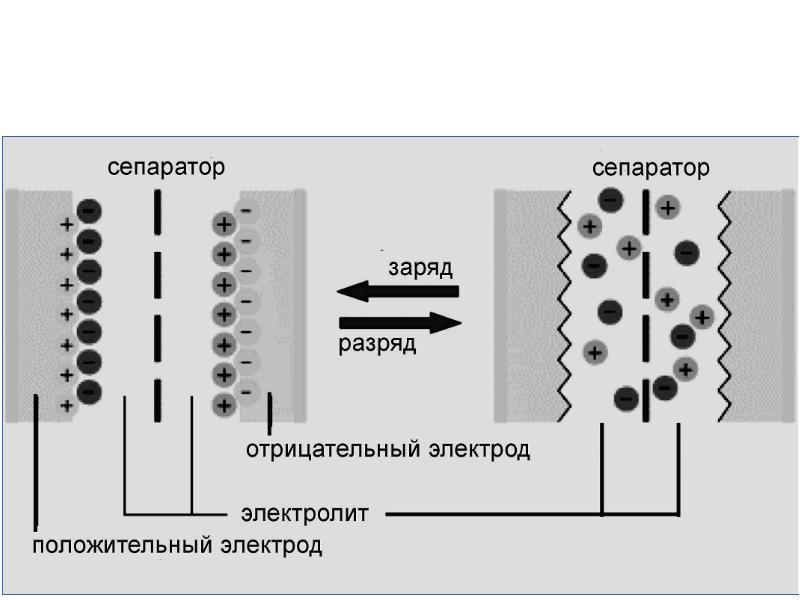
- 24. 4. Теория Грэма (1947)
- 28. Кинетика электродных процессов
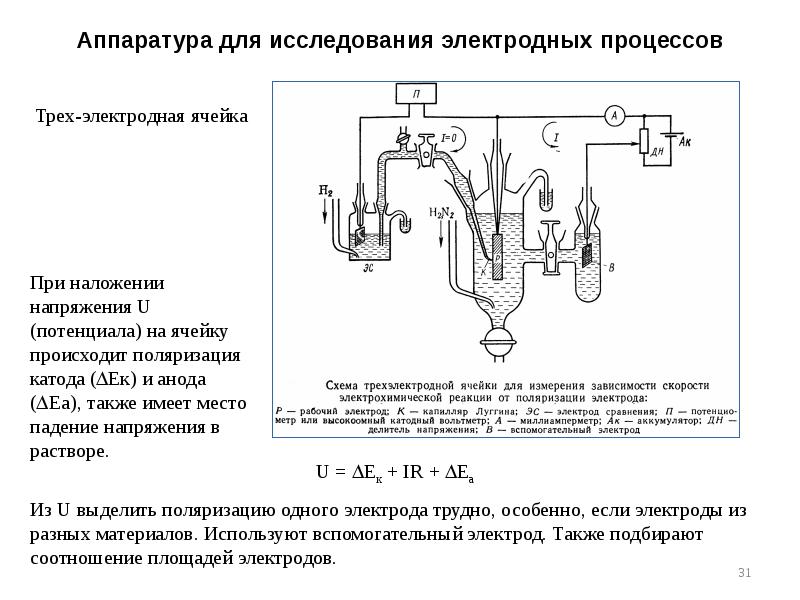
- 31. Аппаратура для исследования электродных процессов
- 32. Закономерности стадии разряда-ионизации
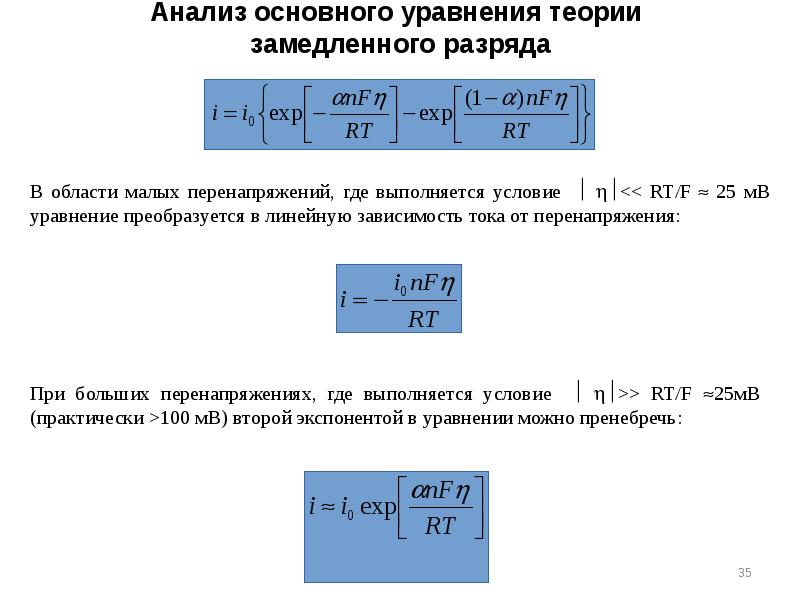
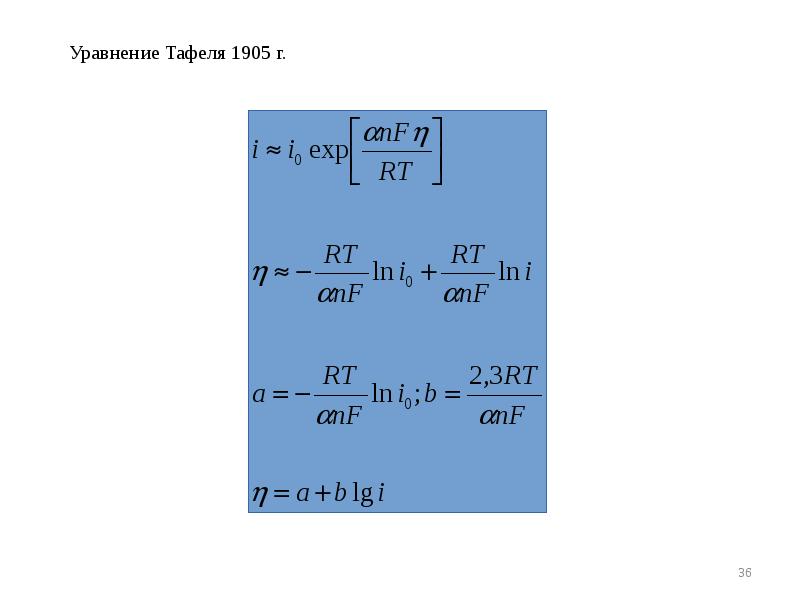
- 35. Анализ основного уравнения теории замедленного разряда
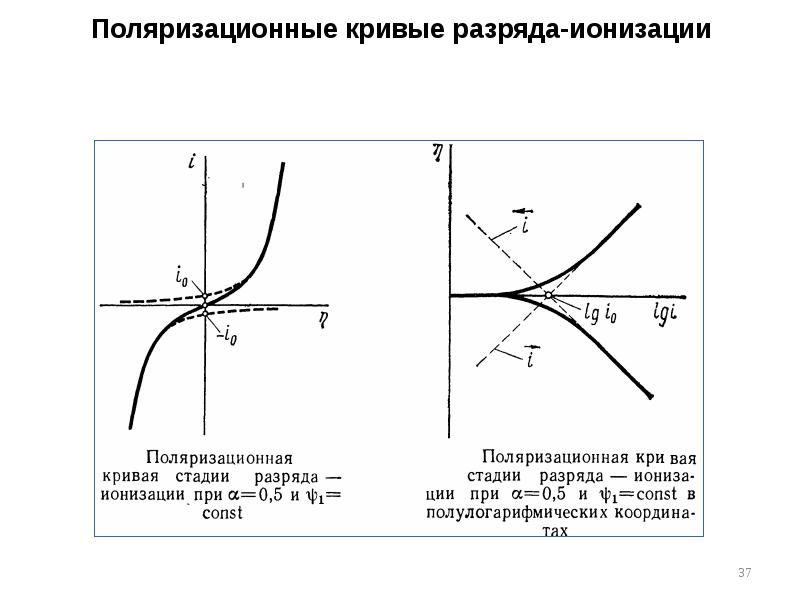
- 37. Поляризационные кривые разряда-ионизации
- 38. Скачать презентацию

















Слайды и текст этой презентации
Скачать презентацию на тему 1. Электрохимическая кинетика. Электрохимические системы в неравновесном можно ниже:
Похожие презентации





























