Атомная физика
Содержание
- 2. Открытие атома. Мысль о том, что все разнообразие веществ в природе
- 3. Электрон. Открывателем электрона считают английского физика Дж. Дж. Томсона (1897г.; нобелевская
- 4. Первооткрыватель электрона. - английский физик, основатель научной школы, член и
- 6. Первыми изучали внутреннюю структуру атома английский физик Э.Резерфорд и его студенты
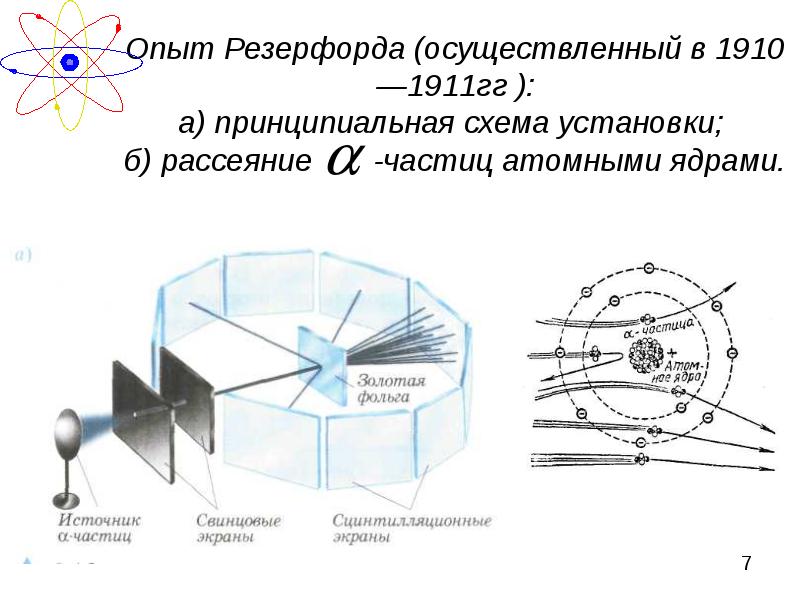
- 7. Опыт Резерфорда (осуществленный в 1910—1911гг ): а) принципиальная схема установки; б)
- 8. Объяснение результатов опыта: Т.к. большинство - частиц не изменяли траекторию
- 9. Квантовые постулаты Бора. — великий датский физик. Создал первую квантовую
- 10. Постулаты: Первый постулат Бора гласит: атомная система может находиться только в
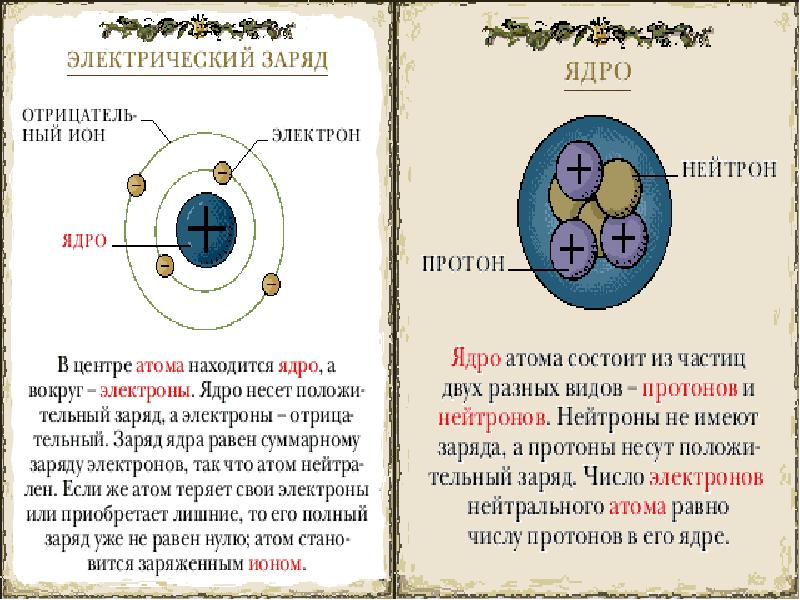
- 11. Обозначение ядер химического элемента.
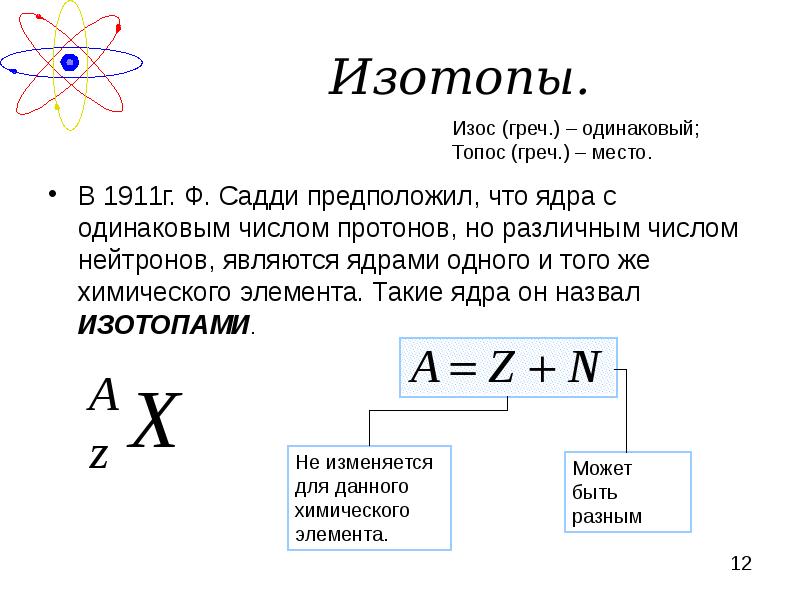
- 12. Изотопы. В 1911г. Ф. Садди предположил, что ядра с одинаковым числом
- 13. Изотопы водорода. Легкий водород (в ядре 1 протон). При соединении
- 14. Дефект масс. Дефектом масс называют разность между суммарной массой всех
- 15. Радиоактивность. Явление радиоактивности было случайно открыто в 1896г. французским ученым Беккрелем,
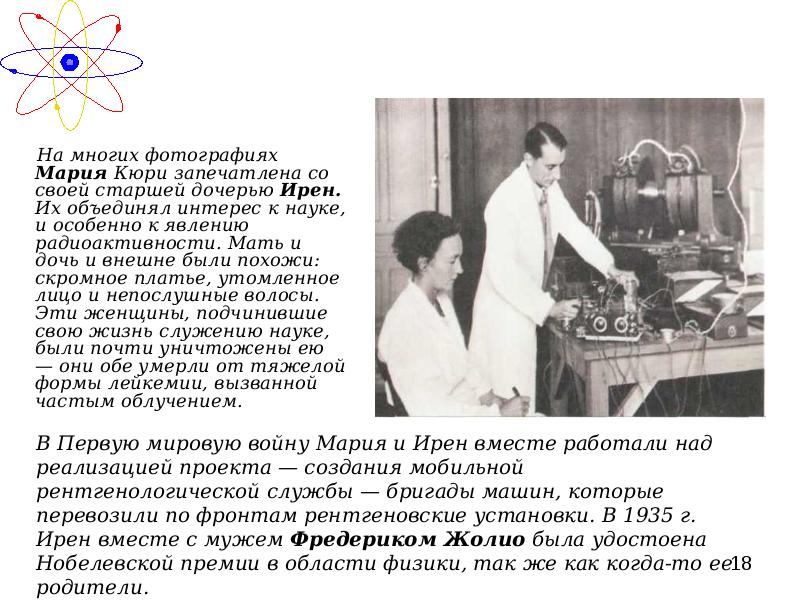
- 18. В Первую мировую войну Мария и Ирен вместе работали над реализацией
- 19. Виды радиоактивного излучения. - лучи – поток положительно заряженных ядер
- 20. Виды радиоактивности. Устойчивыми, стабильными являются лишь атомные ядра с энергией связи
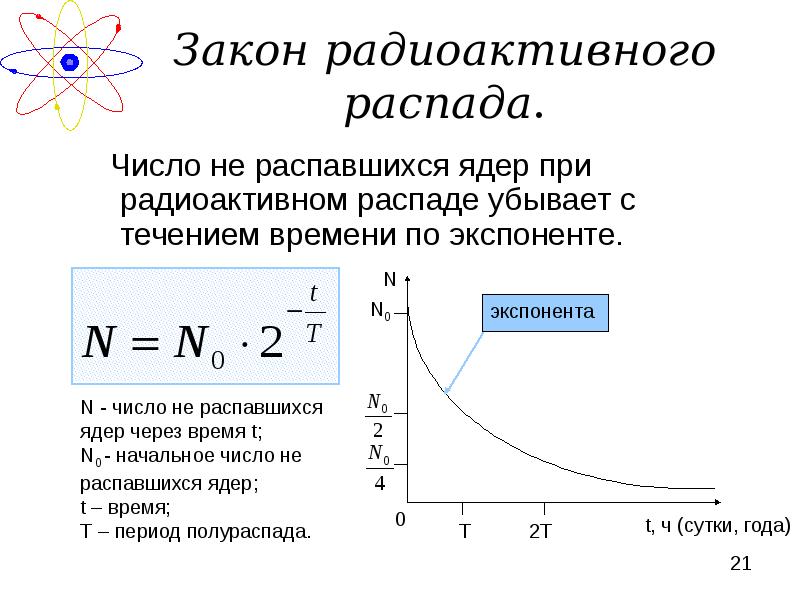
- 21. Закон радиоактивного распада. Число не распавшихся ядер при радиоактивном распаде убывает
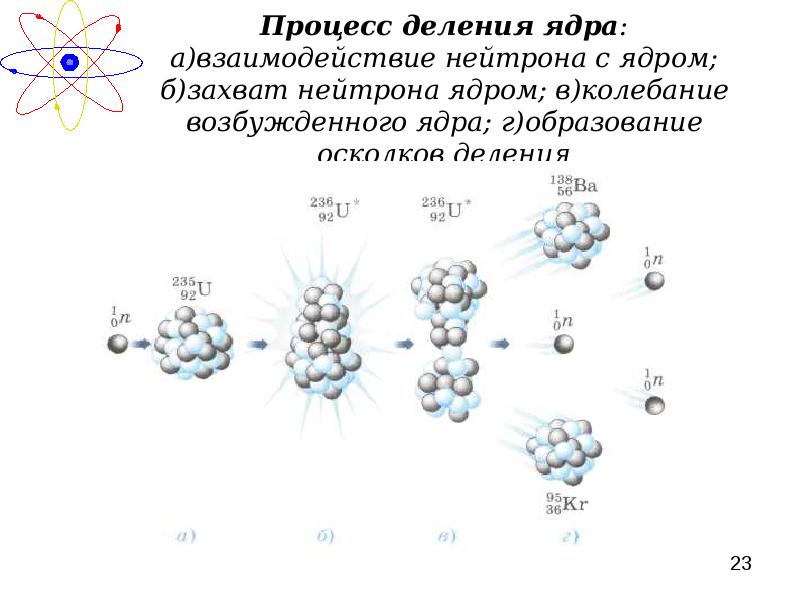
- 23. Процесс деления ядра: а)взаимодействие нейтрона с ядром; б)захват нейтрона ядром; в)колебание
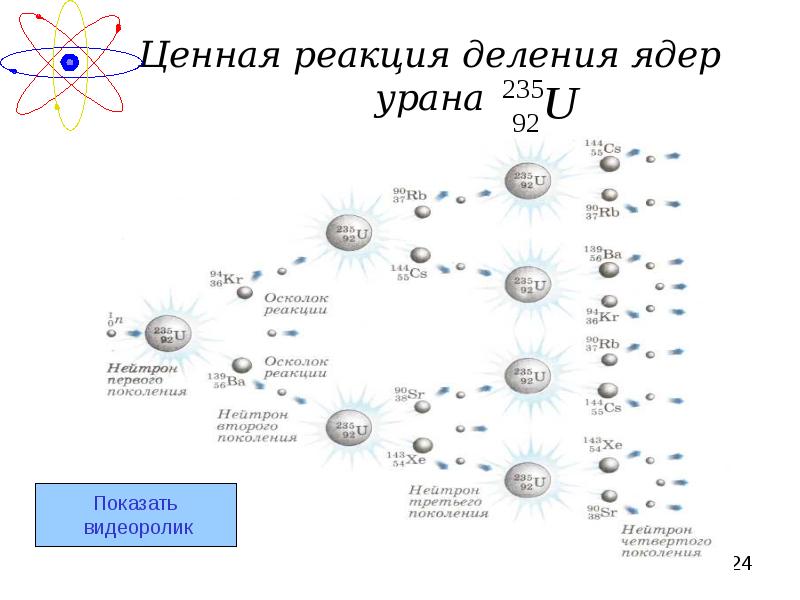
- 24. Ценная реакция деления ядер урана
- 25. Ядерный реактор. Для стабильной цепной ядерной реакции, необходимо создать условия,
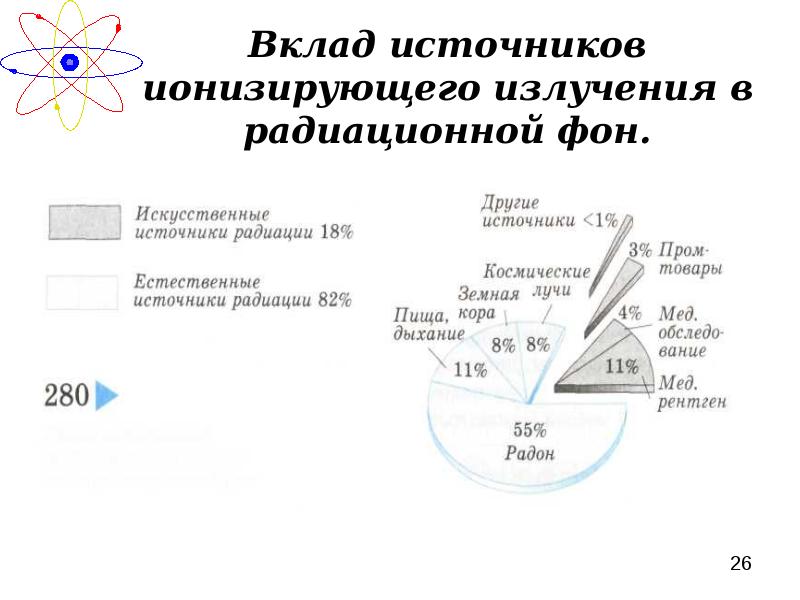
- 26. Вклад источников ионизирующего излучения в радиационной фон.
- 27. Ядерной бомбой
- 28. ФАКТЫ: Для создания ядерных бомб применяются изотопы урана и плутония. В
- 29. Скачать презентацию




















Слайды и текст этой презентации
Похожие презентации





























