12. Электрохимия презентация
Содержание
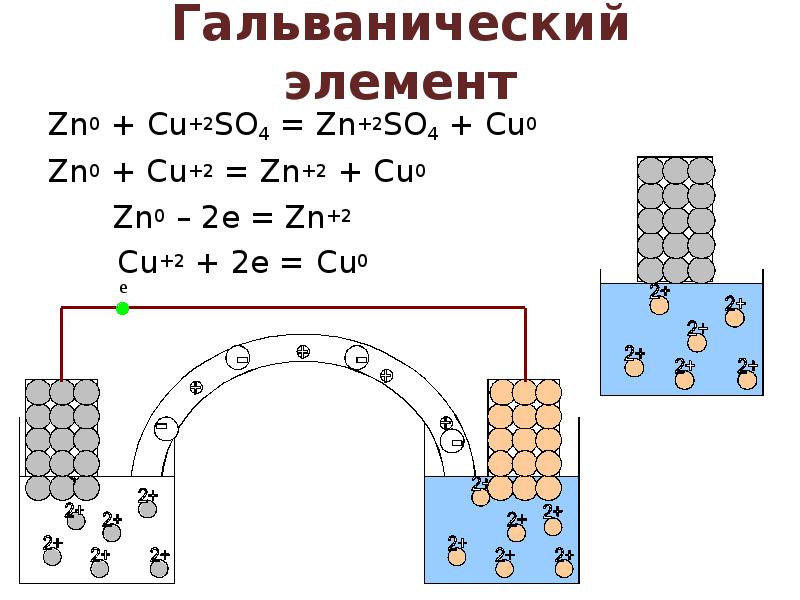
- 2. Гальванический элемент Zn0 + Cu+2SO4 = Zn+2SO4 + Cu0 Zn0 +
- 3. Термины электрохимии Гальванический элемент – устройство, в котором осуществляется превращение энергии
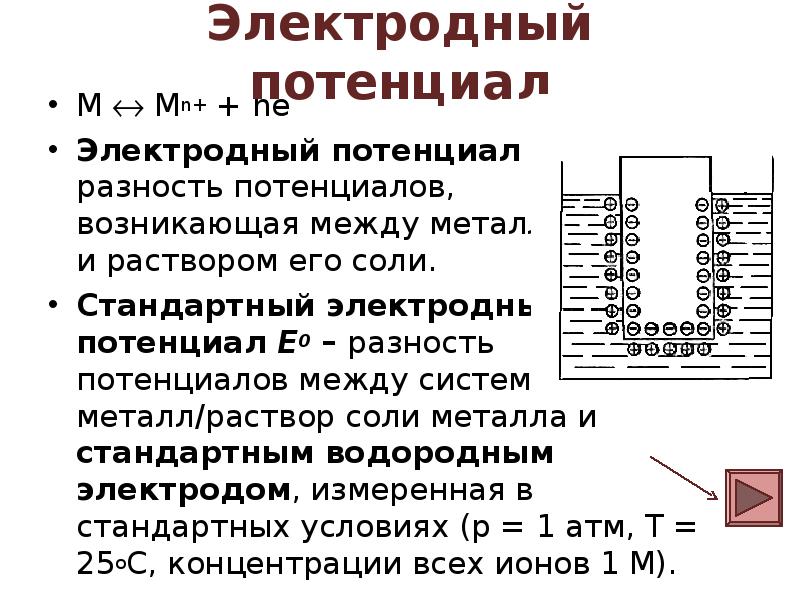
- 4. Электродный потенциал М Mn+ + ne Электродный потенциал – разность
- 5. Стандартные электродные потенциалы Для полуреакций в форме восстановления: Mn+ + ne
- 6. Электрохимический ряд напряжений металлов (ряд активности металлов) - металлы в порядке
- 7. Окислительно-восстановительный потенциал - характеристика любой ОВ системы в водном растворе: Ох
- 8. ЭДС Электродвижущая сила (ЭДС) процесса складывается из потенциалов полуреакций: Е
- 9. ЭДС и свободная энергия Гиббса G = –nFЕ 2KMnO4 +
- 10. Потенциалы последовательных полуреакций Cu2++ e = Cu+ (1) Cu+ +
- 11. Уравнение Нернста Ох + ne Red G = G0298 +
- 12. Концентрационный элемент Cu2+ + 2e = Cu СuSO4 1M E1 = E0
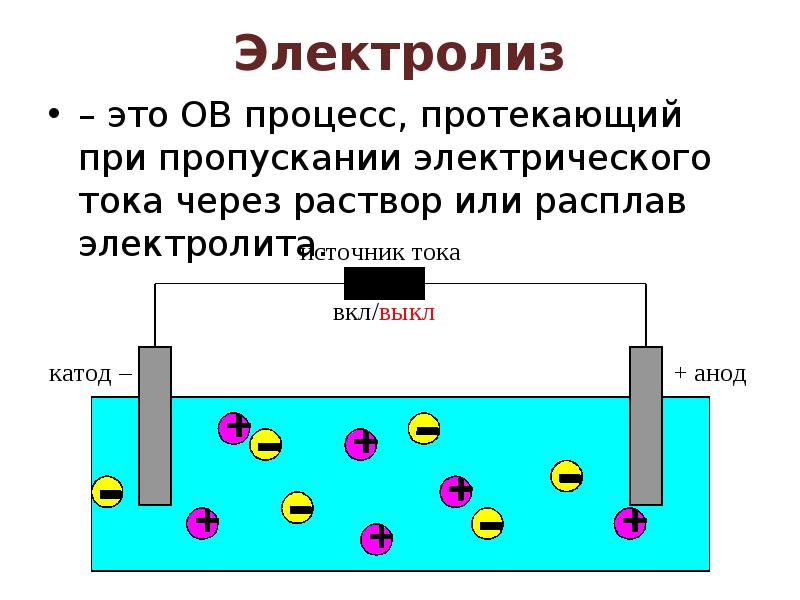
- 13. Электролиз – это ОВ процесс, протекающий при пропускании электрического тока через
- 14. Электролиз расплавов LiH = Li+ + H- К: Li+ + e =
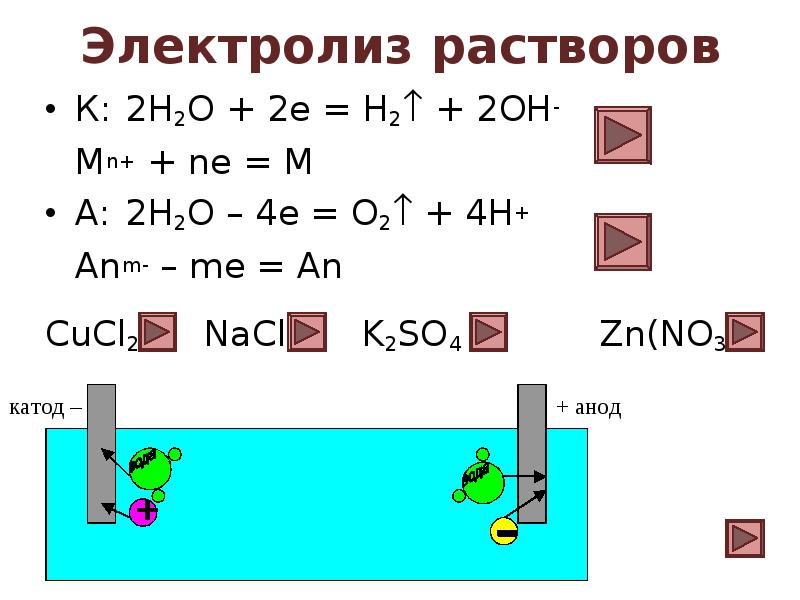
- 15. Электролиз растворов К: 2Н2О + 2е = Н2 + 2ОН- Мn+
- 16. Напряжение разложения Напряжение разложения электролита – это минимальная разность потенциалов между
- 17. Закон Фарадея I – сила тока в амперах, t –
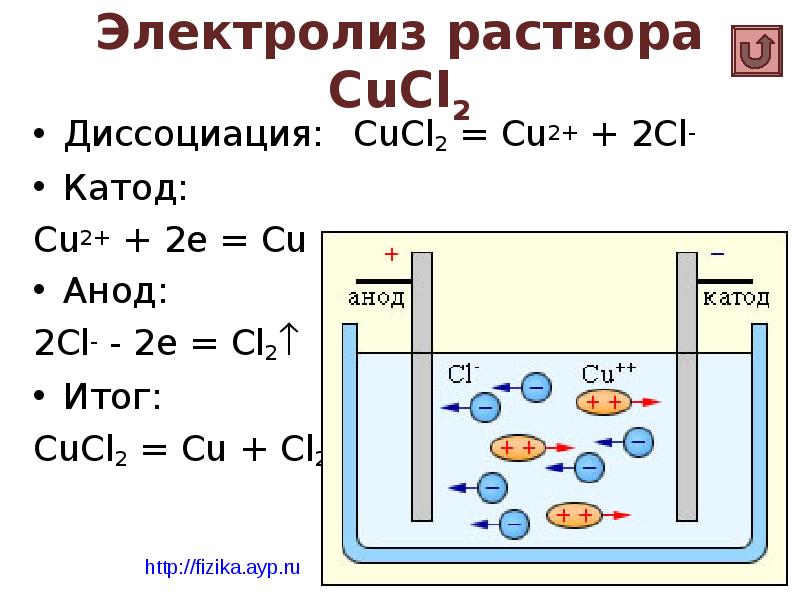
- 20. Электролиз раствора CuCl2 Диссоциация: CuCl2 = Cu2+ + 2Cl- Катод:
- 21. Электролиз раствора NaCl Диссоциация: NaCl = Na+ + Cl- Катод: 2Н2О
- 22. Электролиз раствора K2SO4 Диссоциация: K2SO4 = 2K+ + SO42- Катод: 2Н2О +
- 23. Электролиз раствора Zn(NO3)2 Диссоциация: Zn(NO3)2 = Zn2+ + 2NO3- Катод: 2Н2О +
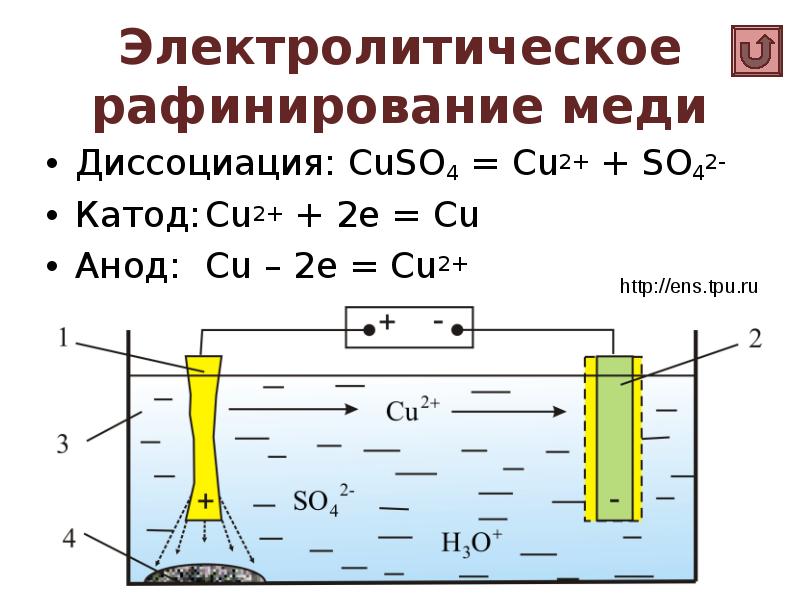
- 24. Электролитическое рафинирование меди Диссоциация: CuSO4 = Cu2+ + SO42- Катод: Cu2+ +
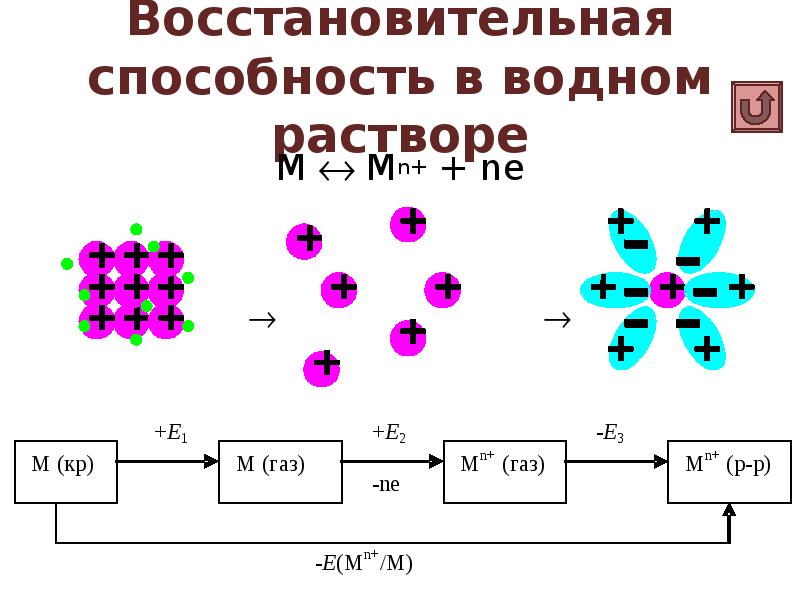
- 25. Восстановительная способность в водном растворе М Mn+ + ne
- 26. СЛЕВА – БОЛЕЕ СИЛЬНЫЕ ВОССТАНОВИТЕЛИ, ЧЕМ СПРАВА Li K Ba Sr
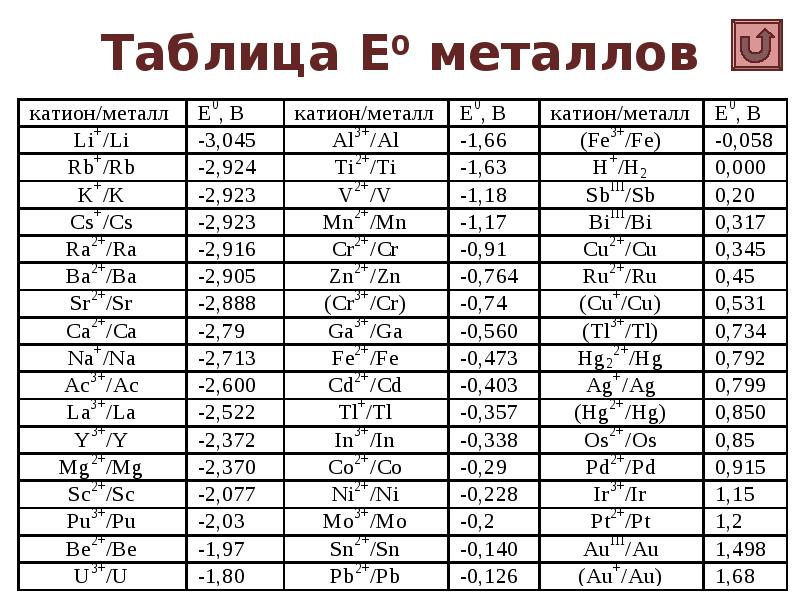
- 27. Таблица Е0 металлов
- 28. Свинцовый аккумулятор А: Pb + HSO4- – 2e = PbSO4 +
- 29. Никель-кадмиевый аккумулятор А: Cd + 2OH- – 2e = Cd(OH)2 К: NiOOH
- 30. Сухой элемент (батарейка) А: Zn + 4NH4+ – 2e = [Zn(NH3)4]2+
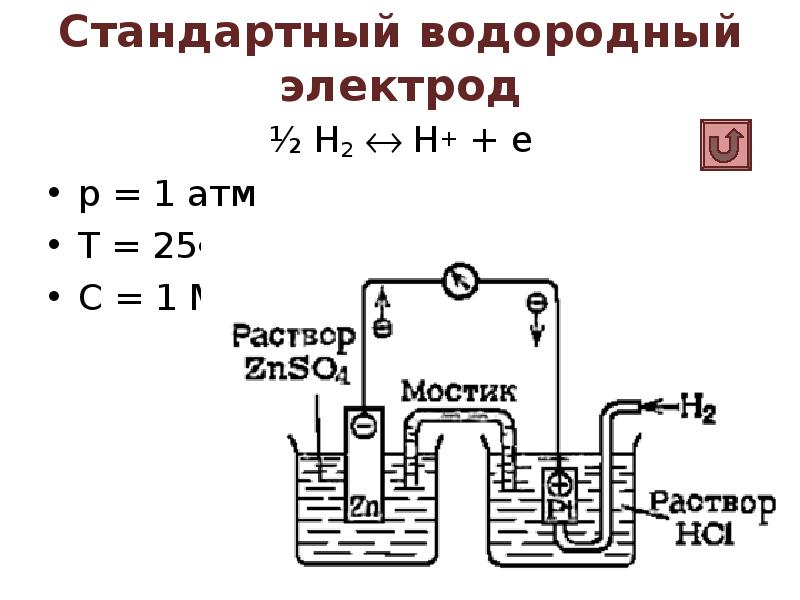
- 31. Стандартный водородный электрод ½ Н2 Н+ + е р =
- 32. Катодные процессы
- 33. Анодные процессы Растворимый (активный) анод: М – ne = Mn+ Нерастворимый
- 35. Батарейки
- 36. Аккумуляторы
- 37. Скачать презентацию





















![Сухой элемент (батарейка)
А: Zn + 4NH4+ – 2e = [Zn(NH3)4]2+ Сухой элемент (батарейка)
А: Zn + 4NH4+ – 2e = [Zn(NH3)4]2+](/documents_4/066b2f3516602ffb230f81bb7157906c/img29.jpg)





Слайды и текст этой презентации
Похожие презентации





























