Кислоты органические и неорганические презентация
Содержание
- 2. Определение Кисло́ты — сложные вещества, которые состоят из атомов водорода, способных
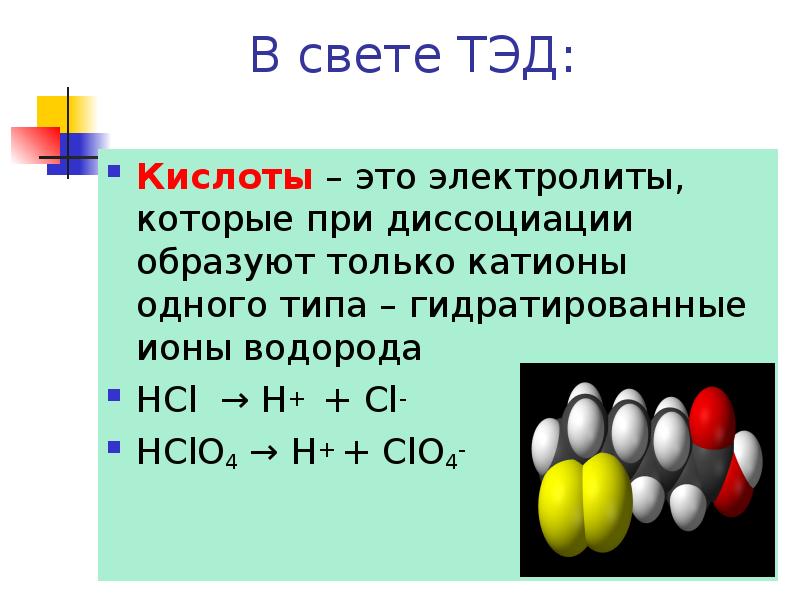
- 3. В свете ТЭД: Кислоты – это электролиты, которые при диссоциации
- 4. Определение Льюиса
- 5. Протолитическая теория Брёнстеда -Лоури По протонной теории кислот и оснований, выдвинутой в 1923 г.
- 6. Протолитическая теория Брёнстеда -Лоури
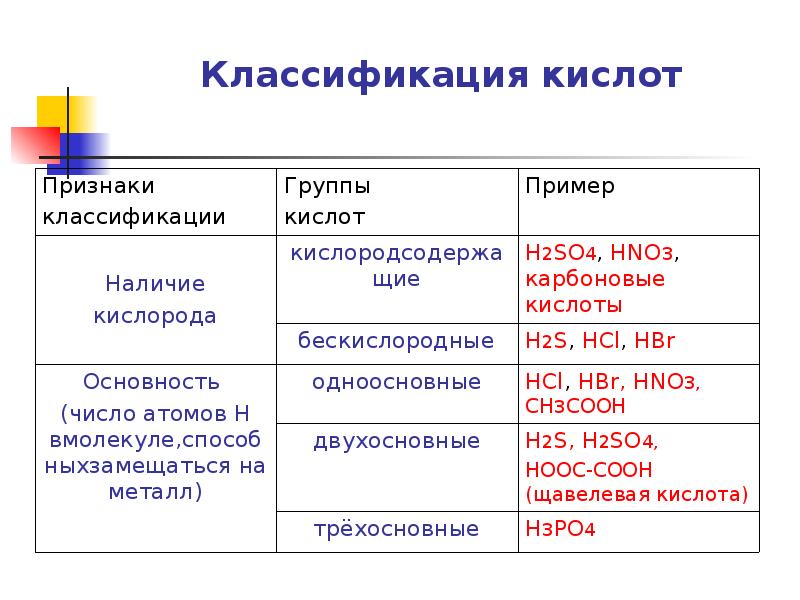
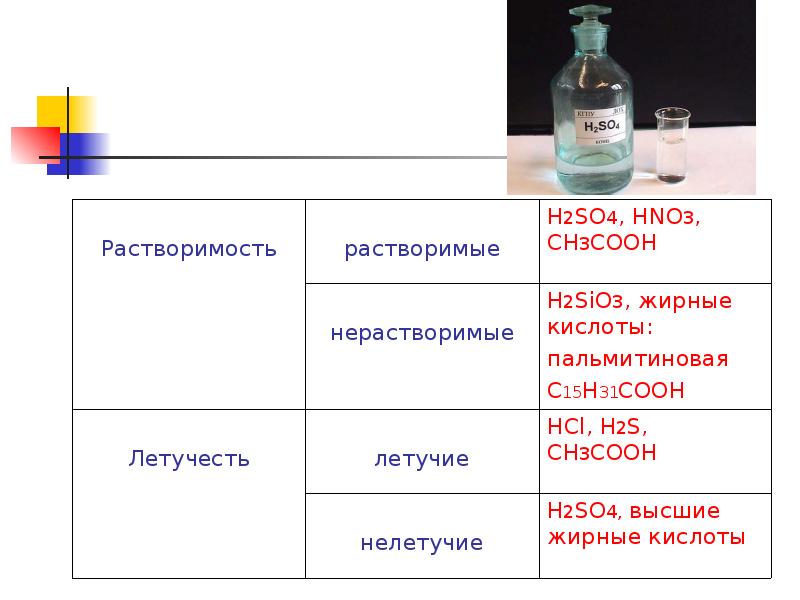
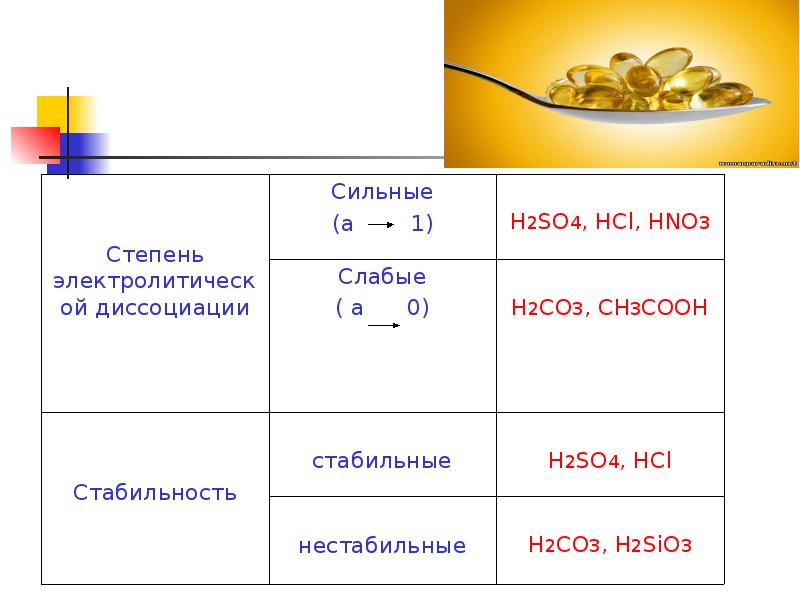
- 7. Классификация кислот
- 10. Свойства кислот Кислый вкус, действие на индикаторы (лакмус – красный,
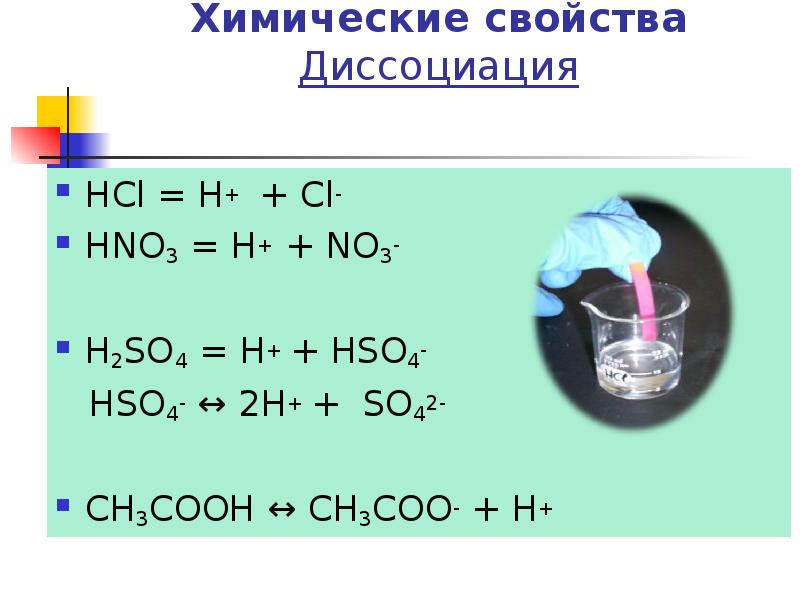
- 11. Химические свойства Диссоциация HCl = H+ + Cl- HNO3 = H+
- 12. Химические свойства Взаимодействие с металлами Металлы, стоящие в электрохимическом ряду напряжений
- 13. Химические свойства Взаимодействие с металлами H2SO4 (конц) и HNO3 любой концентрации
- 14. Химические свойства Взаимодействие с металлами Неметаллы и малоактивные металлы восстанавливают H2SO4
- 15. Химические свойства Взаимодействие с основными и амфотерными оксидами Взаимодействие с оксидами
- 16. Химические свойства Взаимодействие с основаниями: щелочами и амфотерными гидроксидами Взаимодействие со
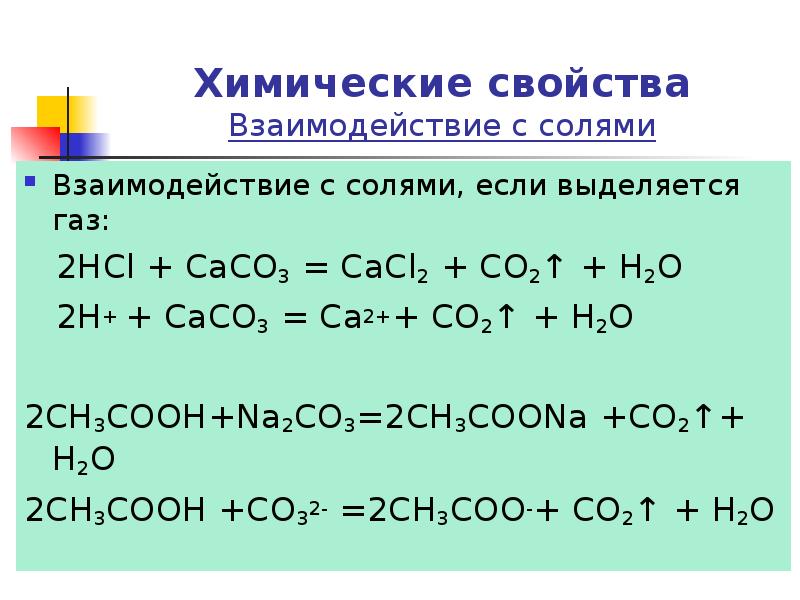
- 17. Химические свойства Взаимодействие с солями Взаимодействие с солями, если выделяется газ:
- 18. Химические свойства Взаимодействие с солями Взаимодействие с солями, если выпадает осадок
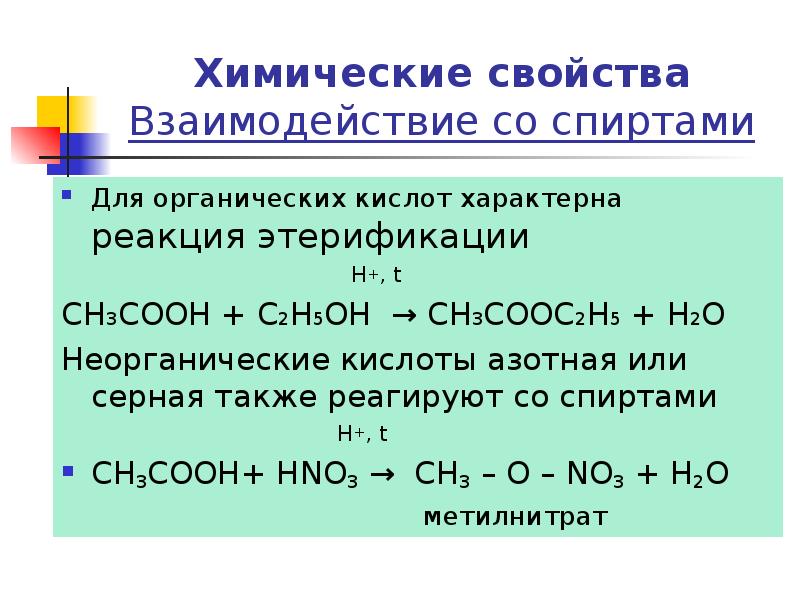
- 19. Химические свойства Взаимодействие со спиртами Для органических кислот характерна реакция этерификации
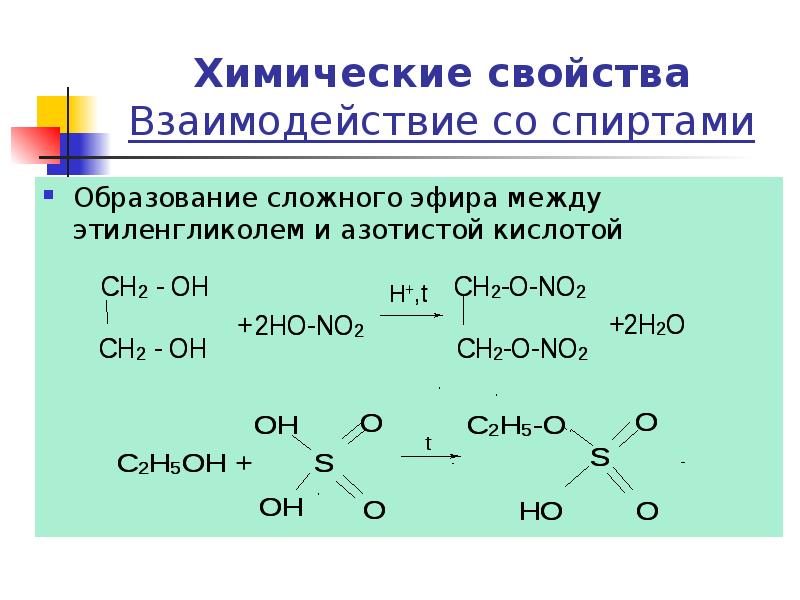
- 20. Химические свойства Взаимодействие со спиртами Образование сложного эфира между этиленгликолем и
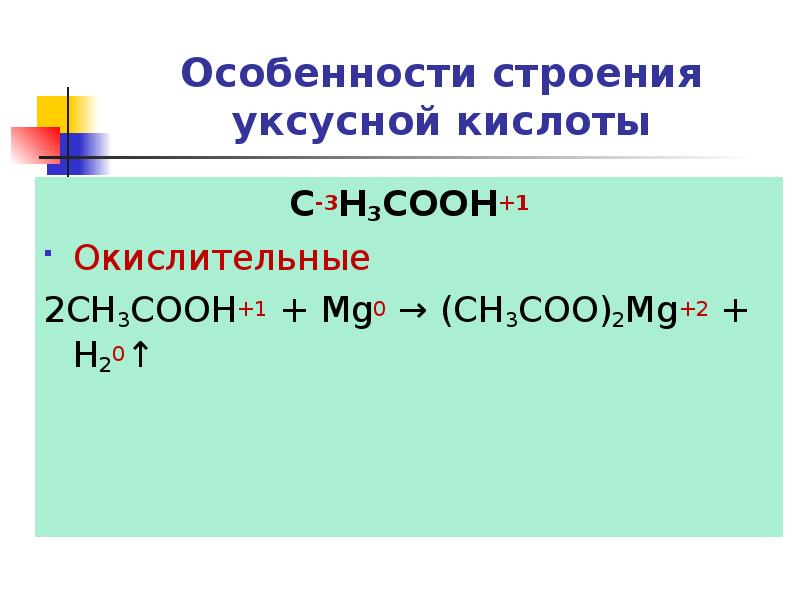
- 21. Особенности строения уксусной кислоты C-3H3COOH+1 Восстановительные
- 22. Особенности строения уксусной кислоты C-3H3COOH+1 Окислительные 2CH3COOH+1 + Mg0 → (СН3COO)2Mg+2
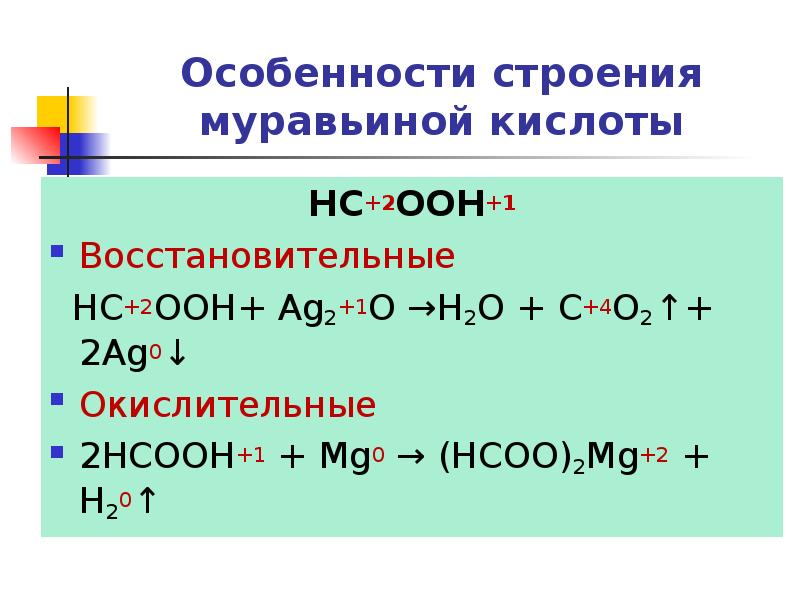
- 23. Особенности строения муравьиной кислоты HC+2OOH+1 Восстановительные HC+2OOH+ Ag2+1O →H2O + C+4O2↑+
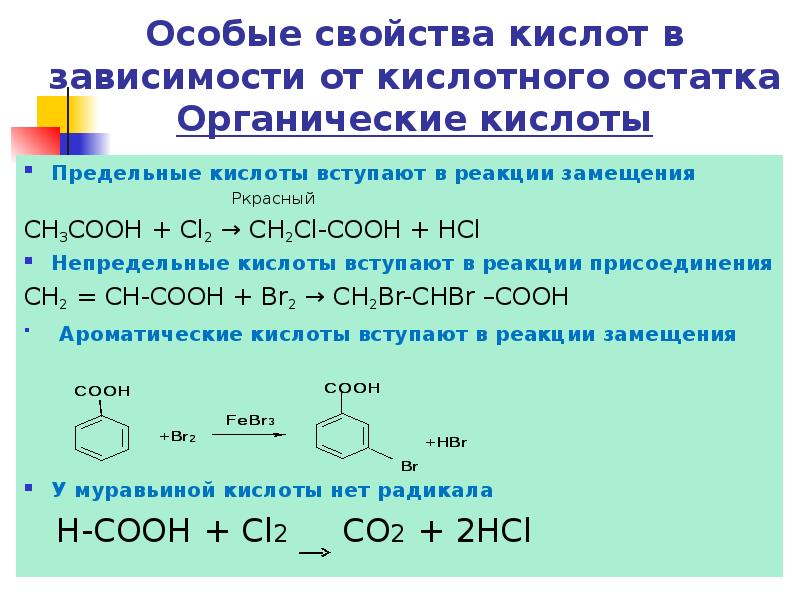
- 24. Особые свойства кислот в зависимости от кислотного остатка Органические кислоты Предельные
- 25. Особые свойства кислот в зависимости от кислотного остатка Неорганические кислоты Качественные
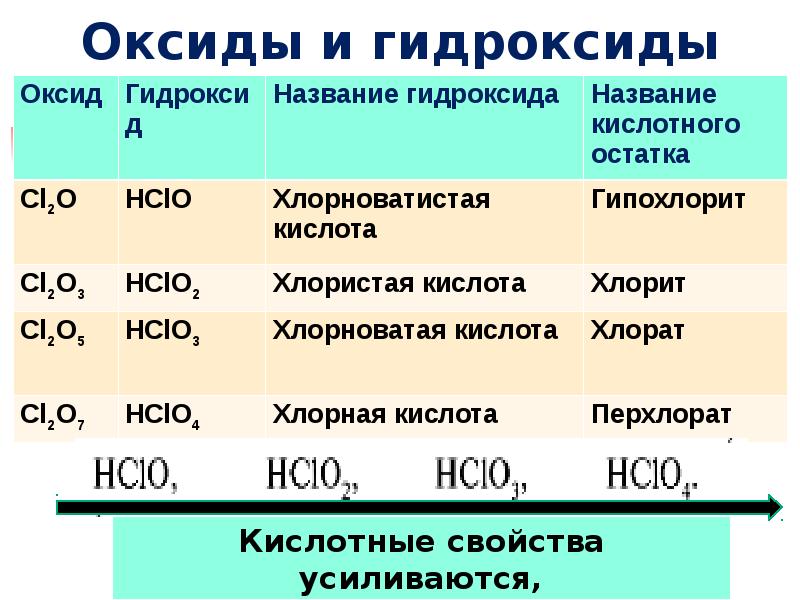
- 26. Оксиды и гидроксиды
- 27. Применение кислот
- 28. Домашнее задание: П.20, № 5,8,9
- 29. Спасибо за работу!
- 30. Скачать презентацию

















Слайды и текст этой презентации
Скачать презентацию на тему Кислоты органические и неорганические можно ниже:
Похожие презентации





























