ХИМИЧЕСКАЯ КИНЕТИКА презентация
Содержание
- 2. План лекции 1. Основные понятия 2. Классификация процессов 3. Скорость химической
- 3. Химическая кинетика - раздел химии, изучающий скорость и механизмы химических реакций
- 4. Классификация процессов по фазовому составу 1) гомогенные - протекающие по всему
- 5. Классификация по механизму реакции Механизм реакций - совокупность элементарных стадий слагающих
- 6. Молекулярность реакций По числу молекул одновременно участвующих в хим. превращении простые
- 7. Сложные реакции делятся по механизму на: Сложные реакции делятся по механизму
- 8. Цепные - неразветвленные р-ции Это реакции, в которых возникают промежуточные активные
- 9. Цепные - разветвленные реакции Н2 + 0,5О2 = Н2О Зарождение цепи:
- 10. Лимитирующая стадия это самая медленная стадия в сложном процессе и скорость
- 11. Скорость химической реакции это число элементарных актов взаимодействия, происходящих в единицу
- 12. Скорость как функция изменения концентрации Взаимодействия атомов и молекул фиксировать невозможно,
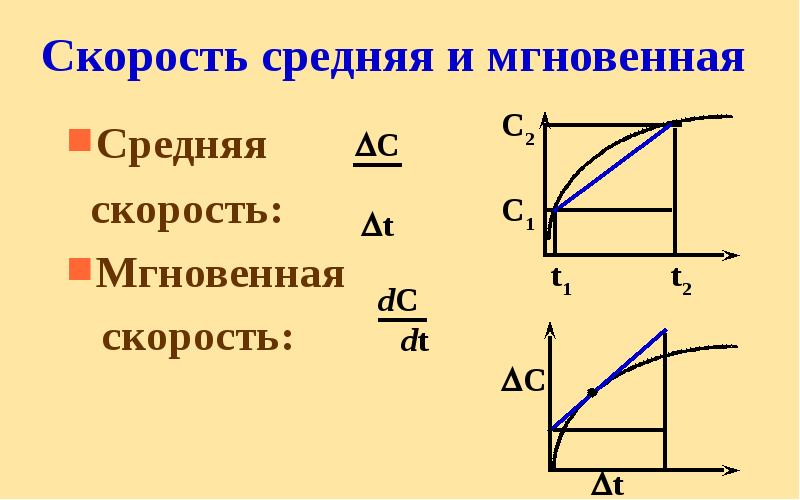
- 13. Скорость средняя и мгновенная Средняя скорость:
- 14. Для реакции в общем виде скорость химической реакции с учетом стех-ких
- 15. Общая закономерность Скорость химической реакции, проводимой без добавления реагентов извне, максимальна
- 16. Реакции, скорость которых постоянна: Реакции, скорость которых постоянна: Автокаталитические реакции -
- 17. Факторы, влияющие на скорость реакции Природа Концентрация веществ Температура Катализаторы
- 18. Влияние природы и концентрации реагентов на скорость реакций Закон действующих масс
- 19. В общем случае: В общем случае: aA + bB + dD
- 20. Кинетическое уравнение Для простой реакции: аА + bВ = сС
- 21. Пример записи кинетического уравнения простой реакции 1) C2H5OH = C2H4 +
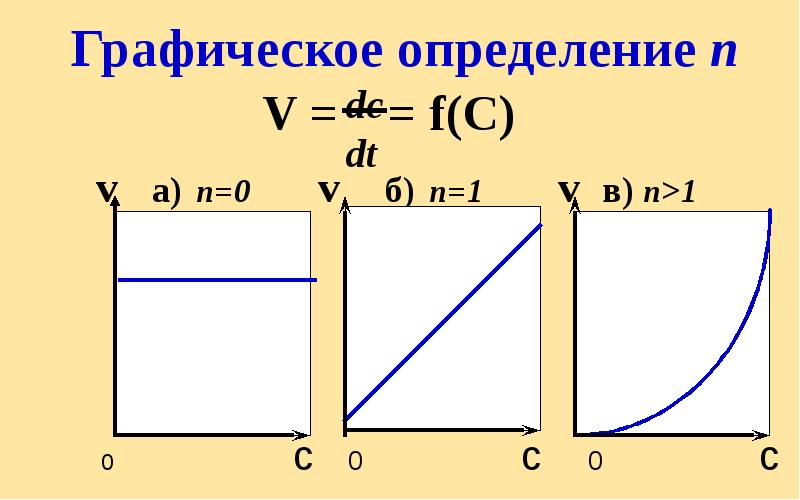
- 22. V = = f(С) v а) n=0 v
- 23. Кинетическое уравнение сложной реакции аА + bВ=сС + dD V
- 24. Пример: Реакцию 2H2(г) + O2(г) = 2H2O(г) провели при одном давлении,
- 25. Константа скорости реакции Физ. смысл k вытекает из V = k
- 26. Период полупревращения Время полупревращения (t1/2) для реакций называют периодом полураспада (не
- 27. Скорость гетерогенных реакций зависит от удельной поверхности и концентраций реагентов в
- 28. Уд. поверхность по ходу реакции мало изменяется , поэтому ее объединяют
- 29. Константа равновесия с позиции кинетики Для простой обратимой реакции: аА+bВ
- 30. Зависимость скорости от температуры (Правило Вант-Гоффа) При увеличении температуры на 10
- 31. Теория активации Аррениуса Хим. реакция может происходить только при столкновении активных
- 32. Энергия активации (Еа, кДж/моль) – это избыточный запас энергии молекулы
- 33. Cогласно молекулярно-кинетической теории газов для каждой системы существует порог энергии Еа
- 34. Еа - велика, скорость реакции – мала Еа - велика, скорость
- 35. ПРЕДЭКСПОНЕНТА И ЭКСПОНЕНТА Предэкспоненциальный множитель (А) дает некоторую характеристику полного числа
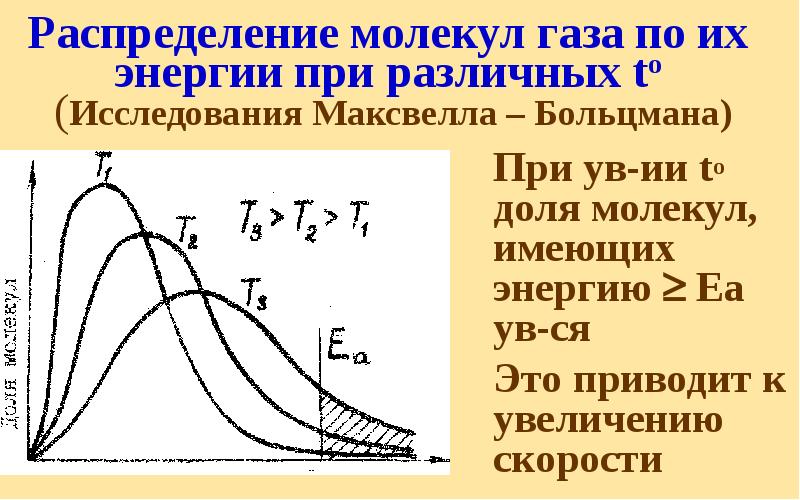
- 36. Распределение молекул газа по их энергии при различных to (Исследования Максвелла
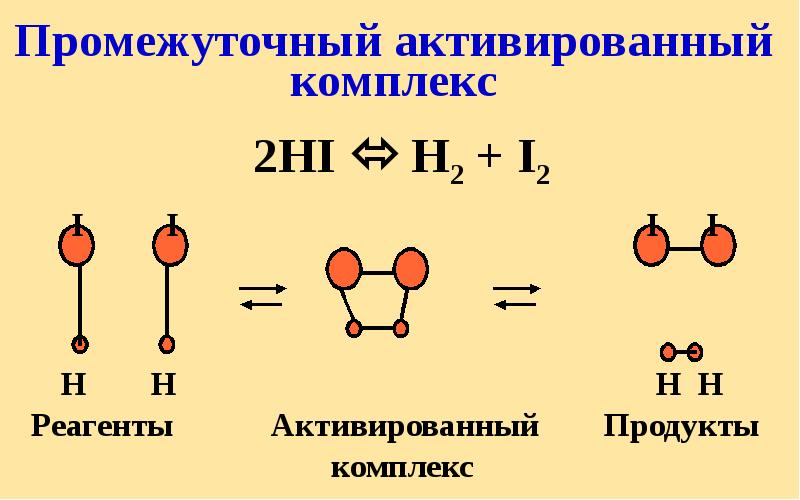
- 38. Промежуточный активированный комплекс
- 39. Определение энергии активации
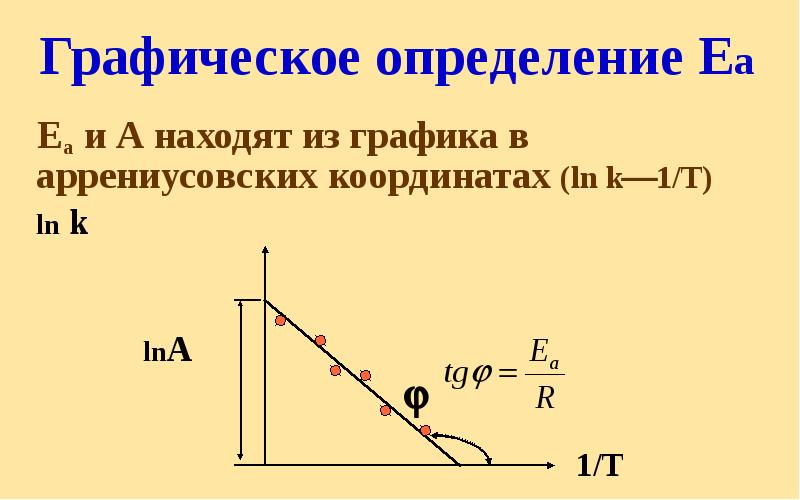
- 40. Графическое определение Еа Еа и А находят из графика в
- 41. Способы активации молекул термический светом ионизирующее излучение ,
- 42. Катализ
- 43. Катализ – это явление ускорения реакции под действием веществ не расходующихся
- 44. Катализатор – это вещество, которое многократно участвует в промежуточных стадиях реакции,
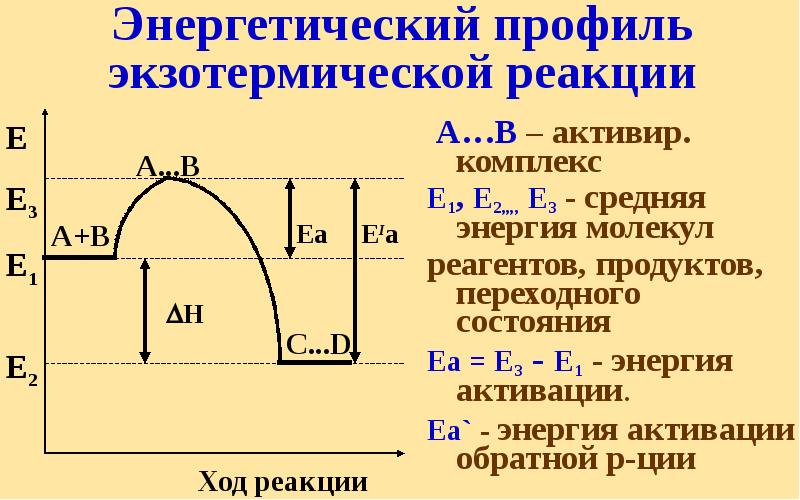
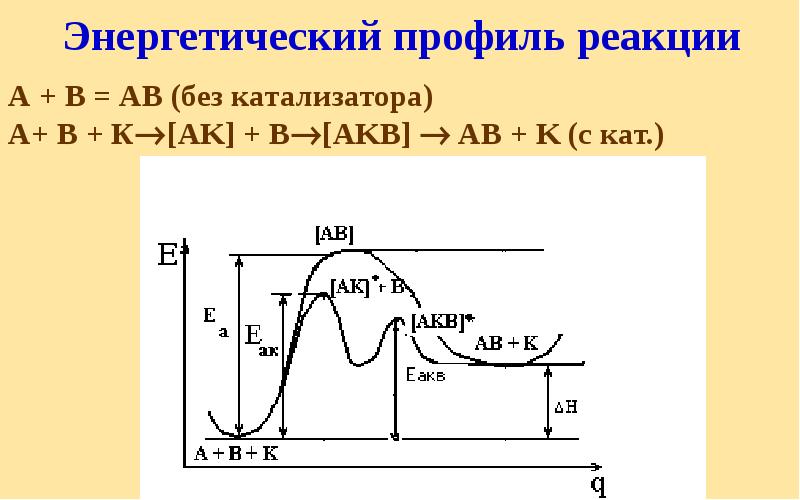
- 45. Энергетический профиль реакции А + В = АВ (без катализатора) А+
- 46. 2HI = H2+ I2; Еа=184 кДж/моль Еак = 69 кДж/моль
- 47. Гомогенный катализ (кат-р и реагент образуют одну фазу) Пример: получение
- 48. Гетерогенный катализ Получение H2SO4 с помощью Pt кат-ра SO2 (г) +
- 49. Скачать презентацию









































Слайды и текст этой презентации
Похожие презентации





























