ПОДГРУППА КИСЛОРОДА презентация
Содержание
- 2. Кислород (O2) Кислород (лат. Oxygenium) — химический элемент главной подгруппы VI группы, второго
- 3. Нахождение в природе O2 Кислород — самый распространённый в земной коре элемент,
- 4. Получение O2 В настоящее время в промышленности кислород получают из воздуха.
- 5. Физические свойства 1 л кислорода имеет массу 1,429 г. Немного тяжелее воздуха. Слабо
- 6. Химические свойства Сильный окислитель, взаимодействует со всеми элементами, кроме гелия, неона,
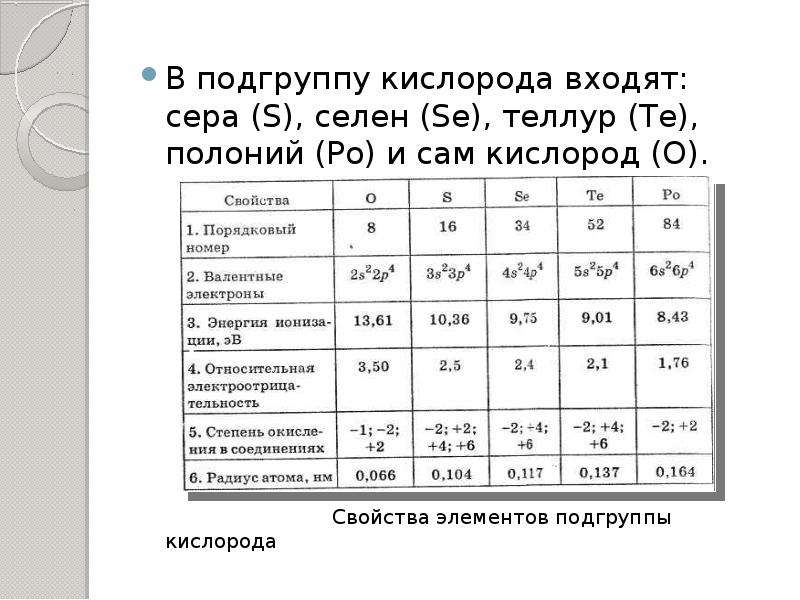
- 7. В подгруппу кислорода входят: сера (S), селен (Se), теллур (Te), полоний
- 8. Сера (S) Се́ра — химический элемент главной подгруппы VI группы, третьего периода периодической системы
- 9. Селен (Se) Селе́н — химический элемент главной подгруппы VI группы, 4-го периода в периодической системе,
- 10. Теллур (Te) Теллу́р — химический элемент главной подгруппы VI группы, 5-го периода в периодической системе,
- 11. Полоний (Po) Поло́ний — химический элемент главной подгруппы VI группы, 6-го периода в периодической системе Д. И. Менделеева,
- 12. Посмотрите презентацию «Кислород и озон», перейдя по ссылке https://infourok.ru/prezentaciya-po-himii-kislorod-i-ozon-2760139.html
- 13. Скачать презентацию











Слайды и текст этой презентации
Похожие презентации





























