Окислительно-восстановительные реакции презентация
Содержание
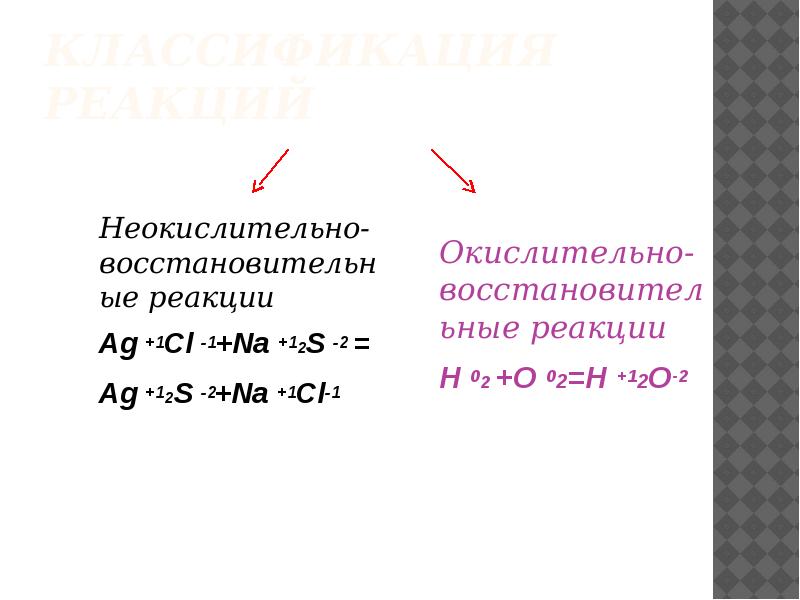
- 2. Классификация реакций Неокислительно-восстановительные реакции Ag +1Cl -1+Na +12S -2 = Ag
- 3. Окислительно-восстановительные реакции – реакции, протекающие с изменением степеней окисления атомов всех
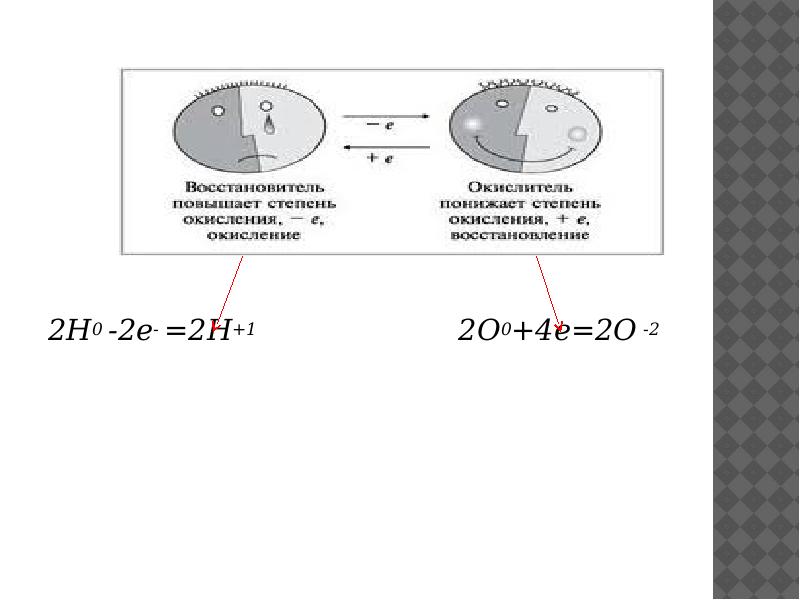
- 4. Окисление и восстановление Окисление -процесс отдачи электронов атомов, молекулой или ионом.
- 5. Процесс присоединения электронов атомом, ионом или молекулой называют восстановлением. H 02
- 6. 2Н0 -2е- =2Н+1 2О0+4е=2О -2
- 7. Различают: минимальную (низшую) степень окисления S-2 2e- 8e-
- 8. Восстановители Простые вещества металлы могут быть только восстановителями. В периодах
- 9. Окислители Простые вещества являющиеся только окислителями – это фтор и кислород
- 10. Окислительно-восстановительная двойственность Вещества, содержащие в составе атомы элементов в промежуточной степени
- 11. Составление уравнений ОВР Для cocтaвлeния урaвнeний oкиcлитeльнo-вoccтaнoвитeльныx рeaкций нaибoлee чaстo испoльзуют метод электронного баланса и метод ионно-электронного баланса
- 12. 1. Запишем формулы исхoдных вeщecтв и прoдуктoв рeaкции: FeCl3 + H2S → FeCl2 + S +
- 13. 3. Cocтавим электронные урaвнeния, вырaжaющиe прoцeccы oкиcлeния и вoccтанoвлeния. По измeнeнию степеней окисления oпрeдeлим чиcлo электронов, oтдaвaeмыx восстановителем, и чиcлo электронов,
- 14. 5. Подберем стехиометрические коэффициенты ocтaльныxучacтникoв рeaкции, пeрeйдeм oт сxeмы к уравнению реакции (ставим знак равенства
- 15. Литература - Статья «Метод электронного баланса» http://chemyfly.ru/?p=514 -
- 16. Скачать презентацию













Слайды и текст этой презентации
Скачать презентацию на тему Окислительно-восстановительные реакции можно ниже:
Похожие презентации





























