Общие свойства металлов презентация
Содержание
- 3. Георг Агрикола (ученый XVI века) писал: Человек не может обойтись без
- 4. Общие физические свойства металлов Металлический блеск
- 5. Общие физические свойства металлов Электропроводность и теплопроводность
- 6. Общие физические свойства металлов Пластичность
- 7. Общие физические свойства металлов Твердость
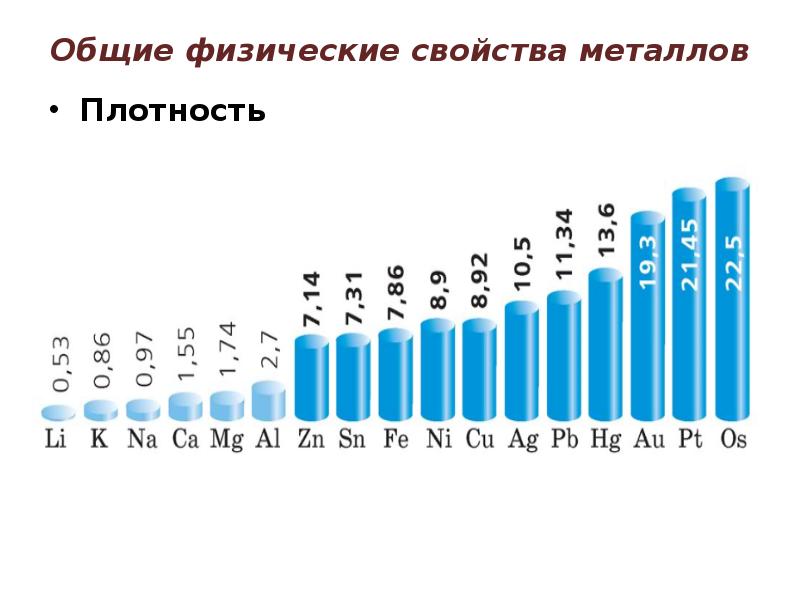
- 8. Общие физические свойства металлов Плотность
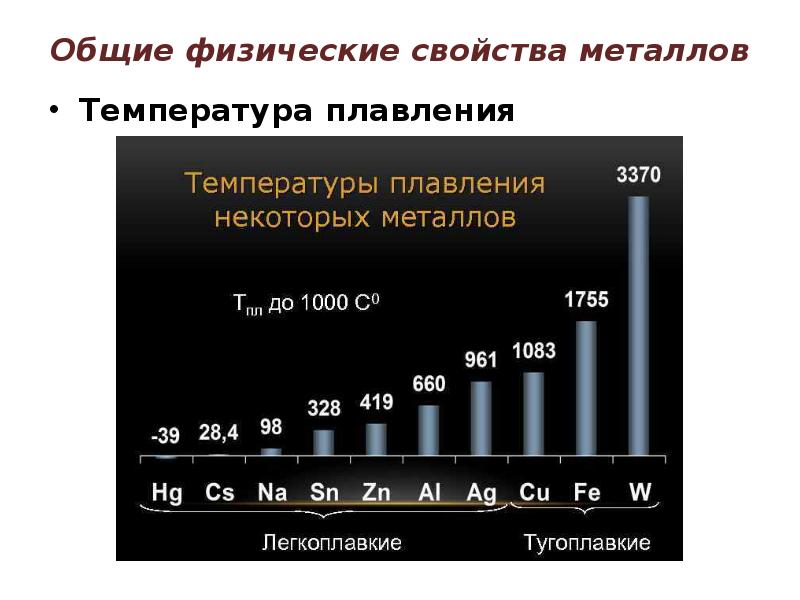
- 9. Общие физические свойства металлов Температура плавления
- 10. Общие физические свойства металлов Цвет
- 11. Строение металлов В электронной оболочке атомов металлов на внешнем энергетическом уровне,
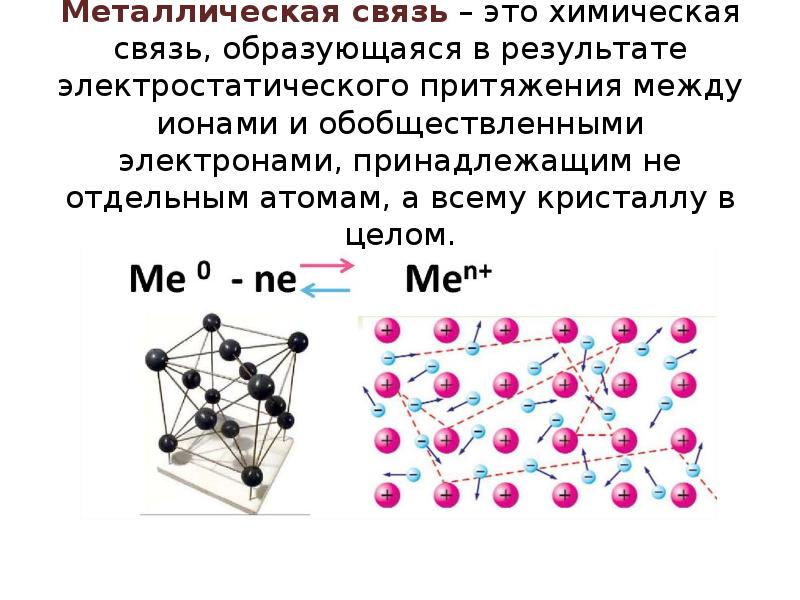
- 12. Металлическая связь – это химическая связь, образующаяся в результате электростатического притяжения
- 13. Общие химические свойства металлов Металл является более сильным восстановителем, чем он
- 14. Общие химические свойства металлов Химические реакции металлов с неметаллами (простыми веществами): с
- 15. Общие химические свойства металлов Химические реакции металлов с сложными веществами: металлы
- 16. Металлы в природе В свободном виде в природе присутствуют наименее активные
- 17. Металлы в природе Остальные металлы, не имеющие "благородного" происхождения, т.к. являются
- 18. Получение металлов Любой современный металлургический процесс заключается в восстановлении ионов металла, с
- 19. Получение металлов Гидрометаллургия - получение металлов из раствора соли металла путем вытеснения
- 20. Получение металлов Электрометаллургия - получение металлов электролизом растворов (расплавов) их соединений (роль
- 21. 3. С какими из перечисленных веществ: О2, S, Cl2, Н2, Н2O,
- 22. 4. Напишите уравнения химических реакций, с помощью которых можно осуществить следующие
- 23. 5. Допишите сокращённые ионные уравнения химических реакций. 2Al + 6H+ →
- 24. 10. Вычислите массу углерода, необходимую для полного восстановления 200 кг железной
- 25. Скачать презентацию




















Слайды и текст этой презентации
Похожие презентации





























