Железо презентация
Содержание
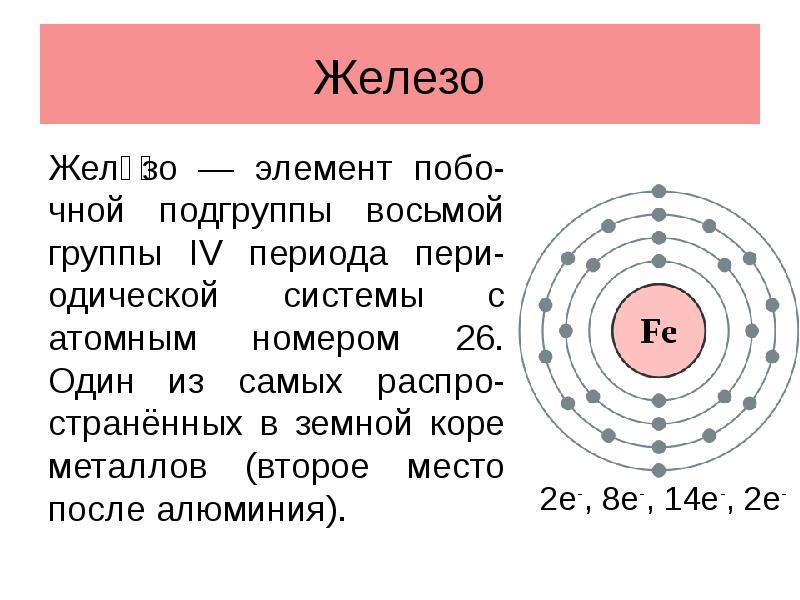
- 2. Железо Желе́зо — элемент побо-чной подгруппы восьмой группы IV периода пери-одической
- 3. Железо – переходный металл Переменные степени окисления. Железо имеет 4 с.о.:
- 4. Нахождение в природе красный железняк (гематит, Fe2O3; содержит до 70 %
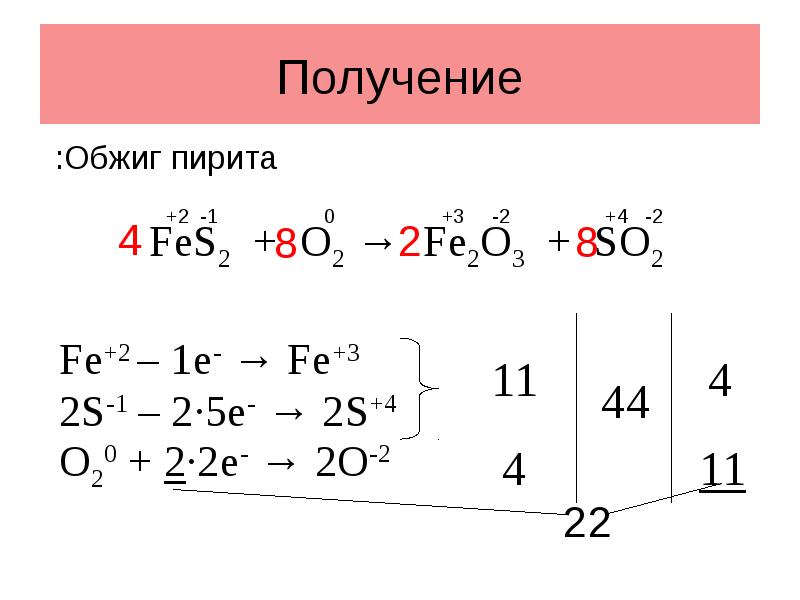
- 5. Получение Первый этап производства — восстановление железа углеродом в доменной печи
- 6. Получение В свою очередь, монооксид углерода восстанавливает железо из руды. Чтобы
- 7. Получение Fe+2 – 1e- → Fe+3 2S-1 – 2·5e- → 2S+4
- 8. Физические свойства Железо — типичный металл, в свободном состоянии — серебристо-белого
- 9. Химические свойства С кислородом железо реагирует при нагревании. при сгорании
- 10. Химические свойства Железо при нагревании реагирует с галогенами. Fe +
- 11. Химические свойства С соляной и разбавленной серной кислотами железо реагирует с
- 12. Соединения железа Гидроксид железа(III) слабо амфотерен: он реагирует с кислотами:
- 13. Качественные реакции Качественные реакции на железо (II): 2K3[Fe(CN)6] + 3FeSO4 =
- 14. Железо(II)
- 15. Качественные реакции Качественные реакции на железо (III): FeCl3 + NaOH =
- 16. Качественные реакции
- 17. Вопросы Какие степени окисления характерны для железа? На внешнем уровне Fe
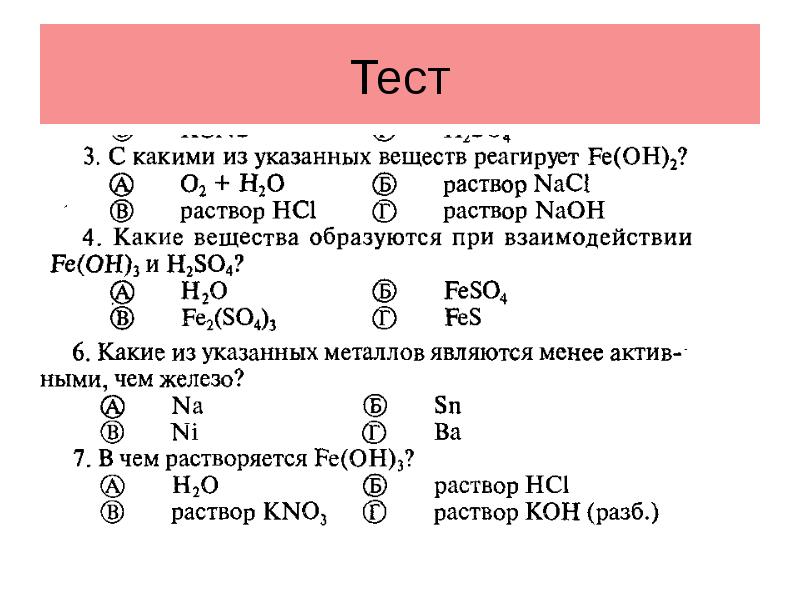
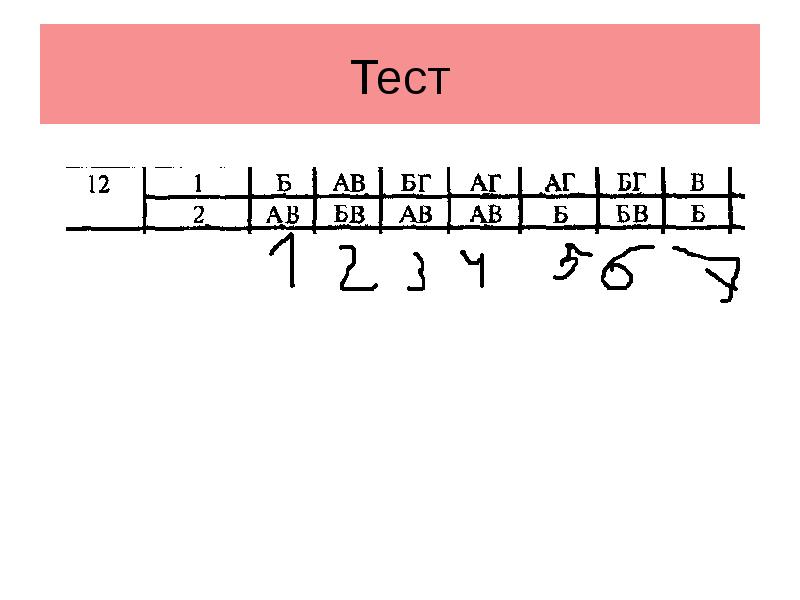
- 18. Тест
- 19. Тест
- 20. Тест
- 21. Тест
- 22. Скачать презентацию










![Качественные реакции
Качественные реакции на железо (II):
2K3[Fe(CN)6] + 3FeSO4 = Качественные реакции
Качественные реакции на железо (II):
2K3[Fe(CN)6] + 3FeSO4 =](/documents_7/ce5406d5b66bb21864f7ced3c44ec2d2/img12.jpg)






Слайды и текст этой презентации
Похожие презентации





























