Реакции ионного обмена презентация
Содержание
- 2. Реакции между ионами называют ионными реакциями, а уравнения таких реакций –
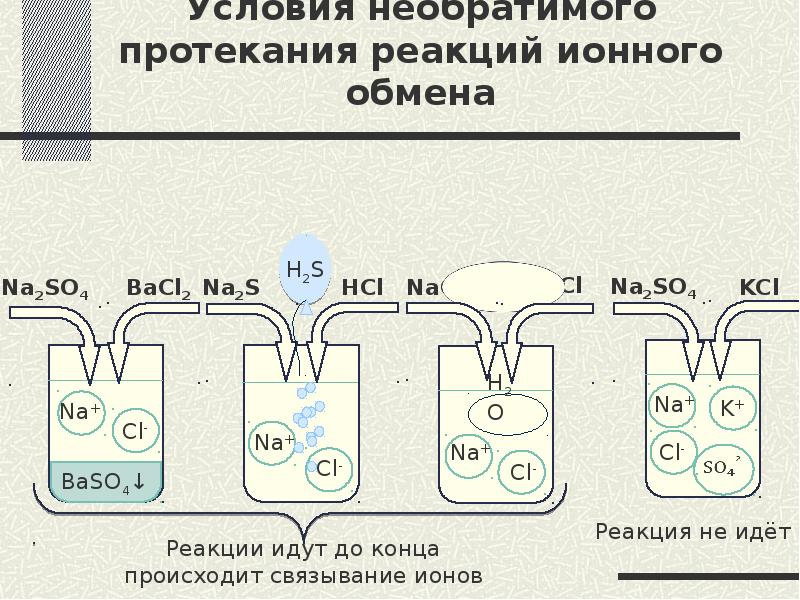
- 3. Условия необратимого протекания реакций ионного обмена
- 4. Правила составления ионных уравнений При составлении ионных уравнений следует
- 5. Правила составления ионных уравнений Сокращённое ионное уравнение – это
- 6. Правила составления ионных уравнений
- 7. Правила составления ионных уравнений Пример: Взаимодействие сульфата натрия с
- 8. Правила составления ионных уравнений Пример: Взаимодействие серной кислоты с
- 9. Примеры реакций ионного обмена Молекулярное уравнение реакции щелочи с кислотой:
- 10. Примеры реакций ионного обмена Молекулярное уравнение реакции основного оксида с
- 11. Примеры реакций ионного обмена Молекулярное уравнение реакции растворимой соли со
- 12. Примеры реакций ионного обмена Молекулярное уравнение реакции двух растворимых солей: Al2(SO4)3 +
- 13. Примеры реакций ионного обмена Молекулярное уравнение реакции растворимой соли (сульфида)
- 14. Примеры реакций ионного обмена Молекулярное уравнение реакции растворимой соли (карбоната) с
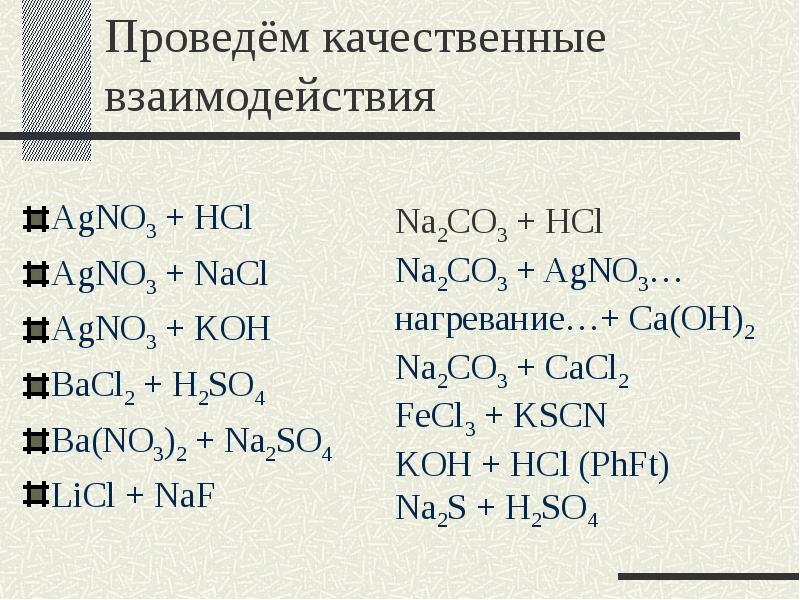
- 15. Проведём качественные взаимодействия AgNO3 + HCl AgNO3 + NaCl AgNO3 +
- 16. Практическая часть Запишите уравнения реакций (также ПИО и СИО) и проведите
- 17. Скачать презентацию














Слайды и текст этой презентации
Похожие презентации





























