Скорость химических реакций презентация
Содержание
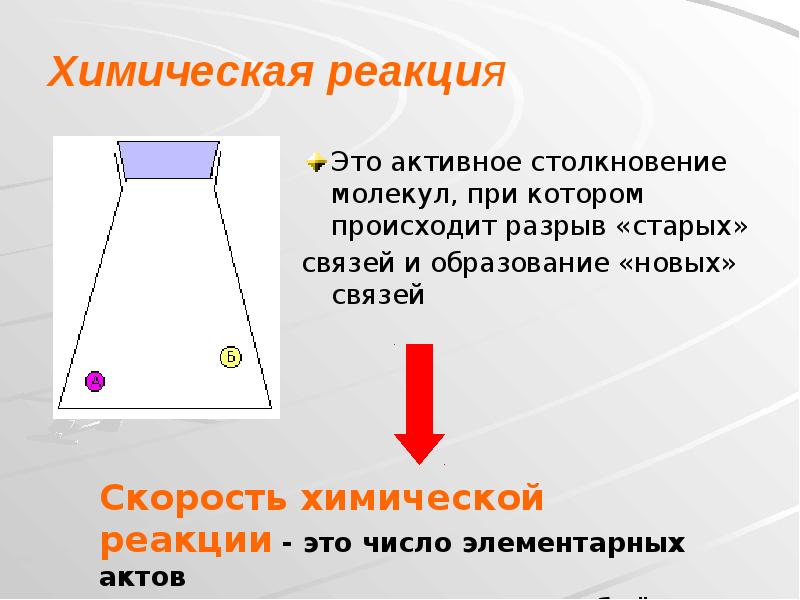
- 2. Химическая реакция Это активное столкновение молекул, при котором происходит разрыв «старых»
- 4. Формулы для расчета скорости реакции
- 5. Химическая реакция протекает в растворе, согласно уравнению: Химическая реакция протекает
- 6. Решение: Дано: С(А) = 0,80 моль/л; С(А1) = 0,74 моль/л; Δt
- 7. Факторы, влияющие на скорость реакции Природа реагирующих веществ Площадь поверхности твердого
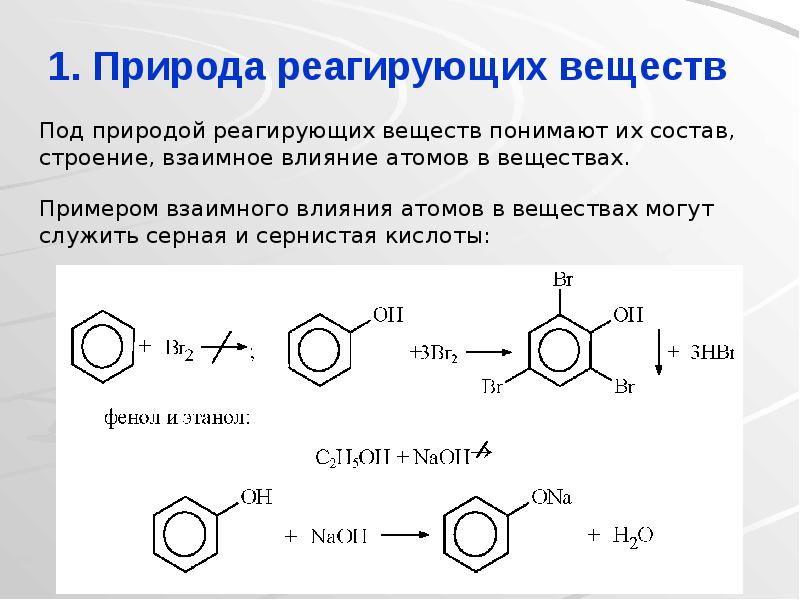
- 8. 1. Природа реагирующих веществ Под природой реагирующих веществ понимают их
- 9. 2. Площадь поверхности твердого вещества
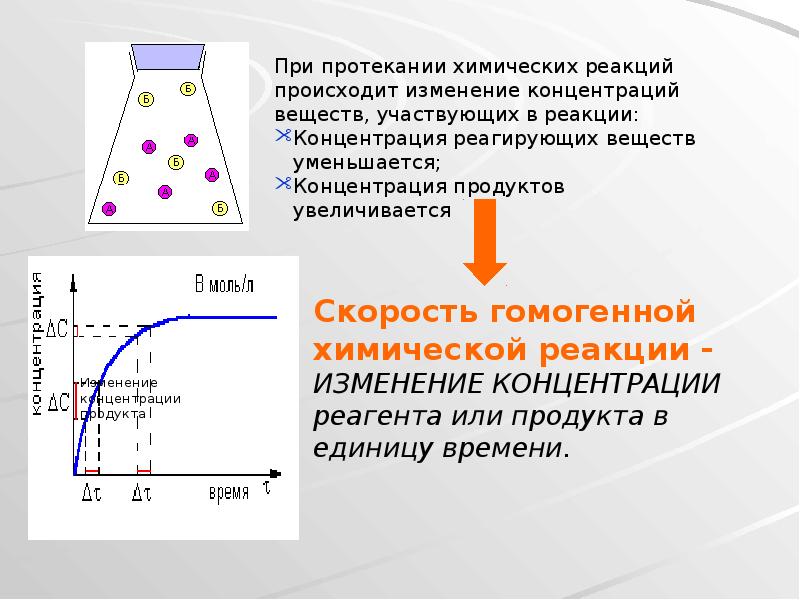
- 10. 3. Концентрация реагирующих веществ
- 11. 4. Влияние температуры Правило Вант-Гоффа: При повышении
- 12. 5. Катализатор Катализаторами называются вещества, которые влияют на скорость реакции, но
- 13. Закон действующих масс Н.И. Бекетов Скорость химической реакции пропорциональна произведению концентраций
- 14. Теория активации Выводы: 1. Повышение температуры усиливает скорость движения
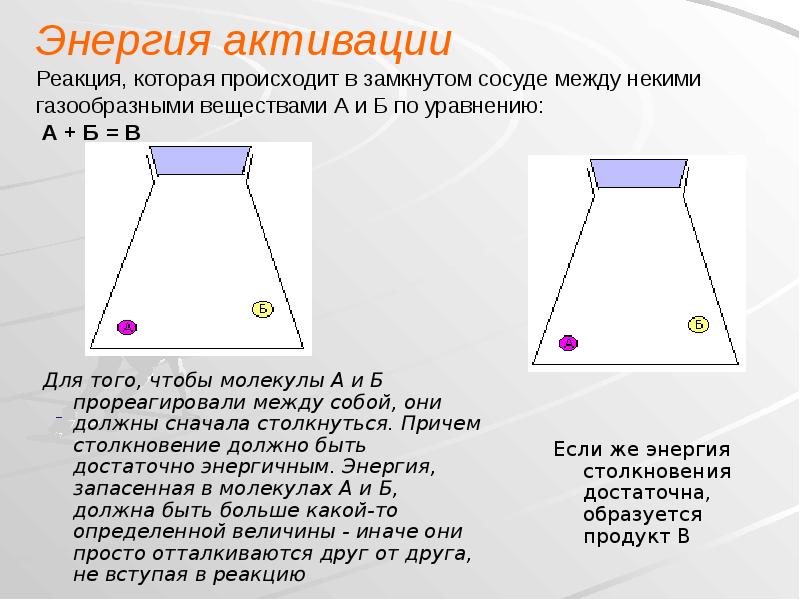
- 15. Энергия активации Реакция, которая происходит в замкнутом сосуде между некими газообразными
- 16. Примеры химических реакций Необратимые х.р. Na2SO4 +BaCl2 BaSO4 ↓+
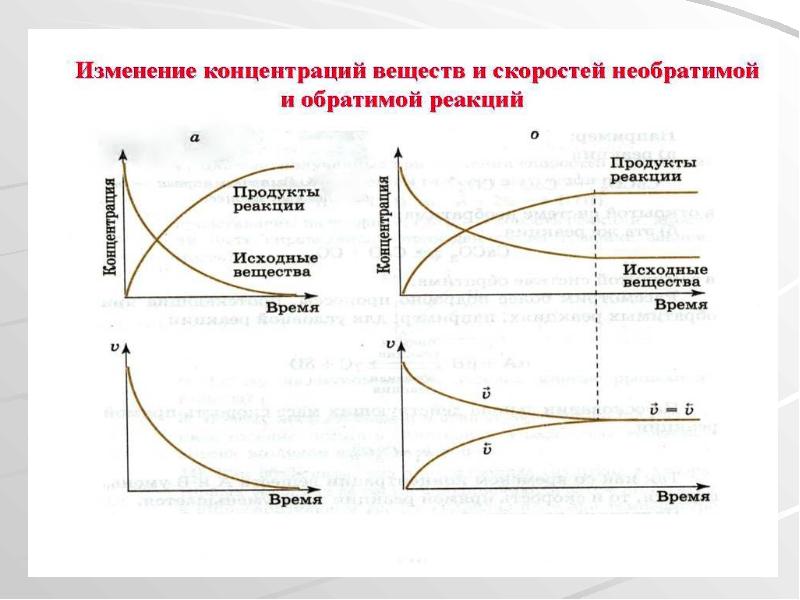
- 17. Химическое равновесие Обратимая химическая реакция H2 + I2 ↔ 2HI По
- 19. Переход системы из одного состояния равновесия в другое называется смещением химического
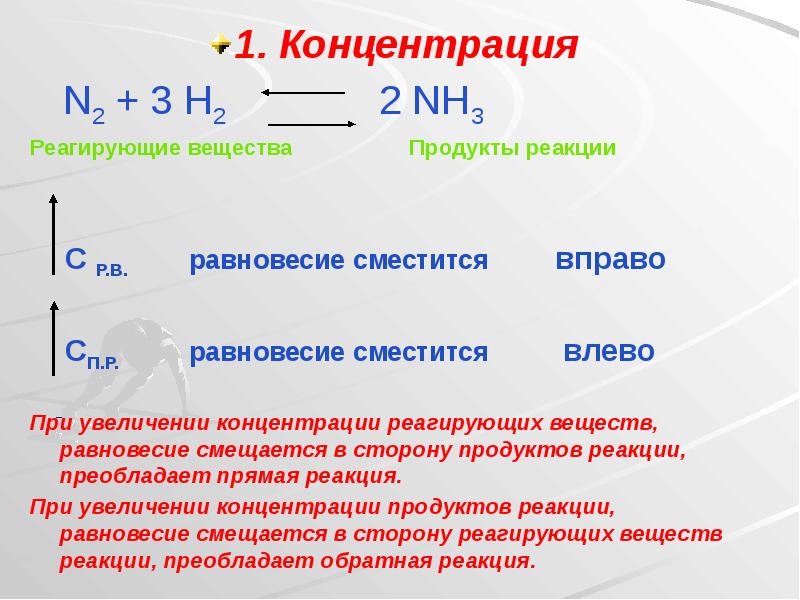
- 20. 1. Концентрация 1. Концентрация N2 + 3 H2
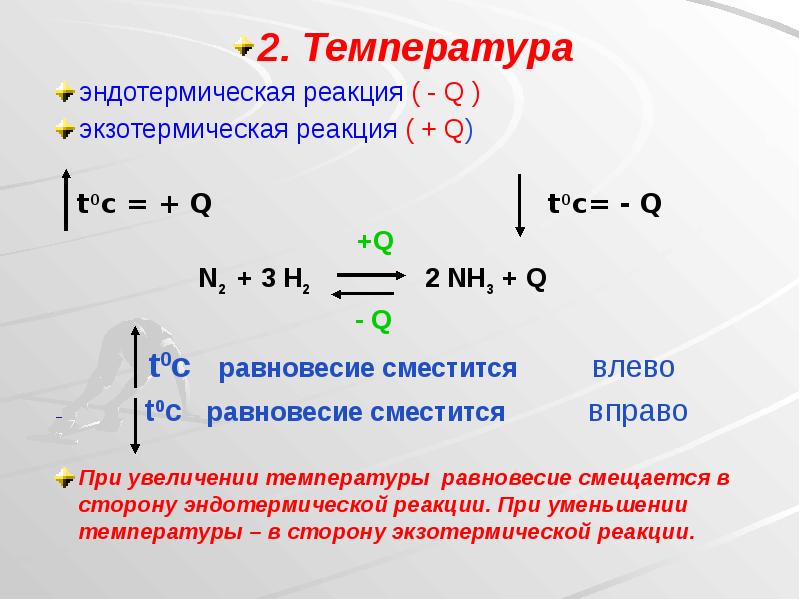
- 21. 2. Температура 2. Температура эндотермическая реакция ( - Q ) экзотермическая
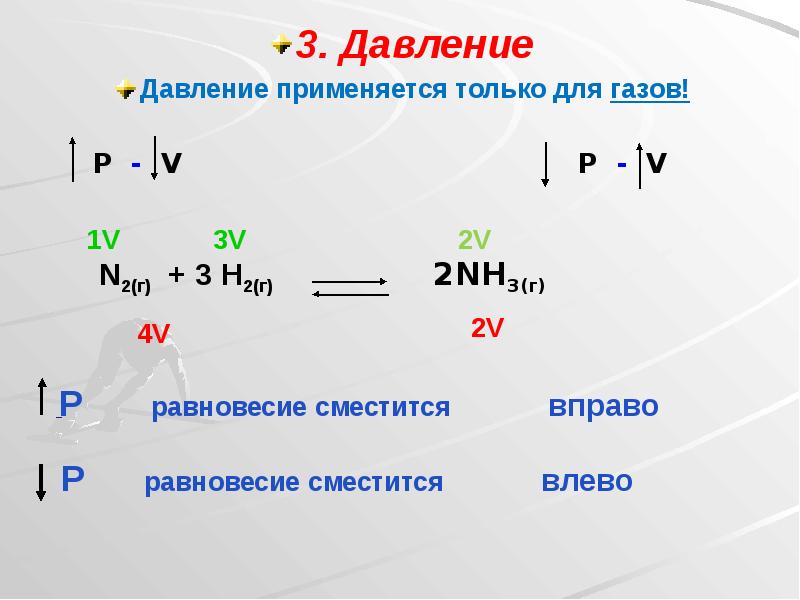
- 22. 3. Давление 3. Давление Давление применяется только для газов!
- 23. При увеличения давления равновесие смещается в сторону той реакции, при которой
- 24. Обобщение и выводы: Обобщение и выводы: Химические реакции протекают с различными
- 25. Скачать презентацию
















Слайды и текст этой презентации
Похожие презентации





























